代谢工程方法改造谷氨酸棒状杆菌生产乙偶姻
2014-06-05马红武刘会娟朱年青
马红武,刘会娟,朱年青,陈 涛
代谢工程方法改造谷氨酸棒状杆菌生产乙偶姻
马红武1,2,刘会娟1,朱年青1,陈 涛1
(1. 天津大学化工学院,天津 300072;2. 中科院天津工业生物技术研究所,天津 300308)
应用代谢工程方法对Corynebacterium glutamicum ATCC 13032生物合成乙偶姻进行了研究.在C. glutamicum ATCC 13032中导入了Bacillus subtilis 168的乙偶姻合成途径的相关基因alsSD操纵子,工程菌株的乙偶姻产量为2.14,g/L.为了增加合成乙偶姻的直接前体物丙酮酸的供给,进一步敲除了丙酮酸脱氢酶复合体E1亚基的编码基因(aceE)和乳酸脱氢酶基因(ldhA),工程菌株的乙偶姻产量提高到5.09,g/L.最后,敲除了工程菌株的2,3-丁二醇脱氢酶基因(butA)以阻断副产物2,3-丁二醇的合成,在优化的溶氧条件下,菌株CGL3在基本培养基中乙偶姻产量提高到8.33,g/L,达到理论得率的51.5%.实验结果表明经过代谢工程改造的C. glutamicum ATCC 13032具有良好的乙偶姻合成能力和应用潜力.
代谢工程;乙偶姻;谷氨酸棒状杆菌;乙酰乳酸合成酶;乙酰乳酸脱羧酶
乙偶姻,又名3-羟基-2-丁酮,作为一种重要的高附加值化合物,在食品、医药及化妆品等行业都有重要用途,美国能源部曾将其列为30种优先开发利用的化合物之一.
自然界中多种微生物能够生产乙偶姻,研究较多的是克雷伯氏菌属(Klebisella)、肠杆菌属(Enterobacter)等[1].由于这些菌种属于病原菌或条件病原菌,大规模工业化生产应用有一定风险,而谷氨酸棒状杆菌是氨基酸工业生产中广泛应用的安全性革兰氏阳性菌[2].传统的育种方式主要是诱变育种,目前基因组改组技术和代谢工程方法在菌种选育领域受到高度重视[3].
C. glutamicum ATCC 13032生长迅速,在有氧发酵培养时可以获得较高菌体密度,底物消耗速率快,从而可以获得较为理想的产物生产率.失活C. glutamicum ATCC 13032丙酮酸脱氢酶复合体E1亚基(aceE)[4]或敲除乳酸脱氢酶编码基因(ldhA)[5]均能够提高细胞积累丙酮酸的能力.合成乙偶姻的前体物是丙酮酸,所以谷氨酸棒状杆菌比较适合作为生物合成乙偶姻的生产菌.
笔者通过代谢工程方法改造谷氨酸棒状杆菌C. glutamicum ATCC 13032使其生产乙偶姻,首先在C. glutamicum ATCC 13032中表达B. subtilis 168乙偶姻合成途径alsSD操纵子,得到乙偶姻生产菌株CGL1;进而敲除丙酮酸脱氢酶复合体E1亚基基因和乳酸脱氢酶基因得到菌株CGL2,提高乙偶姻的碳源得率;进一步失活乙偶姻消耗途径,敲除2,3-丁二醇脱氢酶基因(butA)得到菌株CGL3;最终结合初步的培养条件研究,使得菌株CGL3在基本培养基中乙偶姻产量提高到8.33,g/L,达到理论得率的51.5%,论文结果有一定理论意义.
1 材料与方法
1.1 材 料
1.1.1 菌株和质粒
菌株和质粒见表1.

表1 菌株和质粒Tab.1 Strains and plasmids
1.1.2 培养基
LB培养基:蛋白胨10,g/L,酵母粉5,g/L,氯化钠10,g/L,pH 7.0,相应的固体培养基中添加20,g/L的琼脂粉,需要时添加25,µg/mL卡那霉素.
BHIS培养基:脑心浸粉37,g/L,山梨醇91,g/L.
CGIII培养基:蛋白胨10,g/L,酵母粉10,g/L,氯化钠2.5,g/L.
CGXII发酵培养基:(NH4)2SO4(5,g/L),尿素(5,g/L),KH2PO4(1,g/L),K2HPO4(1,g/L),MgSO4· 7H2O(0.25,g/L),CaCl2(10,mg/L),FeSO4·7,H2O (10,mg/L),MnSO4·H2O(0.1,mg/L),ZnSO4·7,H2O (1,mg/L),CuSO4·5,H2O(0.2,mg/L),NiCl2·6,H2O (20,µg/L),生物素(0.4,mg/L),葡萄糖(33,g/L).
1.2 方 法
1.2.1 引物设计
引物设计见表2.
1.2.2 表达质粒和敲除质粒构建
表达质粒构建:以B. subtilis 168基因组为模板,用引物alsD-U/alsD-D(引物alsD-U带有核糖体结合位点序列AAAGGAGGACAACC),通过PCR扩增得到alsD片段,目的片段用限制性内切酶BamH I和Pst I酶切连接到C. glutamicum ATCC 13032和大肠杆菌穿梭载体pEC-XK99E上得到pEC-XK99E-alsD.alsS基因以引物alsS-U/alsS-D(引物alsS-U带有核糖体结合位点序列AAAGGAGGACAACC)进行扩增,用限制性内切酶Sac I和BamH I酶切连接到pEC-XK99E-alsD上,转化至大肠杆菌DH5α感受态中,在添加25,µg/mL卡那霉素的LB培养基上筛选阳性转化子,通过验证得到表达载体pEC-XK99E-alsSD.
敲除质粒构建:aceE基因上下游(大约500,bp)设计两对引物aceE1/aceE2和aceE3/aceE4(见表2),引物aceE2/aceE3之间有互补序列,可以实现两片段融合PCR.以C. glutamicum ATCC 13032基因组为模板,用引物对aceE1/aceE2和aceE3/aceE4分别进行片段扩增;再以得到的PCR产物为模板,通过引物aceE1/aceE4进行融合PCR,目的片段用限制性内切酶Sal I和BamH I酶切连接到载体pDsacB质粒上,并转化至大肠杆菌DH5α感受态,在含有25,µg/mL卡那霉素LB培养基上得到阳性转化子aceE基因敲除质粒pDsacB-ΔaceE.同理,ldhA与butA基因无痕敲除质粒构建同上.

表2 引物设计Tab.2 Primers design
敲除方法:aceE、ldhA和butA基因敲除参照Schäferet方法[7],通过同源重组将目的基因无痕敲除,在添加100,g/L蔗糖的CGIII培养基上筛选得到目的基因敲除菌株.对于aceE基因敲除菌株需要在培养基中添加10,g/L乙酸钠.
1.2.3 重组菌株发酵
将C. glutamicum ATCC 13032菌株在BHIS平板上划线活化,30,℃培养48,h;挑取单菌落于装有5,mL BHIS培养基的试管中,30,℃,220,r/min过夜培养,取1,mL转接CGIII培养基进行种子培养.当菌体处于对数生长期时离心菌体(4,500g,10,min,4,℃),倒掉上清,用0.9% NaCl溶液重悬菌体,接种到50,mL CGXII(500,mL摇瓶)发酵培养基中,使初始OD600达到1左右,发酵条件为30,℃、120,r/min.
1.2.4 乙酰乳酸合成酶的酶活测定
与发酵培养条件相同:培养菌体至对数生长期收集菌液50,mL,4,℃条件下,9,000,r/min离心10,min收集菌体;用2,mL的0.1,mol/L pH 7.0磷酸缓冲液(4,℃预冷)洗涤二次悬浮在2,mL同样的缓冲液中;向悬浮液中加入终质量浓度为1,mg/mL的溶菌酶,37,℃水浴1~2,h,进一步用超声波破碎菌体;4,℃条件下,9,000,r/min离心30,min去除菌体等杂质,得上清即为粗酶液,放置冰上备用.蛋白浓度测定参照Yang等[8]方法,乙酰乳酸合成酶的比活力单位为:每分钟每毫克蛋白生成1,mmol乙酰乳酸/乙偶姻所需的酶量.
1.2.5 发酵产物分析
通过紫外可见分光光度计测定波长600,nm处的吸光度值记录细胞生长.培养基中的葡萄糖用生物传感仪(SBA-40,C)(山东省科学院生物研究所)检测.乙偶姻和有机酸采用高效液相色谱系统(Agilent公司1100色谱仪)检测.色谱柱为Aminex HPX-87,H column.流动相为5,mmol/L H2SO4.色谱条件如下:柱温65,℃,流速0.4,mL/min,紫外UVD和示差RID检测器.
2 结果与讨论
2.1 在C. glutamicum ATCC 13032中表达alsSD操纵子
微生物的乙偶姻合成途径如图1所示.糖类物质经糖酵解途径合成丙酮酸,两分子丙酮酸在α-乙酰乳酸合成酶(α-acetolactate synthase,ALS)作用下生成α-乙酰乳酸和二氧化碳,α-乙酰乳酸经α-乙酰乳酸脱羧酶(α-acetolactate decarboxyase,ALDC)的作用生成乙偶姻.乙偶姻进一步在2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH)的作用下生成2,3-丁二醇[9].
Bacillus subtilis 168的乙偶姻合成途径关键酶乙酰乳酸合成酶和乙酰乳酸脱羧酶分别由alsSD操纵子的alsS和alsD编码[10].为了在C. glutamicum ATCC 13032中引入乙偶姻合成途径,将表达质粒pEC-XK99E-alsSD转化到C. glutamicum ATCC 13032中,得到菌株CGL1.alsSD操纵子的转录由强启动子Ptrc控制,在0.5,mmol/L IPTG诱导下,表达合成乙偶姻的乙酰乳酸合成酶和乙酰乳酸脱羧酶.
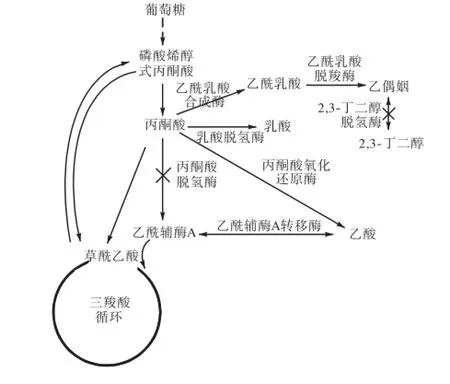
图1 谷氨酸棒状杆菌代谢途径Fig.1 Metabolic pathways in C. glutamicum ATCC 13032
首先从酶学特性考察菌株CGL1中乙酰乳酸合成酶表达效果,对C. glutamicum ATCC 13032和CGL1的ALS酶活进行了测定.CGL1乙酰乳酸合成酶的比酶活为(46.1±0.74)U/(mg蛋白),而对应的野生型菌株仅为(2.5±0.26)U/(mg蛋白),重组菌的比酶活提高了17倍.
为测定菌株CGL1生产乙偶姻的能力,对重组菌株CGL1和野生型菌株进行发酵实验.菌株CGL1的发酵结果如图2所示,CGL1接种初始OD600为1左右,17,h时OD600达到20,比生长速率为0.149,h-1,发酵48,h消耗了33,g/L的葡萄糖,生产了2.14,g/L的乙偶姻.目标产物乙偶姻得率达到理论得率的13.25%,生产率为0.044,g/(h·L).相同条件下野生型菌株在整个发酵过程中未检测到乙偶姻的生成.发酵结果表明alsSD操纵子在C. glutamicum ATCC 13032中成功表达.
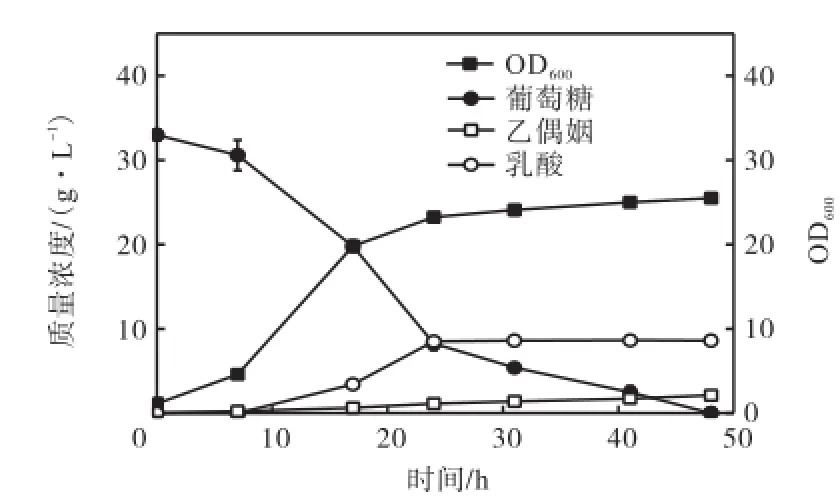
图2 CGL1发酵曲线Fig.2 Fermentation of CGL1
除了目标产物乙偶姻,发酵产物中检测到大量的乳酸,乳酸的生成会竞争消耗合成乙偶姻的直接前体物丙酮酸.碳源大量流向乳酸合成途径使乙偶姻前体物丙酮酸供给不足,导致乙偶姻得率较低.
2.2 aceE和ldhA基因敲除对菌株生产乙偶姻的影响
菌株CGL1发酵过程中生成大量乳酸,为了阻断副产物乳酸的生成敲除ldhA基因.同时失活aceE基因增加乙偶姻前体物丙酮酸的供给,得到双敲除菌株CGL2.当以葡萄糖为底物时,aceE基因的失活导致丙酮酸代谢生成乙酰辅酶A的碳流被完全阻断,会影响菌体生长.需要在发酵培养基中添加适量乙酸盐,乙酸盐在乙酸激酶(AK)与磷酸转乙酰酶(PTA)作用下生成乙酰辅酶A,维持正常的三羧酸循环,使菌体恢复正常生长[11].所以本实验中对于aceE基因敲除菌株在发酵时要在培养基中添加10,g/L乙酸钠.
菌株CGL2的发酵结果如图3所示.由图可知,对数期的比生长速率为0.114,h-1,发酵31,h进入稳定期,最大OD600值保持在34左右.发酵36,h时,底物葡萄糖和乙酸盐同时被耗尽.与菌株CGL1相比,菌株CGL2的比生长速率下降了24%,生长延滞期增长,最终菌体密度较高.最终乙偶姻的浓度为5.09,g/L,达到理论得率的31.54%,相对于菌株CGL1产量提高了1.38倍.发酵液中检测不到乳酸的生成,表明敲除ldhA基因有效地阻断了乳酸合成途径.aceE与ldhA基因的失活阻断了与乙偶姻竞争利用丙酮酸的代谢途径,代谢流在丙酮酸代谢节点进行重新分配,使得乙偶姻合成代谢流增加,乙偶姻产量、转化率得到大幅度提高.
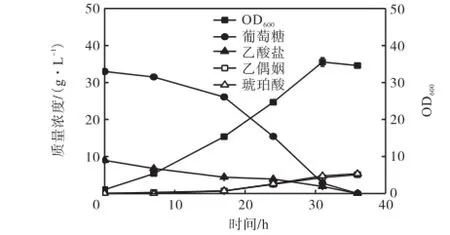
图3 CGL2发酵曲线Fig.3 Fermentation of CGL2
菌株CGL2发酵过程中积累了5.35,g/L琥珀酸. Zimmermann等[12]发现摇瓶发酵实验中,菌体OD600大于10时会导致溶氧不足.C. glutamicum ATCC 13032在微好氧和厌氧发酵条件下,磷酸烯醇式丙酮酸(PEP)在磷酸烯醇式丙酮酸羧化酶(PEPC)的作用下生成草酰乙酸,经过TCA还原臂生成琥珀酸[13].同时Inui等[14]研究表明,C. glutamicum ATCC 13032在厌氧条件下,敲除ldhA基因会提高琥珀酸产量.溶氧不足的条件下,敲除依赖于NADH的乳酸脱氢酶基因会造成还原力不平衡,过剩的还原力将会用于琥珀酸合成,维持NAD+/NADH平衡.所以菌株CGL2发酵过程积累琥珀酸主要是菌体浓度过高、溶氧不足造成的.
本研究发现,发酵中期会有微量的2,3-丁二醇生成(数据未显示),末期时2,3-丁二醇又被代谢利用.
2.3 butA基因敲除对生产乙偶姻的影响
菌株CGL2发酵过程中检测到2,3-丁二醇的生成,表明C. glutamicum ATCC 13032的2,3-丁二醇脱氢酶(ButA)具有潜在酶活性.乙偶姻在ButA作用下经过脱氢反应生成2,3-丁二醇.为了减少乙偶姻代谢消耗,在菌株CGL2的基础上敲除butA基因得到菌株CGL3,阻断2,3-丁二醇的合成途径.
菌株CGL3发酵结果如图4所示.由图可知,对数期的比生长速率为0.125,h-1,发酵24,h时进入稳定期,基因敲除对菌体生长速率几乎没有影响.发酵产物检测最终乙偶姻的产量达到5.88,g/L,与CGL2相比,菌株CGL3乙偶姻产量提高了15.55%,乙偶姻生产率达到0.143,g/(h·L).整个发酵过程中检测不到2,3-丁二醇,表明敲除butA基因有效阻断了2,3-丁二醇的合成途径,同时提高了乙偶姻的产量.
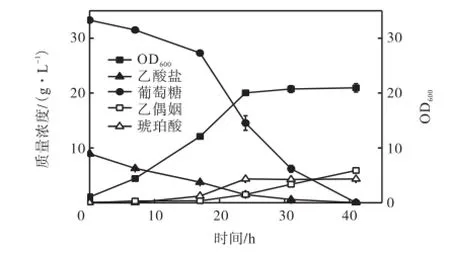
图4 CGL3发酵曲线Fig.4 Fermentation of CGL3
副产物琥珀酸的产量为4.33,g/L,下降了19%.菌株CGL3发酵过程中最大OD600保持在20左右,与CGL2相比菌体密度下降,溶氧条件得到改善,减少了琥珀酸的生成.
2.4 不同溶氧条件对菌株CGL3生产乙偶姻的影响发酵过程中很多参数会影响乙偶姻的生产,包括溶氧、pH和发酵方式等.其中溶氧是乙偶姻发酵生产的重要操作条件.溶氧过高,碳源主要用于菌体生长和生成CO2,造成碳源浪费;溶氧较低则导致琥珀酸的生成.为了降低琥珀酸的积累,优化发酵条件,探讨了不同的摇床转速对菌株CGL3发酵的影响.
如图5所示,研究了120,r/min、150,r/min、180,r/min和220,r/min 4个转速条件下菌株CGL3生产乙偶姻的状况.实验结果表明150,r/min为最佳转速,在此条件下乙偶姻产量8.33,g/L,达到理论得率的51.5%.生产率为0.207,g/(h·L),与120,r/min转速条件下相比,生产率提高了40.37%.当转速继续增加时,乙偶姻的产量开始呈下降趋势.所以通过优化实验,确定乙偶姻生产的最佳转速为150,r/min.
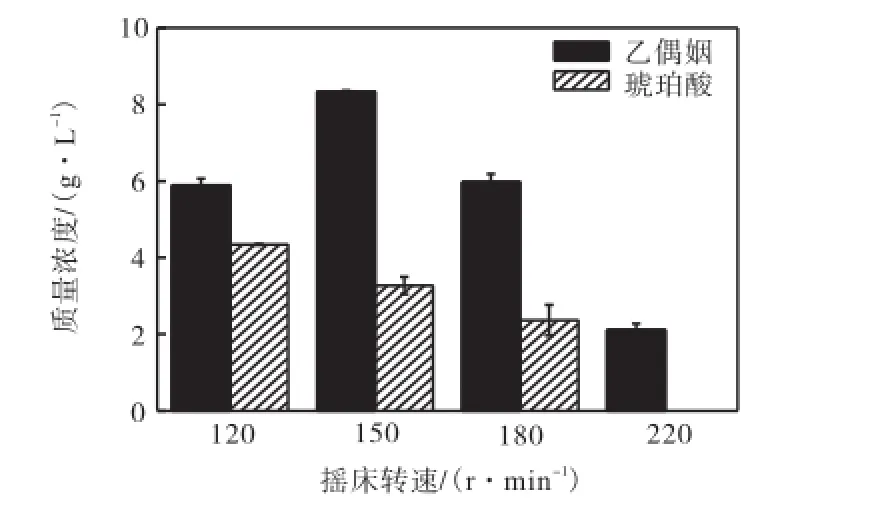
图5 摇床转速对生产乙偶姻的影响Fig.5 Effect of rotation speed on acetoin production
琥珀酸的生成量随着转速的增加呈下降趋势,转速为220,r/min时发酵产物中检测不到有琥珀酸生成.溶氧直接影响菌体生长、代谢途径和产物合成,完全好氧条件下,氧气作为氢受体,可以有效维持NAD+/NADH平衡,抑制琥珀酸生成.但是完全好氧条件下,大量碳源用于菌体呼吸生成CO2,所以当转速高于150,r/min时乙偶姻产量有下降趋势,造成碳源浪费.
3 结 论
本研究首次构建了生产乙偶姻的谷氨酸棒状杆菌工程菌株.
(1) 在野生型C. glutamicum ATCC 13032中表达合成乙偶姻操纵子,菌种CGL1发酵生产乙偶姻2.14,g/L,同时积累大量副产物乳酸.
(2) 构建ldhA和aceE基因敲除菌株CGL2,乙偶姻产量为5.09,g/L,有大量琥珀酸生成,同时检测到有微量2,3-丁二醇生成.
(3) 敲除butA基因阻断乙偶姻降解途径,得到菌株CGL3,发酵产物中检测不到2,3-丁二醇,菌体密度下降,减少了琥珀酸的积累,乙偶姻的产量达到5.88,g/L.
(4) 不同转速条件下菌株CGL3发酵结果显示,150,r/min为乙偶姻生产的最佳转速.该条件下乙偶姻产量为8.33,g/L,达到理论得率的51.5%.
[1] Liu Y F,Zhang S L,Yong Y C,et al. Efficient production of acetoin by the newly isolated Bacillus licheniformis strain MEL09[J]. Process Biochemistry,2011,46(1):390-394.
[2] Leuchtenberger W,Huthmacher K,Drauz K. Biotechnological production of amino acids and derivatives:Current status and prospects[J]. Applied Microbiology and Biotechnology,2005,69(1):1-8.
[3] 姜春晓,王 婷,张彦峰,等. 基因组改组选育抗镉菌及生物修复镉污染土壤[J]. 天津大学学报,2012,45(7):609-614.
Jiang Chunxiao,Wang Ting,Zhang Yanfeng,et al. Breeding cadmium-resistant strains by genome shuffling and bioremediation of cadmium contaminated soil[J]. Journal of Tianjin University,2012,45(7):609-614(in Chinese).
[4] Blombach B,Schreiner M E,Holátko J,et al. L-valine production with pyruvate dehydrogenase complexdeficient Corynebacterium glutamicum[J]. Applied and Environmental Microbiology,2007,73(7):2079-2084.
[5] Wieschalka S,Blombach B,Eikmanns B J. Engineering Corynebacterium glutamicum for the production of pyruvate[J]. Applied Microbiology and Biotechnology,2012,94(2):449-459.
[6] Zhu N Q,Xia H H,Wang Z W,et al. Engineering of acetate recycling and citrate synthase to improve aerobic succinate production in Corynebacterium glutamicum[J]. PLoS One,2013,8(4):e60659.
[7] Inui M,Kawaguchi H,Murakami S,et al. Metabolic engineering of Corynebacterium glutamicum for fuel ethanol production under oxygen-deprivation conditions [J]. Journal of Molecular Microbiology and Biotechnology,2004,8(4):243-254.
[8] Yang Y T,Peredelchuk M,Bennett G N,et al. Effect of variation of Klebsiella pneumoniae acetolactate synthase expression on metabolic flux redistribution in Escherichia coli[J]. Biotechnology and Bioengineering,2000,69(2):150-159.
[9] 付 晶,王 萌,刘维喜,等. 生物法制备 2,3-丁二醇的最新进展[J]. 化学进展,2012,24(11):2268-2276.
Fu Jing,Wang Meng,Liu Weixi,et al. Latest advances of microbial production of 2,3-butanediol[J]. Progress in Chemistry,2012,24(11):2268-2276(in Chinese).
[10] Wang M,Fu J,Zhang X Y,et al. Metabolic engineering of Bacillus subtilis for enhanced production of acetoin[J]. Biotechnology Letters,2012,34(10):1877-1885.
[11] Schreiner M E,Fiur D,Holátko J,et al. E1 enzyme of the pyruvate dehydrogenase complex in Corynebacterium glutamicum:Molecular analysis of the gene and phylogenetic aspects[J]. Journal of Bacteriology,2005,187(17):6005-6018.
[12] Zimmermann H F,Anderlei T,Büchs J,et al. Oxygen limitation is a pitfall during screening for industrial strains[J]. Applied Microbiology and Biotechnology,2006,72(6):1157-1160.
[13] Fukui K,Koseki C,Yamamoto Y,et al. Identification of succinate exporter in Corynebacterium glutamicum and its physiological roles under anaerobic conditions[J]. Journal of Biotechnology,2011,154(1):25-34.
[14] Inui M,Murakami S,Okino S,et al. Metabolic analysis of Corynebacterium glutamicum during lactate and succinate productions under oxygen deprivation conditions[J]. Journal of Molecular Microbiology and Biotechnology,2004,7(4):182-196.
(责任编辑:田 军)
Metabolic Engineering of Corynebacterium Glutamicum for Acetoin Production
Ma Hongwu1,2,Liu Huijuan1,Zhu Nianqing1,Chen Tao1
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
The acetoin was synthesized using metabolic engineering method from Corynebacterium glutamicum ATCC 13032. The alsSD operon derived from Bacillus subtilis 168 was expressed in C. glutamicum ATCC 13032 to yield acetoin of 2.14,g/L in the engineering strain. Additional inactivation of aceE gene encoding the E1p enzyme of the pyruvate dehydrogenase complex and ldhA gene encoding NAD+-dependent L-lactate dehydrogenase increased the supply of acetoin precursor. The acetoin production increased to 5.09,g/L with the newly constructed strain. Subsequently,formation of 2,3-butanediol was inhibited by deleting butA gene encoding for 2,3-butanediol dehydrogenase. Total yield of acetoin reached 8.33,g/L(51.1% of theoretical yield)under the optimum fermentation condition in the strain CGL3. The experimental results show that the strain of C. glutamicum ATCC 13032,engineered metabolically can provide a potential application for acetoin synthesis.
metabolic engineering;acetoin;Corynebacterium glutamicum;acetolactate decarboxylase;acetolactate synthase
Q815
A
0493-2137(2014)11-0967-06
10.11784/tdxbz201304053
2013-04-27;
2013-06-04.
国家重点基础研究发展计划(973计划)资助项目(2011CBA00804,2012CB725203);国家自然科学基金资助项目(21176182).
马红武(1970— ),男,博士,研究员,hongwu.ma@gmail.com.
陈 涛,chentao@tju.edu.cn.
时间:2014-04-08.
http://www.cnki.net/kcms/doi/10.11784/tdxbz201304053.html.
