氮、磷浓度对太湖水华微囊藻(Microcystis flos-aquae)群体生长的影响*
2014-05-28许慧萍杨桂军秦伯强张光生胡细全
许慧萍,杨桂军**,周 健,秦伯强,张光生,邹 华,胡细全
(1:江南大学环境与土木工程学院,无锡 214122)
(2:中国科学院南京地理与湖泊研究所湖泊环境与科学国家重点实验室,南京 210008)
(3:湖北大学资源与环境学院,武汉 430062)
伴随着我国经济的快速发展,大量污染物的产生和排放致使水体富营养化日趋严重.由于水体富营养化,太湖最近每年的5-10月都会出现微囊藻水华,给太湖周边的社会生活和生产造成重大影响和损失[1].尽管对微囊藻水华进行了大量研究[2-3],然而,到目前为止微囊藻水华暴发机理还不清楚.
在自然水体中,微囊藻水华暴发时,大量微囊藻以群体状态漂浮在水体表层[4].微囊藻群体的大小对微囊藻在水体中的迁移速度[5-7]、抗捕食压力[8]和比表面积有重要影响.Wu 等[9]发现太湖微囊藻水华暴发时,微囊藻大群体更容易克服水体扰动产生的包裹力,同时微囊藻大群体对太阳辐射的昼夜变化反应不敏感,无论是有风还是无风的情况,大于120 μm 的微囊藻大群体总是聚集于水面上层.Cao 等[10]野外调查发现太湖大于200 个细胞的大群体微囊藻是构成6月份微囊藻水华的重要组成部分.
在野外条件下,微囊藻主要以群体形态存在[6],而转入室内培养后以单细胞和两细胞形态为主[10-12].微囊藻单细胞如何转变为群体微囊藻这一问题引起了关注.有研究显示,很多因素都可以诱导单细胞微囊藻形成群体微囊藻,包括生物因子,如鞭毛虫的摄食[6,13-15]、后生浮游动物摄食[16]、异养菌的诱导作用[17];化学因子,如微囊藻毒素[18];物理因子,如高光照强度[19].尽管有关微囊藻单细胞转变为群体的研究已经取得了很多进展,然而到目前为止,其机理还不是很清楚.
微囊藻大群体都是由微囊藻小群体生长而来.影响微囊藻群体生长的的因素有很多,包括浮游动物捕食等生物因素以及营养盐、光照、温度等非生物因素.营养盐是影响微囊藻的主要非生物因子之一,其中氮和磷是影响微囊藻生长的主要营养元素.有关氮、磷营养盐浓度对微囊藻生长的影响,国内外学者已经做了大量的研究[20-26],但这些研究都是探讨氮、磷营养盐浓度对微囊藻单细胞生长的影响,而有关氮、磷营养盐浓度对微囊藻群体生长影响的研究国内外未见报道.水华微囊藻是太湖微囊藻水华的主要优势种之一[27].本研究以水华微囊藻小群体为研究对象,以近几年太湖微囊藻水华暴发最严重的梅梁湾氮磷比的平均值作参考,通过设置不同的氮、磷营养浓度,探讨氮、磷浓度对水华微囊藻小群体生长的影响,将有助于人们了解太湖微囊藻水华暴发机理.
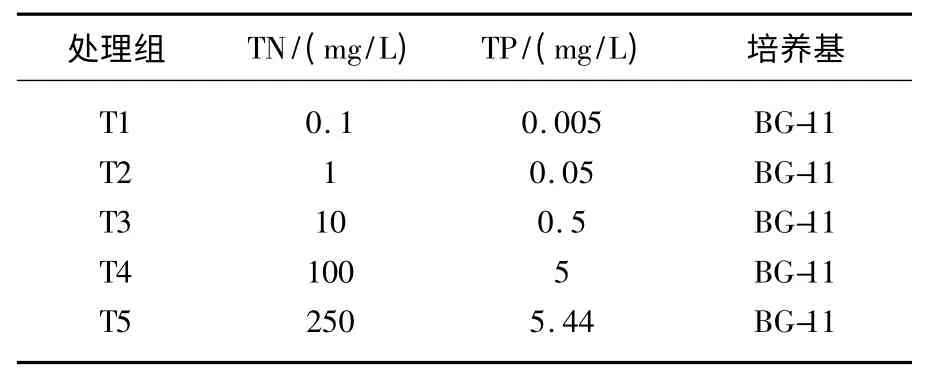
表1 实验各组培养基中的总氮、总磷浓度Tab.1 Concentrations of TN,TP and culture medium in treatments in this experiment
1 材料与方法
实验用的水华微囊藻1028 来源于中国科学院武汉水生生物研究所,所有藻种接种于含改良的BG-11液体培养基的锥形瓶中,置于25℃恒温培养箱中培养,光照设置为3000 lx,光暗周期比为12 h∶12 h.藻种在BG-11 培养基中培养一段时间,藻种中含有一定量的水华微囊藻单细胞、两细胞以及小群体后正式开始实验(藻种中含22.1% 小群体,群体平均大小为3.8 cells).取培养好的藻种分别加入100 ml无氮和无磷的 BG-11 培养液,总氮(TN)、总磷(TP)浓度设置见表1.实验中 T1 ~ T4 氮磷比(20∶1)模拟近几年太湖蓝藻水华暴发最严重的梅梁湾氮磷比的平均值.T5 中的氮、磷浓度为正常BG-11 培养基中的氮、磷浓度.实验每组设置3 个平行样,在上述条件下置于培养箱中培养21 d,锥形瓶每天摇动一次.每3 天取样一次并在显微镜(Nikon E200)下观察计数.测定微囊藻群体大小时通常直接测定群体的直径.这样的方法对于野外紧密型的微囊藻群体比较适合.但经观察在室内培养下的微囊藻群体呈现较松散的立体空间结构,且群体没有固定的形态,使用通常的方法测定误差较大.为避免这样的误差,本实验通过测定单个群体的细胞数来表示群体的大小.本研究中选取了单细胞、双细胞、3 ~10 细胞的群体、含10 ~100 细胞的群体以及100 +细胞(>100 cells)的群体进行计数[10].本研究中细胞计数时要求单细胞、双细胞至少取100 个视野;测定群体大小时至少测定50 群体,然后取平均值.
2 结果
2.1 不同氮、磷营养盐浓度对水华微囊藻群体大小的影响
本实验中,处理组T1、T2、T3 和T4 均有大于100 细胞的群体形成,而处理组T5 整个实验期间未发现有较大群体形成(图1 和图2).其中,T1、T2、T3 和 T4 组的大群体平均大小依次是151、217、437 和160 cells(图2),T3 组中群体平均大小最大(图1),表明这个水平的氮、磷浓度最有利于水华微囊藻群体的增长.T5 组中初始时有3 ~10 细胞的群体以及10 ~100 细胞的群体形成,而后消失,表明这个水平的氮、磷浓度过高,不利于水华微囊藻群体的生长,这也可能是在实验条件下微囊藻以单细胞和两细胞形态存在的原因.

图1 实验中不同氮、磷浓度培养下水华微囊藻群体大小比较Fig.1 Contrasting on size of M.flos-aquae colonies under different N and P concentrations in this experiment
实验结果表明,群体大小随营养盐浓度变化而变化.T1、T2、T3 和T4 组中群体大小基本上呈增长趋势,而T5 组中则呈下降趋势(图3).T5 组中10 ~100 细胞群体在第12 d 时开始消失(图3B).
2.2 不同氮、磷营养盐浓度对水华微囊藻群体密度的影响
随着氮、磷营养盐浓度从TN=0.1 mg/L、TP=0.005 mg/L 升高至TN =10 mg/L、TP=0.5 mg/L,水华微囊藻群体密度依次增高,且大于100 细胞的群体所占比例逐渐增大,TN =10 mg/L、TP=0.5 mg/L 时群体密度达到最大;营养盐浓度升高至TN =250 mg/L、TP =5.44 mg/L 时,群体密度开始逐渐减小,T5 组中大于100 细胞的群体所占比例为0(图4).这表明当TN=10 mg/L、TP=0.5 mg/L 时利于水华微囊藻群体大小的增长,而过高的氮、磷营养盐浓度则会制约其群体的形成.
当营养盐浓度较低时(TN=0.1 mg/L、TP=0.005 mg/L),各群体密度增长趋势并不明显(图5A);随着营养盐浓度的升高,水华微囊藻群体密度逐渐增大,T2 组中10 ~100 细胞群体和大于100 细胞群体密度开始呈现增长趋势(图5B);TN =10 mg/L、TP =0.5 mg/L 时大于100 细胞的群体密度增长速度最快,第21 d时超大群体比例最大,而单细胞数量几乎为0(图5C);TN =100 mg/L、TP =5 mg/L 时,随着培养时间的增加,各群体密度也逐渐增大,相比较而言,10 ~100 细胞的群体密度大于100 +细胞的群体密度(图5D);T5组中,细胞密度也以较快速度增长,其中双细胞增长速度最快,10 ~100 细胞的群体在培养第12 d 时消失,其后一直以单细胞、双细胞以及3 ~10 细胞的群体形态存在(图5E).

图2 实验中不同氮、磷浓度水平水华微囊藻群体平均大小比较Fig.2 Contrasting on mean size of M.flos-aquae colonies under different N and P concentrations

图3 实验中不同氮、磷浓度水华微囊藻群体大小随时间变化情况Fig.3 The variation of M.flos-aquae colony size under different N and P concentrations
3 讨论
本研究结果显示,当TN≤10 mg/L、TP≤0.5 mg/L时,氮、磷营养盐浓度增加有利于水华微囊藻群体增大;当TN >10 mg/L、TP >0.5 mg/L 以后,氮、磷营养盐浓度增加抑制水华微囊藻群体增长,不利于水华微囊藻群体增大.研究证实,随着外界环境的改变,生物的表现型会发生相应的改变[28-29].微囊藻聚集效应是微囊藻应对环境改变最常见的方式.藻类群体中各细胞的聚集主要依靠的是具有粘性的胞外多聚糖,因此,浮游植物群体的形成与胞外多聚糖的含量有着直接的关系[30-34].Yang 等[13]研究发现铜绿微囊藻群体形成后胞外多聚糖要显著多于单细胞胞外多聚糖.张民等[35]研究也发现群体微囊藻比单细胞微囊藻具有更多的胞外多聚糖.大量研究表明,细胞胞外多糖的分泌与生物和非生物因子(如:光照、营养盐和温度等)有重要关系.杨州等[13]发现在原生动物的强牧食压力下铜绿微囊藻胞外多聚糖分泌量明显增加.鱼腥藻的胞外多聚糖的释放受到温度的影响[36].在一定的光照强度范围内,蓝藻胞外多糖的含量随着光照强度的增加而增加,光照强度促进了藻类碳水化合物的产生以及胞外多糖的聚合[36-37].
在自然水体中,N、P 浓度是影响浮游植物生长的最主要营养元素[38].研究证实,经分离纯化后转入实验室的单细胞微囊藻的胞外多糖含量比野外大群体的小得多[39],因此影响胞外多糖分泌的因素在微囊藻群体的形成上也可能发挥了至关重要的作用.作为细胞物质合成的主要元素,氮、磷对胞外多糖的影响一直是研究的重点.De Philippis 等[40]研究发现 N限制条件能促进蓝藻体内胞外多糖的合成,而在P饥饿或P 缺乏时,一些藻类的多聚糖含量也会升高[41-42].有研究证实:相对的磷限制、氮限制或碳过量(即在较高的C/N 或C/P)能促进一些藻类或细菌胞外多聚糖的分泌,可能有助于细胞的聚合[31,43-44].Otero 等[45-46]发现,在氮限制或碳过饱和,也就是在不平衡的高碳氮比下,念珠藻(Nostoc sp.)可产生更多的胞外多聚糖,而在含氮丰富的培养基中,念珠藻的胞外多聚糖产量很低.Moreno等[36]发现鱼腥藻(Anabaena sp.)胞外多聚糖产量与培养基中氮的总量呈现负相关关系.研究结果表明,N 限制能够促进水华微囊藻碳水化合物的合成[47].阳振[19]发现将铜绿微囊藻(M.aeruginosa)培养在N 浓度为1.98 mg/L、P 浓度为0.65 mg/L或N 浓度更低的条件下,胞外多糖的合成明显增加.Liu 等[48]用乙醛酸模拟营养胁迫对栅藻(S.obliquus)多糖产量的影响进行研究发现,低浓度的乙醛酸对栅藻的增长无明显影响,而高浓度则抑制其生长,且乙醛酸处理组中,有栅藻群体形成,实验组中多糖产量、乙醛酸含量以及颗粒细胞数两两呈现正相关,Yang 等[49]在多糖含量对小球藻(C.pyrenoidosa)群体聚集影响时也发现多糖含量随乙醛酸浓度的增加而增加,且胞外多糖含量同小球藻群体大小直接相关.
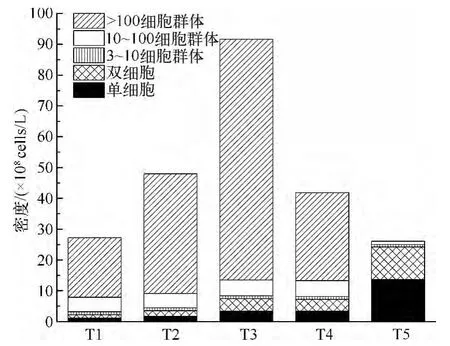
图4 实验中不同氮、磷浓度水华微囊藻各形态的平均密度Fig.4 The mean density of different units of M.flos-aquae under different N and P concentrations in this experiment

图5 实验中不同氮、磷浓度下水华微囊藻各形态平均密度随时间的变化Fig.5 The density variation of different units of M.flos-aquae under different N and P concentrations in this experiment
本实验中,T5 处理组所用培养基为含N 和P 极高的BG-11 培养基(TN=250 mg/L、TP=5.44 mg/L),一直未形成超大群体,大群体也在随后几天消失.高浓度的氮、磷营养盐可能抑制了微囊藻细胞胞外多糖的分泌,最终制约了微囊藻群体的形成.T1 组中大群体在第12 d 后开始缓慢减少,T1 组中氮、磷营养盐浓度水平较低,随着培养时间的增长,营养盐逐渐被消耗,因此大群体密度开始逐渐减少.本实验设置的浓度梯度中,TN =10 mg/L、TP=0.5 mg/L 时微囊藻超大群体大小最高达到900 cells(图3C),因此,在一定范围内,其群体密度随着营养盐含量的升高而升高.过高的营养盐则制约了胞外多糖的合成,由此可以得到T5 组多为单细胞和双细胞而没有超大群体形成的原因.通常情况下,实验室中多用BG-11 培养基培养微囊藻,由此可以解释为何在实验室条件下很难获得微囊藻群体.本研究表明,适宜的氮、磷浓度有利于微囊藻群体的生长,过低或过高的氮、磷浓度都不利于微囊藻群体的生长.
梅梁湾位于太湖北部,每年5-10月微囊藻水华暴发频繁[1].同世界各地富营养化湖泊一样,梅梁湾氮、磷水平较高(平均TN=4.57 mg/L、TP=0.165 mg/L)[50-51].水华微囊藻是太湖微囊藻水华暴发的主要优势种之一[52].本实验结果表明从T1 ~T3,随氮、磷营养盐浓度增加,微囊藻藻群体也增大,其中,T1 为TN =0.1 mg/L、TP=0.005 mg/L;T3 为 TN=10 mg/L、TP=0.5 mg/L,太湖梅梁湾的氮、磷浓度处于 T1 ~ T3 之间,说明目前太湖氮、磷浓度水平有利于水华微囊藻群体的增长.本文研究结果可为解释太湖以及其它富营养水体微囊藻水华频发提供参考.
[1]Chen YW,Qin BQ,Teubner K et al.Long-term dynamics of phytoplankton assemblages,Microcystis domination in Lake Taihu,a large shallow lake in China.Journal of Plankton Research,2003,25(4):445-453.
[2]Li YG,Gao KS.Photosynthetic physiology and growth as a function of colony size in the cyanobacterium Nostoc sphaeroides.European Journal of Phycology,2004,39(1):9-15.
[3]Wallace BB,Hamilton DP.Simulation of water-bloom formation in the cyanobacterium Microcystis aeruginosa.Journal of Plankton Research,2000,22(6):1127-1138.
[4]Burkert U,Hyenstrand P,Drakare S et al.Effects of the mixotrophic flagellate Ochromonas sp.on colony formation in Microcystis aeruginosa.Aquantic Ecology,2001,35(1):11-17.
[5]Hutchinson GE.A treatise on limnology.New York:John Wiley & Sons Inc.,1957.
[6]Reynolds CS.The ecology of freshwater phytoplankton.Cambridge:Cambridge University Press,1984.
[7]Reynolds CS.Cyanobacterial water blooms.Advances in Botanical Research Incorporating Advances in Plant Pathology,1987,13:67-143.
[8]Oliver RL,Ganf GG.Freshwater blooms.Dordrecht:Kluwer Academic Publishers,2000:149-194.
[9]Wu XD,Kong FX.Effects of light and wind speed on the vertical distribution of Microcystis aeruginosa colonies of different sizes during a summer bloom.International Review of Hydrobiology,2009,94(3):258-266.
[10]Cao HS,Yang Z.Variation incolony size of Microcystis aeruginosa in a eutrophic lake during recruitment and bloom formation.Journal of Freshwater Ecology,2010,25(3):331-335.
[11]Reynolds CS,Jaworski GHM,Cmiech HA et al.On the annual cycle of the blue-green alga Microcystis aeruginosa Kütz.Emend.Elenkin.Philosophical Transactions of the Royal Society of London:Series B:Biological Sciences,1981,293(1068):419-477.
[12]Bolch CJS,Blackburn IS.Isolation and purification of Australian isolates of the toxic cyanobacterium Microcystis aeruginosa Kütz.Journal of Applied Phycology,1996,8(1):5-13.
[13]Yang Z,Kong FX,Shi XL et al.Changes in the morphology and polysaccharide content of Microcystis aeruginosa (cyanobacteria)during flagellate grazing.Journal of Phycology,2008,44(3):716-720.
[14]吴忠兴.我国微囊藻多样性分析及其种群优势的生理学机制研究[学位论文].武汉:中国科学院水生生物研究所,2006.
[15]Yang Z,Kong FX,Zhang M et al.Effect of filtered cultures of flagellate Ochromonas sp.on colony formation in Microcystis aeruginosa.International Review of Hydrobiology,2009,94(2):143-152.
[16]Jang MH,Ha K,Joo GJ et al.Toxin production of cyanobacteria is increased by exposure to zooplankton.Freshwater Biology,2003,48(9):1540-1550.
[17]Shen H,Niu Y,Xie P et al.Morphological and physiological changes in Microcystis aeruginosa as a result of interactions with heterotrophic bacteria.Freshwater Biology,2011,56(6):1065-1080.
[18]Sedmak B,Eleršek T.Microcystins induce morphological and physiological changes in selected representative phytoplank-tons.Microbial Ecology,2005,50(2):298-305.
[19]阳 振.微囊藻群体形成的驱动因子研究[学位论文].南京:中国科学院南京地理与湖泊研究所,2010.
[20]Elmgren R,Larsson U.Nitrogen and the Baltic Sea:Managing nitrogen in relation to phosphorus.Scientific World Journal,2001,1(2):371-377.
[21]Smith VH.Eutrophication of freshwater and coastal marine ecosystems:A global problem.Environmental Science and Pollution Research,2003,10(2):126-139.
[22]Cloern JE.Our evolving conceptual model of the coastal eutrophication problem.Marine Ecology Progress Series,2001,210(1):223-253.
[23]Bledsoe EL,Phlips EJ,Jett CE et al.The relationships among phytoplankton biomass,nutrient loading and hydrodynamics in an inner-shelf estuary.Ophelia,2004,58(1):29-47.
[24]Liu X,Lu XH,Chen YW.The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu,China:An 11-year investigation.Harmful Algae,2011,10(3):337-343.
[25]Xie L,Xie P,Li S et al.The low TN:TP ratio,a cause or a result of Microcystis blooms.Water Research,2003,37(9):2073-2080.
[26]Yang LY,Wang Q,Shi XL et al.Phosphorus metabolism of Microcystis aeruginosa during its growth process.Journal of Agro-Environment Science,2005,24(4):686-689.
[27]Schmalhausen Ⅱ.Factors of evolution:The theory of stabilizing selection.Chicago:University of Chicago Press,1949.
[28]何家菀,何振荣,余家禄.东湖铜绿微囊藻毒素的分离与鉴定.海洋与湖沼,1988,19(5):424-430.
[29]Waddington CH.Genetic assimilation of an acquired character.Evolution,1953,7(2):118-126.
[30]Wustman BA,Gretz MR,Hoagland KD.Extracellular matrix assembly in diatoms(Bacillariophyceae)(I.A model of adhesives based on chemical characterization and localization of polysaccharides from the marine diatom Achnanthes longipes and other diatoms).Plant Physiology,1997,113(4):1059-1069.
[31]De Philippis R,Vincenzini M.Exocellular polysaccharides from cyanobacteria and their possible applications.FEMS Microbiology Reviews,1998,22(3):151-175.
[32]Pajdak-Stós A,Fialkowska E,Fyda J.Phormidium autumnale (cyanobacteria)defense against three ciliate grazer species.Aquatic Microbial Ecology,2000,23(3):237-244.
[33]Van Rijssel M,Janse I,Noordkamp DJB et al.An inventory of factors that effect polysaccharide production by Phaeocystis globosa.Journal of Sea Research,2000,43(3):297-306.
[34]Thornton D.Diatom aggregation in the sea:mechanisms and ecological.European Journal of Phycology,2002,37(2):149-161.
[35]张 民,孔繁翔.单细胞和群体微囊藻光化学响应的差异.中国水环境污染控制与生态修复技术学术研讨会,2008.
[36]Moreno J,Vargas MA,Olivares H et al.Exopolysaccharide production by the cyanobacterium Anabaena sp.ATCC 33047 in batch and continuous culture.Journal of Biotechnology,1998,60(3):175-182.
[37]雷腊梅,宋立荣,欧丹云等.营养条件对水华蓝藻铜绿微囊藻的胞外多糖产生的影响.中山大学学报,2007,46(3):85-87.
[38]Hecky RE,Kvilham P.Nutrient limitation of phytoplankton in freshwater and marine environment:a review of recent evidence on the effects of enrichment.Limnology and Oceanography,1988,33(4):796-822.
[39]Zhang M,Kong FX,Tan X et al.Biochemical,morphological and genetical variations in Microcystis aeruginosa due to colony disaggregation.World Journal of Microbiology and Biotechnology,2007,23(5):663-670.
[40]De Philippis R,Margheri MC,Pelosi E et al.Exopolysaccharide production by a unicellular cyanobacterium isolated from a hypersaline habitat.Journal of Applied Phycology,1993,5(4):387-394.
[41]Nicolaus B,Panico A,Lama L et al.Chemical composition and production of exopolysaccharides from representative members of heterocystous and non-heterocystous cyanobacteria.Phytochemistry,1999,52(4):639-647.
[42]Roux JM.Production of polysaccharide slime by microbial mats in the hypersaline environment of a western Australian solar saltfield.International Journal of Salt Lake Research,1996,5(2):103-130.
[43]Konopka A.The effect of nutrient limitation and its interaction with light upon the products of photosynthesis in Merismopedia tenuissima (Cyanophyceae).Journal of Phycology,1983,19(4):403-409.
[44]Huang WJ,Lai CH,Cheng YL.Evaluation of extracellular products and mutagenicity in cyanobacteria cultures separated from a eutrophic reservoir.Science of the Total Environment,2007,377(2/3):214-223.
[45]Otero A,Vincenzini M.Extracellular polysaccharide synthesis by Nostoc strains as affected by N source and light intensity.Journal of Biotechnology,2003,102(2):143-152.
[46]Otero A,Vincenzini M.Nostoc(Cyanophyceae)goes nude:Extracellular polysaccharides serve as a sink for reducing power under unbalanced C /N metabolism.Journal of Phycology,2004,40(1):74-81.
[47]Chu ZS,Jin XC,Yang B et al.Buoyancy regulation of Microcystis flos-aquae during phosphorus-limited and nitrogen-limited growth.Journal of Plankton Research,2007,29(9):739-745.
[48]Liu Y,Wang W,Zhang M et al.PSII-efficiency,polysaccharide production,and phenotypic plasticity of Scenedesmus obliquus in response to changes in metabolic carbon flux.Biochemical Systematics and Ecology,2010,38(3):292-299.
[49]Yang Z,Liu Y,Ge J et al.Aggregate formation and polysaccharide content of Chlorella pyrenoidosa Chick (Chlorophyta)in response to simulated nutrient stress.Bioresource Technology,2010,101:8336-8341.
[50]Yang GJ,Qin BQ,Tang XM et al.Characterization of zooplankton communities in waters with different eutrophic states in a large,shallow,eutrophic freshwater lake (Lake Taihu,China).Fresenius Environmental Bulletin,2012,21(3):534-542.
[51]Yang GJ,Qin BQ,Tang XM et al.Contrasting zooplankton communities of two bays of the large,shallow,eutrophic Lake Taihu,China:their relationship to environmental factors.Journal of Great Lakes Research,2012,38(2):299-308.
[52]杨桂军.浮游植物对营养盐和浮游动物胁迫的响应研究[学位论文].南京:中国科学院南京地理与湖泊研究所,2008.
