α-玉米赤霉醇对大鼠成骨细胞IL-6 表达及分泌的影响
2014-05-25郝华超李少春刘未华孙晓芳
段 斐,郝华超,薛 娟,李少春,刘未华,谷 雨,孙晓芳
(河北大学基础医学院,河北 保定 071000)
·基础研究·
α-玉米赤霉醇对大鼠成骨细胞IL-6 表达及分泌的影响
段 斐,郝华超,薛 娟,李少春,刘未华,谷 雨,孙晓芳
(河北大学基础医学院,河北 保定 071000)
目的 探讨α-玉米赤霉醇对体外培养的大鼠成骨细胞IL-6表达及分泌的影响。方法 体外培养原代SD新生大鼠颅骨成骨细胞,形态学观察、碱性磷酸酶(ALP)染色、I型胶原免疫荧光染色进行成骨细胞鉴定,分别以雌激素及不同浓度的α-玉米赤霉醇作用于成骨细胞,采用RT-PCR法检测IL-6 mRNA的表达,ELISA法检测成骨细胞培养上清中IL-6的含量。结果 10-10~10-5mol/L α-玉米赤霉醇能够抑制成骨细胞 IL-6 mRNA的表达及其蛋白分泌,其中以10-6mol/L、10-7mol/L的α-玉米赤霉醇作用显著。结论 α-玉米赤霉醇能够抑制成骨细胞细胞因子 IL-6 mRNA及蛋白的表达,这可能是α-玉米赤霉醇防治绝经后骨质疏松症的机制之一。
α-玉米赤霉醇;成骨细胞;白细胞介素6;绝经后骨质疏松症
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是一种严重危害老年妇女身体健康及生活质量的常见病,其起病隐匿,常发生在绝经后5~10年,由于卵巢功能衰退,雌激素水平下降,导致骨量减少及骨组织结构变化,骨脆性增加,因其引起的骨折已成为老年人寿命缩短、致畸、致残的主要原因。由于PMOP和雌激素水平降低密切相关,因此雌激素替代疗法(hormore replacement treatment,HRT)是目前防治PMOP的最有效方法之一。但是,长期使用雌激素有诱发乳腺癌、子宫内膜癌、心脑血管疾病、静脉血栓的危险[1]。α-玉米赤霉醇(α-zeranol,α-ZAL)是一种新型植物雌激素,前期实验发现,α-ZAL可以有效改善去卵巢骨质疏松模型大鼠的骨密度和生物力学性能[2-3],为了进一步探讨α-ZAL抗骨质疏松症的机制,实验采用体外培养新生大鼠颅骨成骨细胞,利用不同浓度的α-ZAL干预成骨细胞,观察其对成骨细胞IL-6 mRNA的表达及其蛋白分泌的影响。
1 材 料
1.1 实验动物
SD孕鼠(由河北医科大学实验动物中心提供,动物合格证编号:1004078)所生24 h内新生大鼠10只,性别、体质量不限。
1.2 主要试剂
17β雌二醇(SIGMA公司),α-ZAL(DR. ehrenstorfer Gmbh公司),DMEM培养基(Gibco公司),胎牛血清(四季青公司),胰蛋白酶(AMRESCO公司),I型胶原酶(SIGMA公司),ALP染色试剂盒(北京雷根生物技术有限公司),羊抗鼠I型胶原多克隆抗体(sc-25974),免疫荧光染色试剂盒-抗大鼠Cy3、Hoechst染色试剂盒、Trizol试剂 (上海碧云天生物技术有限公司),PCR引物(上海生工),逆转录试剂盒(MBI Fermentas公司),大鼠IL-6 ELISA检测试剂盒(上海凯博生化试剂有限公司)。
1.3 主要仪器
酶标仪(iMark,Bio-rad),低温低速离心机(DL-5M,湘仪),CO2培养箱(MCO-15AC,SANYO),倒置显微镜(XDS-1A,上海精密仪器仪表有限公司),荧光显微镜(CX31-32RFL,OLYMPUS),超净工作台(BSC-1600ⅡA2,苏州安泰空气技术有限公司),低温高速离心机(Fresco21,Thermo),PCR 仪(DL9700,鼎国昌盛有限公司),电子分析天平(TP-114,丹佛),电泳槽(SUB-CELL GT,Bio-rad),凝胶成像系统(Gel DicTMXR+,Bio-rad),细胞培养板(costar)。
2 方 法
2.1 新生大鼠颅骨成骨细胞的分离培养
将新生24 h SD大鼠脱颈处死后,75%乙醇浸泡消毒10 min,无菌操作取出颅骨,D-Hank's 液清洗后,剔除骨膜、血管和结缔组织,0.01mol/L PBS 液(含青霉素、链霉素)反复清洗。用眼科剪将头盖骨剪成泥状,加入0.25%胰蛋白酶(含0.02EDTA),37℃恒温消化20 min,吸出消化液,加0.1%Ⅰ型胶原酶,37℃消化20 min,低温离心机离心5 min(1 000 r/min),弃上清液,加入含15%血清的DMEM 培养基,吹打骨片,将细胞悬液接种于培养瓶中,置于37℃、5% CO2培养箱中培养。以后每3 d换培养液1次,待生长细胞铺满平皿 80%后,进行传代。每5~7 d传代1次。
2.2 成骨细胞的鉴定
成纤维细胞 ( fibroblast,FB) 是成骨细胞培养时的主要混杂细胞。将新生大鼠颅骨分离的细胞经差速黏附法纯化获得的成骨细胞进行鉴定,经鉴定确认的成骨细胞可用于实验研究。
2.2.1 形态学观察
采用倒置相差显微镜每日观察成骨细胞的生长情况及形态特征。
2.2.2 碱性磷酸酶(ALP)染色
采用改良钙钴法,取第3代的成骨细胞爬片,95%乙醇固定后,按照试剂盒说明进行染色。利用图像测量分析软件IPP7.0分析计算原代培养的成骨细胞纯度,计算公式:成骨细胞纯度 = 染色细胞/全部细胞× 100%。
2.2.3 I型胶原免疫荧光染色
将培养的第3代细胞接种到载玻片上,待细胞贴壁后,4%多聚甲醛固定,用羊抗鼠I型胶原多克隆抗体(1∶200稀释),按照免疫荧光染色试剂盒说明书进行染色,之后使用Hoechst染色试剂盒对细胞核进行染色,荧光显微镜下观察。
2.3 分组及干预
取培养第3代的成骨细胞,调整细胞数为105/mL,接种于培养瓶中培养。当细胞长满瓶底时用10%高糖 DMEM将α-ZAL梯度稀释成10-5、10-6、10-7、10-8、10-9、10-10mol/L,并设阴性及阳性对照(10-8mol/L 17β雌二醇)。孵育48 h后,分别收集培养上清和细胞,-80℃保存。
2.4 RT-PCR测定成骨细胞IL-6 mRNA的表达
按Trizol试剂盒的说明要求,提取细胞总RNA,并用DNA酶处理总RNA,琼脂糖凝胶电泳确定RNA未降解,紫外分光光度计测定浓度。使用逆转录试剂盒,将RNA反转录为cDNA,进行PCR扩增,产物经1%琼脂糖凝胶电泳检测基因的表达。PCR引物见表1。

表1 目的基因检测所用引物
2.5 ELISA检测成骨细胞IL-6的分泌量
将冻存的细胞培养上清标本室温下融解,10倍稀释后按照 IL-6 的 ELISA 试剂盒说明操作,在492 nm 波长下测定样本的吸光度,根据标准曲线计算 IL-6的浓度,最后得出培养上清中 IL-6的实际浓度。
2.6 统计学分析
实验数据以均数±标准差表示,行单因素方差分析 ( One-way ANOVA),多样本组间比较采用SNK-q检验。所有统计学分析借助于SPSS 13. 0 完成,以P<0. 05 为差异有统计学意义。
3 结 果
3.1 成骨细胞形态学观察
原代细胞培养贴壁前呈均匀一致的球形,散在悬浮于细胞培养液中;24 h后少量细胞开始贴壁生长,外观呈长梭形;2 d后大部分细胞贴壁、伸展,细胞体积增大,并向多角形转化,随着培养时间的延长,细胞呈星形生长,并借突起相互连接;5 d后细胞铺满整个培养瓶底部,连接紧密,融合成片,细胞分界不清。传代培养的细胞生长较快,一般在接种后5 h可贴壁生长,培养 3 d细胞可长满瓶壁,其形态与原代培养相同(图1)。
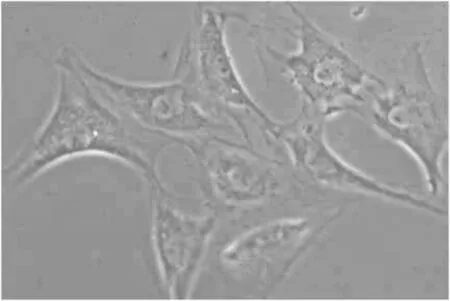
图1 成骨细胞光镜观察(×200)
3.2 ALP染色
光学显微镜下可见,细胞呈梭形、多角形,细胞质中可见灰黑色细微颗粒(图2)。软件分析染色结果显示,阳性染色细胞占全部细胞的比例为 93.27% ± 2.31%,说明细胞纯度较高。

图2 成骨细胞ALP染色(×200)
3.3 I型胶原免疫荧光染色
荧光显微镜下可见,细胞染色呈梭形、多角形,细胞质内可见红色阳性荧光颗粒,细胞核呈蓝色荧光(图3)。说明本实验原代培养的成骨细胞具备合成、分泌Ⅰ型胶原的特点。
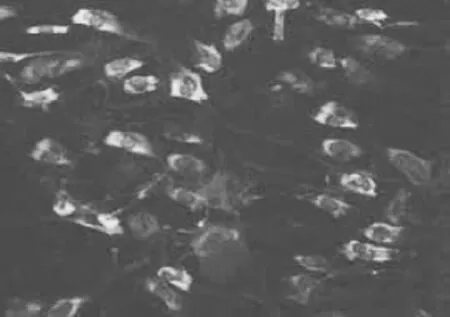
图3 I型胶原免疫荧光染色(×200)
3.4 成骨细胞IL-6 mRNA的表达
与阴性对照组相比较,不同浓度(10-10~10-5mol/L)α-ZAL处理组在作用48 h后均能显著降低成骨细胞IL-6 mRNA的表达(P<0.05);10-6、10-7mol/L α-ZAL处理组与阳性对照组相比较,IL-6 mRNA的表达差异无统计学意义(P>0.05),而其他处理组则显著高于阳性对照组(P<0.05)(图4)。

图4 各实验组成骨细胞中IL-6 mRNA的表达
3.5 成骨细胞IL-6 的分泌量
与阴性对照组相比较,不同浓度α-ZAL处理组在作用48 h后均能显著降低成骨细胞培养上清中IL-6的含量(P<0.05);10-6、10-7mol/L α-ZAL处理组与阳性对照组相比较,上清液中IL-6的含量差异无统计学意义(P>0.05),而其他处理组则显著高于阳性对照组(P<0.05)(图5)。此结果与不同浓度处理组成骨细胞IL-6 mRNA的表达情况相一致。

图5 各实验组成骨细胞IL-6的分泌量
4 讨 论
IL-6主要由成骨细胞、单核细胞、B细胞等多种细胞分泌,作为强有力的骨吸收刺激因子之一,IL-6 可使 GM-CFU 增生,促进破骨细胞生成;诱导成骨细胞产生IL-1、PGE2、PTHrp等,并与之相互协调作用,从而刺激破骨细胞分化,加强破骨细胞活动并抑制其凋亡;介导M-CSF发挥的促进破骨细胞前体的分化与增殖,抑制破骨细胞凋亡[4-6]。研究[7-8]表明,患有PMOP的妇女,在患病的前10年内,反映骨丢失的重要指标是体内的IL-6水平,骨丢失与血清IL-6水平表现出正相关性。 何勇等[9]发现,PMOP妇女血清IL-6水平明显高于绝经后非骨质疏松妇女以及健康育龄妇女组,且患者血清IL-6水平与骨密度呈明显负相关,与骨钙素呈明显正相关。IL-6基因缺陷的小鼠,在卵巢切除后没有骨丢失的表现[10]。Moffett等[11]分析了3 376例年龄超过65岁女性IL-6 G-174C多态性与骨质疏松表型的关系,认为IL-6 G-174C启动子多态性是骨量丢失的一个基因标志。这些均提示,IL-6与PMOP的发生密切相关。
已证实在IL-6基因启动子上存在雌激素反应原件(estrogen response element, ERE),雌激素可通过雌激素受体(estrogen receptor,ER)作用于IL-6基因启动子近端的225bp的基因序列,阻断NF-κB的c-Rel和RelA蛋白与IL-6基因调节区内靶序列的结合,抑制IL-6基因的表达[12]。动物实验显示,以生理浓度范围的雌二醇处理未成熟的SD雌性大鼠,可明显下调大鼠血清中IL-6的含量[13],应用ER-α受体激动剂(PPT)处理实验性自身免疫性脑脊髓炎(EAE)小鼠,可降低小鼠脾细胞IL-6的表达[14]。而人卵巢切除术后或自然绝经后,血清中IL-6增多,雌二醇治疗能降低IL-6的产生[15]。这些结果证实了雌激素对IL-6有负调节作用。
α-ZAL是玉米赤霉烯酮(zearalenone, ZEN)的还原产物,在玉米、小麦、高粱等重要农作物中广泛存在,具有促生长发育、防衰保绿的类激素效应。研究[16-19]发现,α-ZAL具有保护血管内皮细胞,抑制血管平滑肌细胞增殖、迁移以及细胞外基质的合成,抑制血小板的粘附与聚集、抗氧化、改善血脂代谢及血流动力学、降低血管张力等作用,对心血管系统以及神经元均具有广泛的保护作用,这些作用与雌激素相似,但对于子宫与乳腺的刺激却明显小于雌激素,其对子宫内膜癌、乳腺癌等的发病率无明显影响,甚至对子宫、乳腺具有潜在的保护作用[20-21]。以往研究显示,α-ZAL可以有效改善骨质疏松模型大鼠的骨密度和生物力学性能[2-3],上调大鼠胫骨近端骨组织ER-α mRNA的表达[22],说明α-ZAL对卵巢切除所致大鼠骨质疏松症具有明显的防治作用。为了进一步探讨其作用机理,采用RT-PCR和ELISA法对α-ZAL作用下新生大鼠成骨细胞IL-6 mRNA的表达及其蛋白分泌进行检测,结果显示,10-10~10-5mol/Lα-ZAL可显著降低成骨细胞IL-6 mRNA的表达及其蛋白分泌,其中,10-6、10-7mol/L α-ZAL两个处理组的作用效果最好,其与17β雌二醇组在抑制成骨细胞生成IL-6方面的能力一致。由此说明,α-ZAL具有与雌二醇相类似的作用,影响了成骨细胞的自分泌,抑制IL-6的表达。推测α-ZAL在骨重建中发挥类雌激素样作用时,不仅能作用于成骨细胞,促进骨形成,很有可能通过降低IL-6,抑制破骨细胞前体的形成和分化,下调破骨细胞的活性,影响骨吸收,这可能是α-ZAL防治PMOP的机制之一。
[1] REID R L. Progestins in hormon replacement therapy: Impact on endometrial and breast cancer[J]. J SOGC, 2000, 22(9): 677-681.
[2] 李少春, 段斐, 程炜, 等. 植物雌激素α-玉米赤霉醇对去卵巢大鼠骨组织形态学变化的影响[J]. 时珍国医国药, 2011, 22(7):1655-1656.
[3] 李少春, 程炜, 段斐. α-玉米赤霉醇对去卵巢大鼠骨生物力学的影响[J]. 医学研究与教育, 2010, 27(3): 6-8.
[4] PALMQVIST P, PERSSON E, CONAWAY H H, et al. IL-6, leukemia inhibitory factor, and oncostatin M stimulate bone resorption and regulate the expression of receptor activator of NF-kappa B ligand, osteoprotegerin, and receptor activator of NF-kappa B in mouse calvariae [J]. J Immunol, 2002, 169(6): 3353-3362.
[5] KIM S, YAMAZAKI M, SHEVDE N K, et al. Transcriptional control of receptor activator of nuclear factor-kappaB ligand by the protein kinase A activator forskolin and the transmembrane glycoprotein 130-activating cytokine, oncostatin M, is exerted through multiple distal enhancers [J]. Mol Endocrinol, 2007, 21(1): 197-214.
[6] LIU Xinhua, KIRSCHENBAUM A, YAO Shen, et al. Cross-talk between the interleukin-6 and prostaglandin E(2)signaling systems results in enhancement of osteoclastogenesis through effects on the osteoprotegerin/receptor activator of nuclear factorkappaB(RANK)ligand/RANK system[J]. Endocrinology, 2005, 146(4): 1991-1998.
[7] SCHEIDT-NAVE C, BISMAR H, LEIDIG-BRUCKNER G, et a1. Serum interleukin-6 is a major predictor of bone loss in woman specific to the first decade past menopause[J]. Clin Endocrinol Metab, 2001, 86(5): 2032-2042.
[8] 魏合伟, 候书丽, 龚钰, 等. 白细胞介素-6在绝经后骨质疏松发病机制中作用的临床研究[J]. 广州中医药大学学报, 2002, 19(2): 12-13.
[9] 何勇, 刘树琴, 王长江, 等. IL-1、TNF-α在绝经后骨质疏松症发生中的作用[J]. 中国临床保健杂志, 2007, 10(1): 41-43.
[10] POLIV BALENA R, FATTORI E, MARKATOS A. Interleakin-6 deficient mice are protected from bone loss caused by estrogen depletion[J]. EMBO J, 1994, 13(5): 1189-1196.
[11] MOFFETT S P, ZMUDA J M, CAULEY J A, et al. Association of the G-174C variant in the interleukin-6 promoter region with bone loss and fracture risk in older women[J]. J Bone Miner Res, 2004, 19(10): 1612-1618.
[12] SUN W H, KELLER E I, STEBLER B S, et al. Estrogen inhibits phorbol ester induced NF-kappa B alpha transcription and protein degradation[J]. Biochem Biophys Res Commun, 1998, 244(3): 691-695.
[13] 沈苏楠, 费捷. 17β-雌二醇对未成熟雌性大鼠体液免疫及胸腺内雌激素受体的影响[J]. 上海免疫学杂志, 2002, 22(3): 193-196.
[14] MORALES L B, LOO K K, LIU H B, et al. Treatment with an estrogen receptor alpha ligand is neuroprotective in experimental autoimmune encephalomyelitis[J]. J Neurosci, 2006, 26(25): 6823-6833.
[15] BERG G, EKERFELT C, HAMMAR M, et al. Cytokine changes in postmenopausal women treated with estrogens: a placebocontrolled study[J]. Am J Reprod Immunol, 2002, 48(2): 63-69.
[16] DUAN Jinhong, DAI Shunling, FANG CX, et al. Phytoestrogenα-zearalanol antagonizes homocysteine-induced imbalance of nitric oxide/endothelin-1 and apoptosis in human umbilical vein endothelial cells[J]. Cell Biochem Biophys, 2006, 45(2): 137-145.
[17] DENG Wenhui, DAI Shunling, ZHANG Yi, et al. The effects of alpha-zearalanol and estradiol benzoate on expression of c-myc, c-fos and epidermal growth factor receptor mRNAs in breast tissues implanted into nude mice[J]. Gynecol Endocrinol, 2010, 26(2): 144-148.
[18] DONG Yilong, YUE Yun, LIU Fenghua, et al. Treatment with phytoestrogen alpha-zearalanol might protect neurons of hippocampus in ovariectomized rats[J]. Endocrine, 2006, 30(3): 249-254.
[19] DAI Shunling, DUAN Jinhong, LU Jie, et al. Phytoestrogen alpha-zearalanol inhibits atherogenesis and improves lipid profile in ovariectomized cholesterol-fed rabbits[J]. Endocrine, 2004, 25(2): 121-129.
[20] WANG Wen, JIANG Dongqiao, ZHU Yingfen, et al. Relaxing effects of phytoestrogen alpha-zearalanol on rat thoracic aorta rings in vitro [J]. Chin J Physiol, 2009, 52(2): 99-105.
[21] 邓文慧, 吴宜勇, 段金虹, 等. 植物雌激素α玉米赤霉醇对人正常乳腺的影响[J]. 中国医学科学院学报, 2004, 26(5): 566-570.
[22] 李少春, 段斐, 程炜, 等. 植物雌激素α-玉米赤霉醇对去卵巢大鼠骨组织雌激素受体α和β mRNA的影响[J]. 中国老年学杂志, 2011, 31(10): 1786-1787.
(责任编辑:刘俊华)
Effects of α-zeranol on the IL-6 expression and secretion in rat osteoblasts
DUAN Fei, HAO Huachao, XUE Juan, LI Shaochun, LIU Weihua, GU Yu, SUN Xiaofang
(College of Basic Medical Sciences of Hebei University, Baoding 071000, China)
Objective To investigate the effects of α-zeranol on the IL-6 expression and secretion in rat osteoblasts. Methods Osteoblasts were isolated from the skull of SD neonatal rats and identified by morphological observation, ALP staining, and collagen I immunofluorescence staining. 17β-estradiol and α-zeranol with different concentration were administrated. The expression of IL-6 mRNA in the osteoblasts was detected by RT-PCR and the level of IL-6 in culture supernatant of osteoblasts was measured by ELISA. Results α-zeranol with 10-10~10-5mol/L concentrations could inhibit the expression and secretion of IL-6 in osteoblasts, among which the concentrations of 10-6and 10-7mol/L had obvious effects. Conclusion α-zeranol can inhibit the expressions of IL-6 mRNA and protein in osteoblasts, it may play an important role in the prevention of postmenopausal osteoporosis.
α-zeranol; osteoblasts; IL-6; postmenopausal osteoporosis
R977
A
1674-490X(2014)01-0001-07
2013-12-05
河北大学医学学科建设项目(2012A2002); 河北省计生委基金项目 (2010A03)
段斐(1958—),女,河南洛阳人,教授,博士,博士生导师,主要从事植物雌激素对绝经期妇女骨质疏松的治疗的基础研究工作。E-mail: feiduan9999@sina.com
郝华超(1975—),男,河北保定人,副主任医师,在读硕士,主要从事神经外科临床及基础研究。E-mail: 2252676668@qq.com
