一株苯乙烯高效降解菌的分离鉴定及降解特性研究
2014-05-24於建明蔡文吉成卓韦陈建孟蒋轶锋浙江工业大学长三角绿色制药协同创新中心浙江杭州3004浙江工业大学生物与环境工程学院浙江杭州3004
於建明,刘 靓,蔡文吉,成卓韦,陈建孟,蒋轶锋* (.浙江工业大学长三角绿色制药协同创新中心,浙江杭州 3004;.浙江工业大学生物与环境工程学院,浙江 杭州 3004)
苯乙烯为无色透明油状液体,有毒,难溶于水,能溶于醚类及醇类,作为一种重要的化工原料而广泛用于塑料、合成橡胶、树脂等生产中[1].伴随苯乙烯的生产、运输、使用、贮藏过程,会有较大量苯乙烯进入大气和水体,造成大气和水体的污染及危害人体健康[2].近年来,微生物降解法以反应条件温和、降解彻底、运行费用低、无二次污染等优点受到广泛重视[3-5].目前,已报道的苯乙烯降解菌主要有Actinomycetes[6],Pseudomonas fluorescensST[7],Pseudomonassp. SR-5[8],Rhodococcuspyridinovorans[9],Pseudomonas putidaSN1[10],Brevibacillussp.[11]等.
本文采用唯一碳源筛选的方法,从橡胶厂的活性污泥中分离出一株苯乙烯高效降解菌,对其生长特性进行试验分析,考察该菌株在不同条件下(温度、pH值、初始浓度等)对苯乙烯的降解能力.通过降解动力学研究,优化其降解苯系物能力,为解决苯乙烯的污染问题提供一定的基础数据.
1 材料与方法
1.1 样品来源
筛选菌株的样品取自杭州某橡胶厂曝气池活性污泥.经分析,活性污泥的混合液悬浮固体浓度(MLSS)为 8437mg/L,污泥容积指数(SVI)为123.4mL/g,有效活菌数为3.48×1010CFU/mL.
1.2 培养基类别
无机盐液体培养基(g/L):KH2PO40.376,K2HPO4·3H2O 0.456, (NH4)2SO40.484, NaNO30.68, Mg(NO3)20.256, CaCl20.011,微量元素(MnCl2·H2O 0.06, ZnCl20.088, KI 0.01,NaMoO4·2H2O 0.1, H3BO30.05),蒸馏水 1000mL,pH值7.0; 110℃灭菌40min,添加一定量苯乙烯作为唯一碳源.
LB固体培养基(g/L):蛋白10,酵母浸5, NaCl 5,琼脂 18,蒸馏水 1000mL.pH 值 7.0,121℃灭菌20min.
无机盐固体培养基:无机盐液体培养基中加入琼脂(18g/L),121℃灭菌 20min后取用,倒至培养皿待冷却制成固态平板培养基,将无菌的棉花置于培养皿中,定时向棉花上添加一定量苯乙烯作为碳源.
1.3 主要仪器与试剂
全自动微生物鉴定仪(Biolog,美国);3S柱离心式环境DNA回收试剂盒V2.2(申能博彩,上海);PCR扩增仪(Bio-rad,美国);气相色谱(Agilent 6890,美国);分光光度计(HITACHI U-2910,日本);荧光-光学显微镜(Nikon DS-Fi1,日本);电子天平30℃、160r/min的摇床富集培养转接.取一定量盐水瓶中的菌液进行梯度稀释,并涂布至配好的无机盐固体筛选培养基中,30℃培养 3~4d后,挑取培养平板上的单菌落,接入添加苯乙烯的无机盐培养基中,置于 30℃,160r/min的摇床中培养,经反复筛选,最后筛选出一株具有高效降解苯乙烯能力的菌株,并于4℃ LB斜面保藏.(Sartorius BT224S,北京);便携式 pH 计(WTW 330i,德国);苯乙烯(巨化,衢州);衍生化试剂:吡啶(阿拉丁,上海)、BSTFA(百灵威,上海).
1.4 菌株分离纯化
将曝气池活性污泥置于棕色广口瓶中,以苯乙烯为唯一碳源并同时曝气驯化数周后,从广口瓶取5mL活性污泥至含有50mL无机盐培养基的密封培养瓶中,加入 200mg/L的苯乙烯,置于
1.5 菌株鉴定
菌株的生理生化试验方法参考《常见细菌系统鉴定手册》[12].Biolog试验方法参考文献[13-14],采用GN3通用碳源鉴定板.
采用3S柱离心式环境样品DNA回收试剂盒 V2.2(申能博彩生物科技有限公司,上海)提取菌株的 DNA.主要流程包括:破裂细菌细胞膜和细胞壁、去除蛋白质、DNA沉淀及DNA纯化.选用细菌通用引物BSF8/20和BSR1541/20(宝生物工程有限公司,大连)[15]进行PCR扩增[16].扩增后产物委托杭州华大基因研发中心测序,利用BLAST将测得的基因序列与GenBank内的16S rRNA基因序列进行同源性比对分析[17],选取1400bp左右长度进行比对[Clustelx(1.83)],采用邻位连接(NJ)法进行系统学分析[MEGA(5.1)],确定菌株的属种情况并命名.
1.6 菌株降解特性考察
1.6.1 环境因素对降解效率的影响 采用“单因素试验法”分别考察温度、pH值对菌株降解苯乙烯效率的影响,单因素设置如下:控制pH值7.0,温度为 25、27.5、30、32.5、35、37.5、40℃;控制温度为 30℃,pH 值为 4、5、6、7、8、9、10.取对数生长期的菌液离心洗涤后悬浮于磷酸缓冲溶液中(0.05mol/L,pH值7.0).取250mL玻璃培养瓶中加入 50mL无机盐液体培养基,并向其中加入上述的菌悬液(控制培养液初始生物量18.2mg/L)和 200mg/L 的苯乙烯,橡胶塞密封,置于不同条件下连续培养,同时设置空白对照组(不添加菌液),定时测定培养液中残留的苯乙烯和生物量.
1.6.2 苯乙烯初始浓度对降解效率的影响 将上述的菌悬液(控制培养液初始生物量18.2mg/L)加入含50mL无机盐培养液(pH值7.0)的250mL培养瓶中,并分别向其中加入一定量液态苯乙烯,控制其初始浓度分别在25、50、100、200、300、500、800、1000、1500、2000mg/L 浓度,橡胶塞密封,置于 30℃,160r/min的摇床中连续培养,同时设置空白对照组,定时测定培养液中残留的苯乙烯和生物量.
1.6.3 菌株对多种碳源的降解能力 将上述的菌悬液(控制培养液初始生物量 18.2mg/L)加入含50mL无机盐培养液的250mL培养瓶中,并分别加入等浓度(200mg/L)的苯、甲苯、乙苯、邻二甲苯、间二甲苯、对二甲苯、氯苯、正己烯及二氯甲烷等工业中常见的有机污染物.橡胶塞密封,置于 30℃,160r/min的摇床中连续培养,同时设置空白对照组,定时测定培养液中残留的底物量和生物量.
1.7 分析方法
1.7.1 苯乙烯残留浓度分析 采用气相色谱对摇瓶内的气相苯乙烯浓度进行定量分析,色谱柱为 HP-Innowax 毛细管柱(30m×320μm×0.5μm),进样口和检测器(FID)的温度分别为 250℃和300℃,柱温为 155℃,N2载气,柱流速 2mL/min,进样体积 600μL.液相中苯乙烯浓度经正己烷萃取后亦采用气相色谱进行分析,色谱柱为HP-Innowax毛细管柱,进样口和检测器(FID)的温度分别为250℃和300℃.采用程序升温: 70℃维持3min,30℃/min升温至155℃维持3min. N2载气,柱流速2mL/min,进样体积2.0μL.
1.7.2 菌体生物量测定 采用分光光度计测定菌液在600nm波长处的吸光度值(OD600)及电子天平测定菌液对应浓度下的细胞干重,用定量滤纸滤过该菌悬液后,置于95℃恒温烘箱烘至恒重,测量滤纸前后的质量变化即为细胞干重量,绘制吸光度与细胞干重关系标准曲线,然后根据不同吸光度值计算细胞干重(mg/L).
1.7.3 中间产物分析 采用 GC-MS(Agilent6890-5973N),色谱柱为 HP-5毛细管柱(30m×0.32mm×0.25μm),定时对摇瓶中的培养液经萃取、衍生化[18]后的样品进行检测.检测条件:载气为氦气,柱流速为 1.0mL/min.柱温采用升温程序:初始温度为60℃,保留2min,20℃/min升高到280℃,保留2min;进样口温度为250℃,进样采用不分流模式,进样量为1.0mL;四级杆150℃,辅助通道温度250℃,溶剂延迟时间为2min,电离方式为EI,离子源温度为230℃.
2 结果与讨论
2.1 菌株鉴定
2.1.1 生理生化试验 通过分离纯化,筛选出一株具有高效降解苯乙烯能力的菌株,命名为 WJ.该菌株在无机盐固体培养基30℃培养48h后,形成透明、表面光滑、边缘整齐的菌落.透射电镜观察(图1),该菌株多鞭毛、呈椭球状、大小约为0.9μm×2.2μm;菌株革兰氏染色为阴性,结果见表1,结合伯杰氏手册中关于假单胞菌形态和特性的描述,初步确定该菌株属于假单胞菌属(Pseudomonassp.).

表1 菌株WJ的生理生化特性Table 1 Physiological and biochemical characteristics of strain WJ
2.1.2 16S rRNA基因序列分析 菌株 WJ的16S rRNA基因经PCR扩增和测序后,上传序列至 GenBank,获得该菌株的基因序列登录号(JX569146),与 GenBank内已知基因序列进行同源比对分析,建立系统发育树,确定其发育关系,确定该菌株与Pseudomonas putidastrain1589[JN679854]的可信度达 91%,结合菌株生理生化特性,可以确定该菌株属于Pseudomonas属.该菌株WJ保藏于中国典型培养物保藏中心(CCTCC),保藏号为M 2012295.

图1 菌株WJ的透射电镜图Fig.1 TEM photo of strain WJ
2.1.3 菌株Biolog鉴定 采用GN3通用碳源鉴定板分析菌株对95种碳源的利用能力,将鉴定结果与Biolog系统数据库(V5.2.01)进行比对,进一步确定其属种情况,进而提高鉴定结果的可靠性.30℃培养22h后菌株WJ比对结果表明其属于Pseudomonas putida,SIM值为0.831(临界值为0.75)[19],为良好匹配,且 Biolog所得鉴定结果与16S rRNA分析结果一致,最终可确定菌株WJ属于Pseudomonas putida.
2.2 温度与pH值对菌株降解效率的影响
在不同温度下培养 20h后测得培养液中残留的苯乙烯和生物量(图 2).结果表明,不同温度下苯乙烯降解率和菌株 WJ生物量 (mg/L)具有明显差异,生物量和降解率随着温度的升高而逐渐升高,但温度高于一定值(30℃)后,降解率和生物量反而下降.这是由于微生物的降解过程一般为酶促反应,温度低时菌株生长缓慢、代谢活性差,随着温度的升高,酶的活性随之增加,当温度超过最适宜温度范围之后,酶就逐渐变性和失去活性,从而影响对底物的降解效率[20].在本试验条件下,当温度30℃时,菌株WJ生长最快,生物量达到 101.38mg/L,菌株对苯乙烯的降解率最大达到99.3%,表明30℃为该菌株的最适生长温度.
在不同pH值下培养20h后测得培养液中残留的苯乙烯和生物量(图3)可知,当培养液pH值为4和10时,菌株基本不能降解苯乙烯,且生物量减少.菌株在pH值5~9的范围内均能生长,且pH值呈中性时,菌体生长稳定和苯乙烯降解效率高,可见培养液的酸碱度对生物降解有明显影响.当溶液中pH值超过生物酶的适应范围就有可能改变酶蛋白结构,从而抑制酶的活性.在 pH值为 7时,菌株WJ的生长和降解速率最快,对苯乙烯的去除率达到95.77%,生物量达到102.5mg/L,表明最适宜菌株WJ生长和降解苯乙烯的pH值是7,该结果与文献[10]报道的Pseudomonas putidaSN1菌株最佳生长的pH值和温度一致.
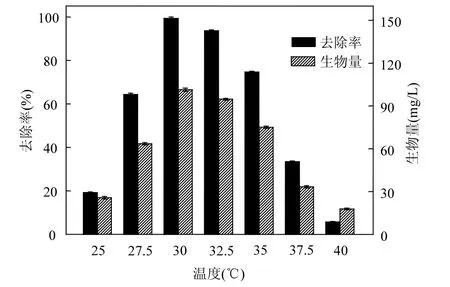
图2 温度对菌株WJ降解苯乙烯及其生长速率的影响Fig.2 Effects of temperature on styrene degradation and the growth of strain WJ

图3 pH值对菌株WJ降解苯乙烯及其生长速率的影响Fig.3 Effects of pH on styrene degradation and the growth of strain WJ
2.3 菌株WJ底物宽泛性研究
实际工业废气往往是多组分的有机污染物共存,因此考察菌株 WJ对其他污染物的降解能力尤为重要,菌株对 BTEX、氯苯、正己烯及二氯甲烷等工业中常见的污染物降解情况见表 2.结果表明,菌株WJ能不同程度地降解苯、甲苯、乙苯、二甲苯等 BTEX,以及正己烯等碳氢化合物,但基本不能利用氯苯、二氯甲烷等卤代烃.
微生物对污染物降解情况往往取决于有机污染的分子结构、化学稳定性[21],以BTEX为代表的苯环类和正己烯为代表的烯烃类化合物是与苯乙烯结构类似的物质,菌株具有相关酶系能有效氧化分解这些物质,因此菌株能不同程度地降解这些物质,而氯苯、二氯甲烷类等卤代烃由于 C-Cl键能极大,致使生物降解此类物质较为困难.该菌株能降解部分常见的工业废气,尤其是对于与苯乙烯结构类似的物质具有良好降解能力,表明该菌株具有良好的底物宽泛性.
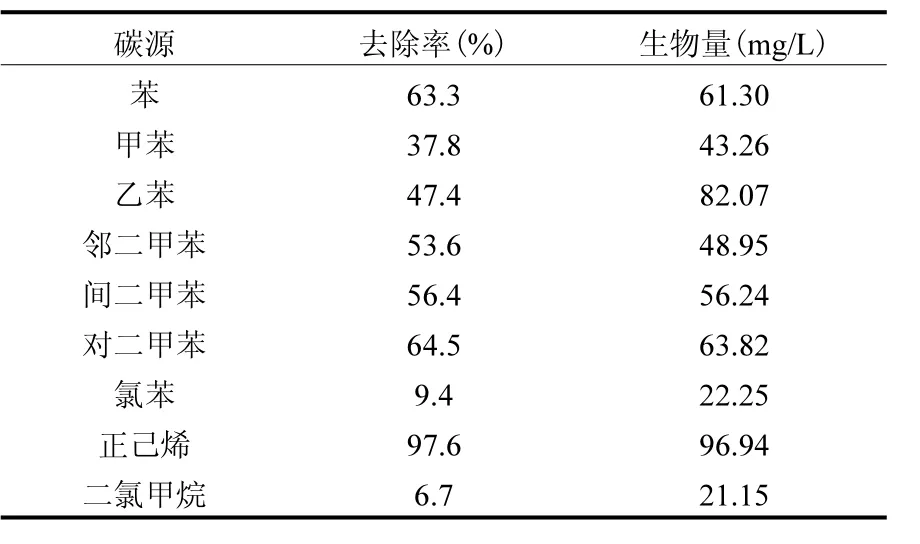
表2 菌株WJ对于不同碳源的降解能力与生物量Table 2 Biodegrading ability and biomass of different carbon sources by WJ strain
2.4 不同初始浓度苯乙烯对菌株降解效率的影响

图4 菌株WJ对不同初始浓度苯乙烯的降解曲线Fig.4 Styrene degradation by strain WJ at different initial concentration
苯乙烯作为一种有机污染物,具有一定的生物毒性,过高浓度的苯乙烯可能会致使微生物细胞发生遗传毒性变异及毒害细胞正常的代谢,并干扰降解辅酶的再生过程[22].在最佳生长条件下,考察菌株 WJ对不同初始浓度苯乙烯的降解特性(图4),结果表明菌株WJ能完全降解浓度低于1500mg/L的苯乙烯,在此范围内随着浓度(>500mg/L)的增加,菌株降解适应期开始趋长[23];当苯乙烯浓度达到 2000mg/L时,菌体细胞生长进入明显的停滞期,且20h后生物量开始消亡,这种由于高浓度底物引起菌株滞后生长的影响并毒害细胞的现象称为底物的抑制作用.Babaee等
[24]报道的生物彻底降解初始苯乙烯浓度为69.25mg/L需要 25h,在初始苯乙烯浓度为 150~200mg/L时即出现大幅的滞后期,而本试验筛选到的菌株WJ在耐受浓度、降解性能上均优于上述文献报道的菌株.
2.5 菌株WJ降解苯乙烯的动力学
Haldane’s方程是最常用的细胞生长动力学模型之一[25],采用该模型对菌株 WJ降解不同初始浓度苯乙烯过程进行拟合,其表达式如下[26-28]:
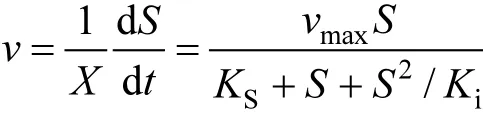
式中:v为菌株比降解速率,h-1;X为菌浓度,mg/L;S为底物浓度,mg/L;t为时间,h;vmax为最大比降解速率,h-1;Ks为半饱和系数,mg/L;Ki为抑制系数,mg/L.
菌株WJ以苯乙烯为底物的Haldane’s方程拟合曲线如图5所示,随着苯乙烯浓度的增加,比降解速率逐渐增大,在苯乙烯浓度为200mg/L时达到最大值,随着苯乙烯浓度的继续增加,比降解速率逐渐下降.这可能是由于低浓度苯乙烯培养基中碳源不足以供应微生物生存,而高浓度苯乙烯溶液表现出底物抑制作用.所得实验数据与模型预测具有较高的相关系数R2=0.955,菌株 WJ降解苯乙烯过程中的 Haldane’s方程动力学参数:vmax=0.282h-1,Ks=23.57mg/L,Ki=1784.56mg/L,Ki越高,底物抑制作用越不明显,表明菌株 WJ对苯乙烯具有良好的耐受性和降解性.

图5 菌株WJ降解苯乙烯的比降解动力学曲线Fig.5 Specific degradation kinetics curve for the strain WJ degrading styrene
2.6 菌株WJ降解苯乙烯的途径

图6 菌株WJ降解苯乙烯的中间产物GC-MS检测结果Fig.6 The GC-MS detection result of styrene intermediates that degraded by Strain WJ
利用GC-MS对该菌株WJ降解苯乙烯的衍生化产物分析,检测获得几种降解产物如图 6所示,依次为氧化苯乙烯、苯乙醛、苯乙酸.吴献花等[29]研究指出苯乙烯微生物需氧降解的两条主要途径包括乙烯基侧链的氧化和芳香环开裂(图7),图中实线已被证实,虚线表示还需进一步证明的.中间代谢产物,结果表明该菌株降解苯乙烯的可能氧化途径为乙烯基侧链的氧化,与文献[29-30]报道的乙烯基侧链的氧化途径相一致,这可能是由于该菌株氧化乙烯基的能力强于氧化芳香环开环能力,对苯乙烯的乙烯基侧链的生物氧化途径做了进一步的验证.

图7 苯乙烯生物降解的主要途径Fig.7 The main biodegradation pathways of styrene
3 结论
3.1 筛选得到的一株能以苯乙烯为唯一碳源和能源的高效降解菌株 WJ,经生理生化试验、Biolog鉴定和16S rRNA基因发育树等方法鉴定该菌株为Pseudomonas putida.
3.2 菌株 WJ较适宜的培养条件为:温度 30℃,pH值7,该条件下对菌株生长和对降解苯乙烯效率有明显的促进作用,菌株能完全降解初始浓度为 0~1500mg/L的苯乙烯,但当苯乙烯初始浓度为2000mg/L时,菌体生长代谢则受到明显抑制.
3.3 菌株WJ的降解动力学符合Haldane’s模型,实验数据与模型预测具有较高的相关系数R2=0.955,相应的动力学参数为:vmax=0.282h-1,Ks=23.57mg/L,Ki=1784.56mg/L.
3.4 菌株WJ宽泛性试验表明,菌株对于BTEX,正己烯等与苯乙烯结构类似的碳氢化合物具有良好的降解能力,但对氯苯、二氯甲烷等卤代烃则基本不能利用.
3.5 GC-MS检测结果表明,菌株 WJ氧化降解苯乙烯的主要可能途径为乙烯基侧链的氧化,这可能是由于该菌株氧化乙烯基的能力强于氧化芳香环的能力.
[1]张 放,邵 华.苯乙烯职业暴露危害研究进展 [J]. 中国公共卫生, 2006,22(9):1145-1146.
[2]Marczynski B, Peel M, Baur X. New aspects in genotoxic risk assessment of styrene exposure—a working hypothesis [J]. Med.Hypotheses, 2000,54(4):619–623.
[3]Rene E R, Spackova R, Veiga M C, et al. Biofiltration of mixtures of gas-phase styrene and acetone with the fungusSporothris variecibatus[J]. J. Hazard. Mater., 2010,184(1-3):204-214.
[4]Hassan A A, Sorial G. Biological treatment of benzene in a controlled trickle bed air biofilter [J]. Chemosphere, 2009,75(10):1315-1321.
[5]Shokrollahzadeh S, Azizmohseni F, Golmohammad F, et al.Biodegradation potential and bacterial diversity of a petrochemical wastewater treatment plant in Iran [J]. Bioresour.Technol., 2008,99(14):6127–6133.
[6]Pol A, Haren F J J van, Camp H J M Op den, et al. Styrene removal from waste gas with a bacterial biotrickling filter [J].Biotechnol. Lett., 1998,20(4):407-410.
[7]Giuseppina Bestetti, Patrizia Di Gennaro, Andrea Colmegna, et al.Characterization of styrene catabolic pathway in Pseudomonas fluorescens ST [J]. Int. Biodeter. Biodegr., 2004,54:183-187.
[8]Jang J H, Hirai M, Shoda M. Styrene degradation byPseudomonassp SR-5in biofilters with organic and inoganic packing materials [J]. Appl. Microbio. Biotechnol., 2004,65:349-355.
[9]Gyung Jung,Chang-Ho Park. Characteristics of styrene degradation byRhodococcus pyridinovoransisolated from a biofilter [J]. Chemosphere, 2005,61(4):451-456.
[10]Mi So Park, Ju Hee Han, Seung Shick Yoo, et al. Degradation of Styrene by a New IsolatePseudomonas putidaSN1[J]. Korean J.Chem. Eng., 2005,22(3),418-424.
[11]Jae Woong Hwang, Cha Yong Choi, Sunghoon Park, et al.Biodegradation of gaseous styrene byBrevibacillussp. using a novel agitating biotrickling filter [J]. Biotechnol. Lett., 2008,30:1207-1212.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册 [M]. 北京:科学出版社, 2001:370-399.
[13]Pires M N, Seldin L. Evaluation of Biolog system for identif i cation of strains ofPaenibacillus azotof i xans[J]. Anton.Leeuw. Int. J. G., 1997,71:195–200.
[14]Zhang L L, Zhu R Y, Chen J Y, et al. Seawater-retting treatment of hemp and characterization of bacterial strains involved in the retting process [J]. Process Biochem., 2008,43(11):1195-1201.
[15]成卓韦,顾信娜,蒋轶锋,等.一株 α-蒎烯降解菌的分离鉴定及降解特性研究 [J]. 中国环境科学, 2011,31(4):622-630.
[16]Zhang L L, Chen J M, Fang F. Biodegradation of methylt-butylether by aerobic granules under a cosubstrate condition [J]. Appl.Microbiol. Biot., 2008,78(3):543-550.
[17]Available from: http://www.ncbi.nlm.nih.gov/blast/.
[18]Yu J Z, Flagan R C, Seinfeld J H. Identification of products containing –COOH, -OH and –C=O in atmospheric oxidation of hydrocarbons [J]. Environ. Sci. Technol.,1998,32(16):2357- 2370.
[19]Pires M N, Seldin L. Evaluation of biolog system for identification of strains ofPaenibacillus azotofixans[J]. Anton.Leeuw. Int. J. G., 1997,71(3):195-200.
[20]周玉央,陈东之,金小君,等.食油假单胞菌 DT4菌株对四氢呋喃(THF)的降解特性 [J]. 环境科学, 2011,32(1):266-271.
[21]Raymond J W, Rogers T N, Shonnard D R, et al. A review of structure-based biodegradation estimation methods [J]. J. Hazard.Mater., 2001,84(2/3):189-215.
[22]Morgan-Sagastume J M, Noyola A. Hydrogen sulfide removal by compost biofiltration: effect of mixing the filter media on operational factors [J]. Bioresource Technol., 2006,97(13):1546-1553.
[23]Arinjay Kumar, Shashi Kumar, Surendra Kumar. Biodegradation kinetics of phenol and catechol usingPseudomonas putidaMTCC 1194 [J]. Biochem. Eng. J., 2005,22(2):151-159.
[24]Babaee R, Bonakdarpour B, Nasernejad B, et al. Kinetics of styrene biodegradation in synthetic wastewaters using an industrial activated sludge [J]. J. Hazard. Mater., 2010,184(1–3):111–117.
[25]Agnieszka Gąszczak, Grażyna Bartelmus, Izabela Greń. Kinetics of styrene biodegradation byPseudomonassp.E-93486P [J]. Appl.Microbiol. Biotechnol., 2012,93(2):565–573.
[26]Marie C D, Josiane N, Louise B, et al.A new method to determine themicrobial kinetic parameters in biological air filters[J]. Chem. Eng. Sci., 2008,63(16):4126-4134.
[27]Littlejohns J V, Daugulis A J. Kinetics and interactions of BTEX compounds during degradation by a bacterial consortium [J].Process Biochem., 2008,43(10):1068-1076.
[28]Okpokwasili G C, Nweke C O. Microbial growth and substrate utilization kinetics [J]. Afr. J. Biotechnol., 2006,5:305-317.
[29]吴献花,孙 石,邵 丹,等.苯乙烯微生物降解机理的研究进展[J]. 生物技术, 2004,14(6):79-81.
[30]Aisling Mooney·Patrick G, Ward·Kevin E O’Connor. Microbial degradation of styrene: biochemistry, molecular genetics, and perspectives for biotechnological applications [J]. Appl.Microbiol. Biotechnol., 2006,72:1–10.
