一株辛基酚聚氧乙烯醚降解菌的筛选、鉴定及其降解
2014-05-24关向杰贺强礼黄水娥杨海君湖南农业大学植物保护学院湖南长沙410128
关向杰,贺强礼,黄水娥,狄 准,杨海君 (湖南农业大学植物保护学院,湖南 长沙 410128)
辛基酚聚氧乙烯醚(OPnEO)类非离子表面活性剂由于性能优良已在工业相关领域得到广泛应用,随着大型聚氧乙烯装置的建成投产和国民经济的快速增长而成为第二大类非离子表面活性剂.由于辛基酚聚氧乙烯醚及其中间代谢产物具有难降解、疏水性、脂溶性和生物累积等特性,大量使用必然会产生环境污染问题[1-5].OPnEO污染的治理方法很多,如混凝沉降法、泡沫分离法、催化氧化法及活性污泥法等,但最佳的方法是生物降解法[6].关于OPnEO降解菌的研究已有很多报道[7-11],但大多数工作主要集中在降解菌的筛选、降解性能、降解途径和影响因素等方面.除 2006年日本学者 Tasaki等[12]报道OPnEO降解基因 adh1外,一直没有关于分子水平上 OPnEO降解机理的研究.本研究从受TX-100(OPnEO,n=9~10)长期污染的制革废水中分离到一株可利用 TX-100作为唯一碳源的细菌,命名为H1,并利用生理生化和16S rDNA序列分析对其进行鉴定.采用 LC-MS和 UPLC-QTOF-MS对降解产物和降解途径进行了分析和推测.此外还从分子水平上证实了菌株 H1中存在 TX-100降解性质粒.研究结果为处理环境污染物及进一步从分子水平上克隆与OPnEO降解有关的基因和构建高效降解多种污染物的基因工程菌奠定了基础.
1 材料与方法
1.1 材料
1.1.1 培养基 溶菌肉汤培养基(LB):酵母浸出物 5.0g/L,胰蛋白胨 10.0g/L,氯化钠 10.0g/L,pH7.2.筛选培养基(g/L)[11]:NaCl (0.5), (NH4)2SO4(2.0), MgSO4(0.24), CaCl2(0.01), Na2HPO4(6.8),KH2PO4(3.0),TX-100(1.0),维生素溶液(2mL/L),微量元素溶液(1mL/L).降解培养基(TX-A)[13]培养基成分如下(g/L):NaCl (2.5), (NH4)2SO4(2.0),MgSO4·7H2O (0.3), CaCl2(0.01),Na2HPO4(3.7),KH2PO4(0.9),TX-100(1.0),维生素溶液(2.0mL/L),微量元素溶液(1.0mL/L).维生素溶液成分(mg/100mL):盐酸吡多辛(10.0),核黄素(5.0),盐酸硫胺素(5.0),硫辛酸(5.0),对氨基苯甲酸(5.0),叶酸(2.0),维生素H(2.0),维生素Bc(2.0),维生素B12(0.1),过滤灭菌.微量元素溶液的成分(mg/100mL):MnCl2·4H2O(20.0),CoCl2·6H2O(4.0),Na2MO4·2H2O(26.0),FeCl3·6H2O(15.0),配好后经高压灭菌121℃、20min,备用.
1.1.2 主要试剂 TX-100(纯度>99%)购于Sigma-aldrich公司,主要成分为OP9EO和OP10EO;十二烷基磺酸钠(纯度>99%)购于深圳鹏程化学试剂有限公司,其余化学试剂均为分析纯.
1.1.3 常用仪器 紫外可见分光光度仪(SHIMADZU,UVmin1240,Japan)、电泳仪(北京六一仪器厂,DYY-8C)、PCR扩增仪(ABI,verity,USA)、凝胶成像分析系统(Kodak,Gel Logic 212,USA),高效液相色谱仪(SHIMADZU,LC-20AT,Japan)液相色谱-质谱联用仪(Agilent, UPLC(1290)-Q-TOF(6530),ACQUITY-SQD,USA)等.
1.2 实验方法
1.2.1 TX-100降解菌的富集、分离和纯化 取皮革厂曝气池废水1mL加入到装有100mL无菌水的三角瓶中,放入恒温振荡培养器中,30℃,200r/min振荡培养 1h,再取 1mL加入到 100mL含1.0g/L TX-100的LB中,30℃、200r/min振荡培养16h,然后将此菌悬液1mL加入到100mL含1.0g/L TX-100的筛选培养基中,30℃、200r/min振荡培养24h,将此菌悬液制成10-1到10-7的稀释液,然后分别取 100µL涂布于筛选培养基平板上,30℃倒置于培养.用接种环挑取其中清晰可见的不同单菌落,在 LB平板上反复划线分离,得到纯菌株.
1.2.2 形态特征鉴定 观察降解菌菌落的大小、表面形态、光泽度、粘稠度、润湿情况、隆起和边缘特征等,显微镜观察菌株大小及形态.
1.2.3 降解菌生理生化特性测定 采用广州环凯微生物科技有限公司的非发酵细菌鉴定管(产品编号:070150),按照说明书操作.另采用法国梅里埃公司 VITEK 2COMPACT 全自动微生物鉴定药敏检测系统仪对降解菌进行快速培养鉴定和药敏实验.采用 0.3g/L Cr3+和0.6g/L Cr6+的LB培养基培养H1,检测该菌对重金属铬的耐受性.
1.2.4 16S rDNA序列的鉴定 细菌基因组提取采用天根生化(北京)有限公司细菌基因组DNA 提取试剂盒.方法见说明书.采用上海生工生物工程技术服务有限公司的细菌16S rDNA通用引物(27F:5′AGAGTTTGATCCTGGCTCAG3′和 1492R: 5′AAGGAGGTGA TCCAGCCGCA3′),以基因组DNA为模板进行16S rDNA的PCR扩增,产物经琼脂糖电泳检测后送上海生工生物工程技术服务有限公司测序,并建立系统发育树.
1.2.5 降解实验 在无菌条件下,用生理盐水(NaCl 0.85%)将培养好的菌液离心洗涤 3次,再加入适量生理盐水振荡均匀制成OD600=1.0的菌悬液.按照2%的接种量向TX-A培养基中加入制备的菌悬液,然后置于30℃、160r/min振荡培养14d后,高效液相法(HPLC)测定TX-100的含量,并计算降解率.TX-100降解率=(Cck-Ct)/Cck×100%, Cck为空白处理中TX-100的浓度,Ct为振荡培养若干天后残留的TX-100浓度.
1.2.6 TX-100降解率测定和降解产物分析高效液相法(HPLC)测定 TX-100的含量:称取0.5g TX-100用色谱甲醇溶解并定容到 100mL,作为TX-100的标准储备液.向系列10mL容量瓶中分别加入 0、0.02、0.10、0.20、0.40、0.60、1.00mL TX-100标准储备液,用色谱甲醇稀释至刻度.经 0.22μm 微滤膜过滤后.在 HPLC上进样测定.样品前处理:降解培养基中加入等体积的甲醇混匀,取1000µL加入甲醇定容到2mL容量瓶后12000r/min离心30min,过0.22 μm有机滤膜后进高效液相色谱测定TX-100的残留量.HPLC条件:分离柱:ZORBAX Edipse XDB-C18;流动相:V(甲醇): V(水)=90:10;波长:226nm;紫外检测器:流速:1.0mL/min;柱温:26℃.
采用液质联用(ULPC-MS和UPLC-Q-TOF)测定溶液中 TX-100及其中间产物:将 TX-100标准储存液用色谱甲醇稀释到 100μg/L.样品加入等体积色谱甲醇混匀后取1mL用色谱甲醇稀释到 100μg/L(ULPC-MS)和 10μg/L(UPLC-QTOF),离心过 0.2μm 有机滤膜后上机,进样量为10μL.UPLC 条件:Agilent XDB-C18色谱柱;柱温为35℃,流速为0.25mL/min;流动相A为0.1%甲酸溶液,流动相 B为乙腈,梯度洗脱程序为0~4min,10% B;4~4.1min,80% B;4.1~9min,10%B.UPLC-Q-TOF中UPLC色谱条件:流动相A为0.1%甲酸溶液,流动相B为乙腈,梯度洗脱程序为0~10min,10% B;10~10.1min,95% B;10.1~15min,10% B.质谱条件:采用ES+离子模式,m/z范围50~1000.Q-TOF条件:采用电喷雾电离离子源 ESI,正离子电离模式,m/z范围100~1500.
1.2.7 乙醛和乙醛酸的检测方法 乙醛的检测采用亚硫酸氢钠加成法[14],乙醛酸的检测采用高锰酸钾滴定法[15].
1.2.8 质粒的检测 采用全式金生物技术有限公司的质粒小提试剂盒.
1.2.9 质粒的消除 采用系统浓度 SDS法[16]和变温SDS法[17].采用影印法[18]对能在LB平板上生长,而不能在 TX-A培养基上生长的质粒消除后衍生菌进行质粒检测和药敏检测.
2 实验结果
2.1 TX-100的标准曲线
以 TX-100(OPnEO, n=9~10)浓度做横坐标,HPLC测定的峰面积为纵坐标得到如图 1的标准曲线,R2=0.9997.
2.2 降解菌的分离纯化
经过富集、分离和纯化,获得一株能在含1.0g/L高浓度TX-100的无机盐培养基平板上迅速生长的细菌.同时,对该菌进行降解实验,经30℃、160r/min培养14d后,TX-100降解率到达81.69%,说明具有降解TX-100的能力,命名为H1.并对该菌进行驯化,采用含TX-100浓度为 1.0,1.5,2.0,2.5,3.0g/L筛选培养基,从低浓度到高浓度逐步驯化后使其可在更高浓度条件下生长.采用甘油保藏法保存菌株 H1于-80℃冰箱.

图 1 TX-100标准曲线Fig.1 Calibration curve of TX-100solution
2.3 降解菌的鉴定
2.3.1 形态特征鉴定 菌株H1的菌落呈圆形、中间隆起、边缘整齐、湿润有光泽、较粘稠.菌株细胞呈短杆状,有链状排列,革兰氏染色阴性,有荚膜,无鞭毛和芽孢,其菌落形态、显微镜照片见图2~图5.

图2 H1的菌落照片Fig.2 Colonies photos of H1

图3 H1的荚膜形态Fig.3 The bacterial capsule picture of H1

图4 H1的扫描电镜照片Fig.4 SEM image of H1

图5 H1的透射电镜照片Fig.5 SEM image of H1
2.3.2 生理生化鉴定 采用广州环凯微生物科技有限公司的非发酵细菌鉴定管(产品编号:070150),结果见表1.

表1 H1的生理生化鉴定结果Table 1 Results of physiological and biochemical tests of H1
查看非发酵细菌生化鉴定编码册,鉴定 H1生理生化特性与醋酸钙不动杆菌相似性较高,机率为 0.5344,说明该菌株很典型.另外,采用法国梅里埃公司VITEK 2COMPACT全自动微生物鉴定药敏检测系统仪对降解菌H1进行快速培养鉴定及药敏实验,鉴定 H1药敏性与鲁氏不动杆菌相近,其药敏结果见表 2.菌株 H1对多种抗生素具有耐受性,这与报道的不动杆菌多具有耐药性[19-21]是一致的.2种鉴定结果的差异,可能由于本实验用的全自动微生物鉴定系统的菌种数据库不全,该数据库主要针对医学病原菌.另外,该菌对重金属铬有一定耐受性,在 0.3g/L Cr3+和0.6g/L Cr6+的LB培养基中能正常生长.
2.3.3 分子生物学鉴定 菌株H1总DNA的提取按照天根细菌基因组DNA提取试剂盒说明书操作,得到菌株 H1的总 DNA.以菌株 H1的总DNA为模板,利用细菌16S rDNA通用引物进行PCR扩增到片段大小为1500bp左右,经测序得到长为 1451bp的 16S rDNA序列.将已测序列在NCBI上Blast分析,结果显示H1与Acinetobactersp.具有很高的同源性(大于 97%),并构建系统发育树,结果见图 6.根据形态学观察、生理生化鉴定和16S rDNA同源比对结果,可初步鉴定菌株H1属于醋酸钙不动杆菌属.
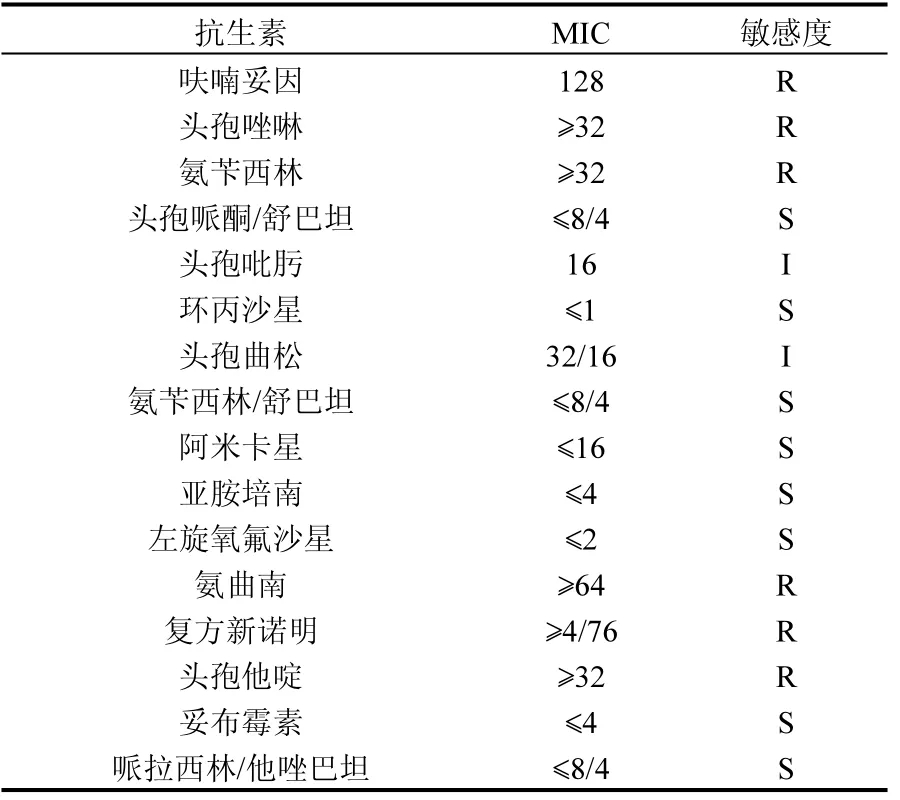
表2 H1的药敏结果Table 2 Results of tests of H1
2.4 降解产物分析
HPLC-MS测定对照和发酵14d后TX-A培养基中 TX-100及其中间产物的浓度,结果见图7~图 8.从图 7、图 8中 UPLC图谱可以看出,对照在 4.64min和 4.93min有明显的峰形出现,而TX-A只有在4.64min有;从对照的MS图中可以看出,在4.64min和4.93min的峰中, OPnEO分子离子主要分布为m/z427.2693+ 44nEO(nEO=5~13),它们对应[M+H]+,相邻离子之间间隔一个乙氧基(C2H4O),质量数相差44,而从TX-A的MS图中未检测到 OPnEO(n=5~13),说明在 TX-A 中OPnEO已降解,但分析结果未发现相应的中间降解产物,仍需要进一步检测分析.
采用超高效相液相色谱联合飞行时间串联质谱分析降解产物,并分析降解机理.UPLC-QTOF-MS检测发酵 7d后的 TX-A培养基有OPnEO(n=1~18)存在,14d后的 TX-A 中只有OPnEO(n=10~18)存在,说明环氧乙烷的聚合度越大,越难降解.在7d的TX-A中检测到OP4EC(图9),说明有末端氧化现象发生,推测降解先从羟基端 EO氧化开始.这与 Shibata等[31]的发现一致,在好氧条件下Ca2+可使Pseudomonas putidaS-5加速形成辛基酚聚氧乙烯醚乙酸(OPnEC),而不生成辛基酚聚氧乙烯醚(OPnEO).

图6 根据遗传距离建立H1的系统发育树Fig.6 Phylogenetic and molecular evolutionary analyses of H1

图7 对照培养基中的UPLC和MS图谱Fig.7 UPLC and MS profile of the contrast medium
在培养7d的TX-A培养基中检测到乙醛酸的存在,这可能由降解过程中乙醚链的断裂而产生的.结合TX-100降解产物的检测和分析结果,可以初步推测TX-100的降解先从EO末端逐步氧化,醚键断裂,释放出乙醚酸,最终形成新的化合物.
2.5 H1质粒提取
采用较温和的碱裂解法质粒小提试剂盒对H1进行质粒提取,得到较明显的多条质粒条带,如图10所示.

图8 培养14d后TX-A的UPLC和MS图谱Fig.8 UPLC and MS profile of TX-A after training 14 days

图9 OP4EC的MS图谱Fig.9 MS zoomed spectrum profile of OP4EC
从图10可以看出,在3~15kb之间有明显的4条带,这说明H1的质粒可能有2种或2种以上.这与大多数研究[17,22]不动杆菌的质粒及其耐药性研究的结果一致,大多数不动杆菌都含有质粒,且有些含有2个或2个以上.此外,研究还发现不动杆菌的耐药性与质粒有关,部分质粒消除后的不动杆菌会丧失对一些抗生素的抗性,且能够通过接合方式在细菌之间发生转移[23].这对不动杆菌质粒与降解能力的研究有一定的指导作用.
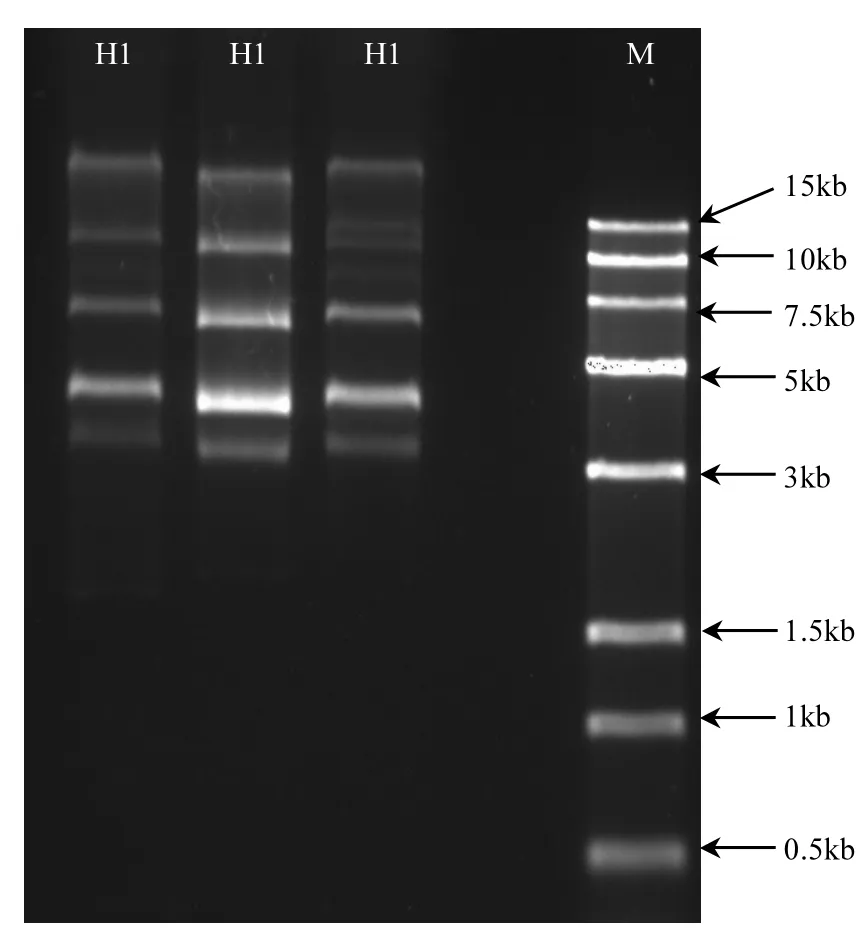
图10 质粒提取与检测Fig.10 Plasmid extraction and detection
2.6 质粒消除结果
通过影印得到质粒消除后的菌株,结果如图11所示.

图 11 LB(左)与 TX-A(右)影印对照Fig.11 Comparative result between LB flat (left) and TX-A flat (right)
H1经过质粒消除处理丢失了质粒,随机将质粒消除后的H1命名为H1T1、H1T2、H1T3、H1T4和 H1T5.H1T1、H1T2、H1T3、H1T4和H1T5质粒电泳检测结果见图12.
由图 12可见.H1T1、HIT2、H1T3、H1T4和H1T5已检测不到质粒.而H1的DNA条带与图10中H1的DNA条带大小一致.通过培养发现质粒消除后的衍生菌株与原始菌株相比,其耐受和降解TX-100能力明显降低,说明TX-100的降解可能和质粒有关.

图12 质粒消除后检测结果Fig.12 Detection of plasmid after annihilation
采用法国梅里埃公司 VITEK 2COMPACT全自动微生物鉴定药敏检测系统仪对 H1T5进行快速培养鉴定及药敏实验,从其药敏结果可以得出质粒消除前后,H1和H1T5对呋喃妥因、头孢唑啉、环丙沙星、环丙沙星、头孢曲松、亚胺培南和左旋氧氟沙星的药敏度未变,其中对呋喃妥因和头孢唑啉为耐药,其它为敏感;对氨苄西林、阿米卡星和复方新诺明的药敏度由耐药变为敏感,推测质粒上可能携带这些抗生素的抗性基因;对头孢匹肟、氨苄西林/舒巴坦和氨曲南的药敏度有变化,但不是很明显.
3 结论
3.1 从皮革厂污水曝气池中筛选到一株能够耐受较高浓度TX-100且降解性能较好的菌株H1,经 30℃、160r/min培养 14d后,H1对 1.0g/L TX-100的降解率可达 81.69%.对该细菌进行了形态学特征、生理生化反应鉴定和16S rDNA序列分析,初步鉴定 H1为醋酸钙不动杆菌属(Acinetobacter calcoaceticus).并发现 H1对三价铬、六价铬和一些抗生素具有一定的耐受性.
3.2 对降解菌H1降解TX-100的降解产物分析,得出降解过程中产生了 C2H2O3和 OP4EC,可以初步推断TX-100的降解先从EO末端氧化,醚键断裂,释放出乙醛酸,逐步缩短聚氧乙醚链,最终形成未知化合物.降解菌H1在只有TX-100为唯一碳源的环境下,降解 TX-100过程中不产生环境雌激素效应最强的辛基酚.
3.3 对降解菌 H1进行降解性质粒检测和质粒消除试验,表明H1对TX-100的降解与其质粒有关,说明该质粒为降解性质粒.另外,质粒消除后的衍生株对氨苄西林、阿米卡星和复方新诺明的药敏度由耐药变为敏感,推测质粒上可能携带这些抗生素的抗性基因.
[1]Raychoudhury S S, Blake C A, Millette C F. Toxic effects of octylphenol on cultured rat spermatogenic cells and Sertoli cells[J]. Toxicol. Appl. Pharmacol., 1999,157(3):192-202.
[2]Kim S K, Lee H J, Yang H, et al. Prepubertal exposure to 4-tert-octylphenol induces apoptosis of testicular germ cells in adult rat [J]. Arch. Androl., 2004,50(6):427-431.
[3]卞 倩.辛基酚的雄性生殖毒性及机制研究 [D]. 南京医科大学, 2005.
[4]李 高,陈 鹰,胡大裕等.几种表面活性剂的细胞毒性研究 [J].中国药师, 2006,9(4):294-296.
[5]洪燕燕,张育辉.辛基酚对中国林蛙蝌蚪生长发育的毒性效应[J]. 生态毒理学报, 2010,5(3):343-350.
[6]杨海君.土壤中非离子表面活性剂的微生物修复研究 [D]. 长沙:湖南农业大学, 2006.
[7]Sato H, Shibata A, Wang Y, et al. Characterization of biodegradation intermediates of nonionic surfactants by matrix-assisted laser desorption/ionization-mass spectrometry 1.Bacterial biodegradation of octylphenol polyethoxylate under aerobic conditions [J]. Polym. Degrad. Stab., 2001,74:69-75.
[8]Chen H J, Huang S L, Tseng D H. Aerobic biotransformation of octylphenol polyethoxylate surfactant in soil microcosms [J].Environ. Technol., 2004,25(2):201-210.
[9]臧瑞玲,胡晓芳,印春生,等.农田辛基酚聚氧乙烯醚降解菌的分离 [J]. 环境科学与技术, 2006,29(4):11-14.
[10]杨海君,杨成建,罗 琳.辛基酚聚氧乙烯醚降解菌的分离鉴定及其生长和降解特性 [J]. 环境化学, 2008,27(4):444-447.
[11]Hosoda A, Hotta Y, Jsoi T, et al. Diversity of octylphenol polyethoxylate-degrading bacteria in river sediments and enrichment cultures, was revealed by 16S rRNA and adh1-gene molecular analysis [J]. J. Pestic. Sci., 2010,35(4):470–478.
[12]Tasaki Y, Yoshikawa H, Tamura H. Isolation and characterization of an alcohol dehydrogenase gene from the octylphenol polyethoxylate degrader Pseudom onas putida S5 [J]. Biosci.Biotechnol. Biochem., 2006,70:1855-1863.
[13]Hotta Y, Hosoda A, Sano F, et al. Ecotoxicity by the biodegradation of alkylphenol polyethoxylates depends on the effect of trace elements [J]. J. Agric. Food Chem., 2010,58(2):1062-7.
[14]景宜品.乙醛含量测定方法的改进 [J]. 华南师范大学学报(自然科学版), 1994,(4):53-58.
[15]宋振华.高锰酸钾滴定法测定乙醛酸的含量 [J]. 广西化工,1999,28(4):50-51.
[16]张林达,刘红玉,鲁双庆,等.产表面活性剂菌株的筛选及其功能基因的初步定位 [J]. 农业环境科学学报, 2008,27(6):2265-2268.
[17]唐 银,阳大庆.鲍曼不动杆菌质粒指纹图谱分析及质粒与其耐药性关系的研究 [J]. 中国现代医学杂志, 2004,14(16):49-52.
[18]柳国霞,范丽平,霍贵成.乳酸乳球菌的质粒消除 [J]. 东北农业大学学报, 2009,40(7):101-105.
[19]何礼贤.非发酵革兰氏阴性杆菌医院感染、耐药趋势与抗菌治疗 [J]. 中国抗生素杂志, 2004,29(2):65-71.
[20]刘文静.在不动杆菌对碳青霉烯类耐药机制中外排泵及外膜蛋白表达作用的研究 [D]. 北京协和医学院研究生院, 2011.
[21]陈丽霞,陈 会,沈燕如.不动杆菌医院内感染的特点及耐药性分析 [A]. 中国医院协和第十八届全国医院感染管理学术年会论文资料汇编 [C]. 2011.
[22]李 蓉,徐小文,陈 娇,等.呼吸内科常见菌及鲍曼不动杆菌质粒上耐药基因的研究 [J]. 中国抗生素杂志, 2009,34(11):691-694.
[23]Ramírez M S,Merkier A K,Quiroga M P,C etal. Acinetobacter baumannii is able to gain and maintain a plasmid harbouring in35found in enterobacteriaceae isolates from argentina [J]. Curr.Microbiol, 2012,64:211–213.
