骨内应力环境下复合血管内皮生长因子骨髓基质干细胞修复创伤性股骨头坏死的实验研究
2014-05-18涛陶杰周孜辉周渊宋登新傅燕飞
黄 涛陶 杰周孜辉周 渊宋登新傅燕飞
(1 上海第一人民医院宝山分院骨科,上海 200940;2 上海第一人民医院骨科,上海 200080;3 上海第一人民医院宝山分院放射科,上海 200940)
骨内应力环境下复合血管内皮生长因子骨髓基质干细胞修复创伤性股骨头坏死的实验研究
黄 涛1陶 杰2周孜辉2周 渊1宋登新1傅燕飞3
(1 上海第一人民医院宝山分院骨科,上海 200940;2 上海第一人民医院骨科,上海 200080;3 上海第一人民医院宝山分院放射科,上海 200940)
目的探讨骨内应力对转染VEGF基因的骨髓间充质干细胞修复创伤性股骨头坏死的作用。方法设计制作能骨内加压的空心螺钉,骨髓间充质干细胞培养并转染VEGF基因,20只实验犬通过手术截断股骨颈方法造模,根据术后不同的处理方法分为四组:A组(单纯空心螺钉固定);B组(空心螺钉加人工骨填塞);C组(空心螺钉加复合转染VEGF的骨髓间充质干细胞的人工骨填塞);D组(空心螺钉加复合转染VEGF的骨髓间充质干细胞的人工骨填塞,同时加压)。造模20周后,行大体观察、X线及组织学、免疫组化及Western blot检测骨修复效果。结果通过手术方式成功制作出创伤性股骨头坏死的动物模型;在造模20周后,D组血管计数和VEGF的蛋白含量明显高于其他三组(P<0.05);C组血管计数和VEGF的蛋白含量高于A组和B组,有显著性差异(P<0.05),低于D组比较有显著性差别(P<0.05);A组和B组血管计数和VEGF蛋白水平远低于C组和D组,差异有统计学意义(P<0.05)。A组和B组血管计数和VEGF蛋白水平之间的差异无统计学意义(P>0.05)。结论骨内加压能显著提高转染VEGF的骨髓间充质干细胞对创伤性股骨头坏死的再血管化,适当的应力刺激有利于骨组织的修复。
股骨头坏死;应力;间充质干细胞;血管内皮生长因子;修复
股骨头缺血性坏死塌陷和骨折不愈合是股骨颈骨折术后两大并发症。近年来,随着内固定技术的改进,骨折不愈合率已明显降低,但股骨头缺血性坏死塌陷的发生并没有根本改观,这也成为一直困扰创伤骨科界的一大难题。
目前对于股骨头坏死的早期保髋处理,有髓芯减压术、转子间截骨术,带血管蒂肌蒂骨瓣移植术、多孔钽棒植入术等多种方法使用,针对的均是已发生股骨头坏死的病例。而对于股骨颈骨折而言,如何能在早期牢固固定骨折,促进骨组织修复;快速重建股骨头血供,促进新生骨血管化和加强股骨头软骨下支撑等方面取得一个相对好的平衡,从而在治疗骨折的同时减少甚至达到避免股骨头坏死的发生仍是一个有待解决的课题。
Wolff定律指出适当的力学刺激造成骨生长质和量的改变。有研究也发现纵向压力诱导成骨细胞和成纤维细胞分化成骨[1],我们思考:能否通过某种设计使在骨折内固定的同时能即时在骨内施加一定的应力,从而促使局部骨的快速修复?结合临床实际,我们设计了能骨内局部加压的空心螺钉,结合转染了血管内皮生长因子(VEGF)基因的骨髓基质干细胞(MSCs)的应用,以期为创伤性股骨头坏死的防治提供新的思路。
1 材料与方法
1.1 骨内应力传导装置的设计
根据中青年人股骨颈骨折保头手术常用三枚空心加压螺钉固定的手术方法,采用两部分设计能够骨内加压的应力传导装置。为保证螺钉强度和加压的同步,我们对普通空心加压螺钉进行了改制(图1)。螺钉基本参数:钉长35 mm,外径6.5 mm,内径3.5 mm,壁厚0.8 mm,螺纹0.7 mm,牙距0.8 mm,牙数:头端6。钉尾头型:十字内凹平头,外径10 mm,内径8 mm。加压装置:圆柱螺旋压缩弹簧。自由行程8 mm,通过弹簧回弹力测试仪测试在压缩行程5 mm时(平均三次),可提供(8.1±0.053)N的回弹力。当螺钉中孔填满固态物质后,即可通过弹簧的压缩对钉头加压。装置订做厂家:苏州康力骨科器械有限公司。

图1
1.2 实验动物的选择和分组
选取健康杂种犬20只,雌雄不限,体质量(16.9±2.1)kg,犬龄3~5年,上海交通大学实验动物中心提供。实验动物共40只股骨头,全部纳入实验。将实验动物股骨头随机分为A、B、C、D4组,每组各十只股骨头。动物造模后,A组动物为造模后定制空心螺钉内固定组,B组动物为造模后,定制空心螺钉结合人工骨修复组,C组为造模后,空心螺钉结合VEGF-165基因转染的MSCs修复组,D组造模后,骨内加压、空心螺钉结合VEGF-165基因转染的MSCs修复组。
1.3 主要仪器和试剂
光学倒置显微镜日本Olympus公司;FACS Calibur流式细胞仪美国Becton-Dickinson公司;DMEM细胞培养液、胎牛血清美国GIBCO 公司;pCI –neo-hVEGF-165质粒由本中心实验室保存;LipofectamineTM 2000转染试剂盒美国Life Technologies Corporation公司;蛋白抽提试剂盒、SABC三步法试剂盒 武汉博士德生物工程有限公司;兔抗人VEGF多克隆抗体、羊抗兔IgG抗体 美国Abcam公司;专业图像分析软件Image-Pro Plus 6.0美国Media Cybernetics公司
1.4 骨髓间充质干细胞培养及目的基因转染
实验犬行髂嵴穿刺,抽取骨髓约3 mL,密度梯度离心法分离培养骨髓间充质干细胞(MSCs)至第3代,培养液为含20%胎牛血清DMEM液,流式细胞仪检测CD29、CD31、CD34、CD105的表达。脂质体法转染pCI–neo-hVEGF-165基因进入MSCs,设置阳性对照组(pCI-neo空质粒组)与阴性对照组(DMEM培养液组)。转染试剂为阳离子脂质体LipofectAMINETM2000,具体方法按说明书进行。G418筛选。ELISA法检测转染后细胞上清液中VEGF浓度。将阳性克隆分散在96孔板中,依据上清液中VEGF浓度进一步筛选、扩增高表达克隆。消化细胞并将细胞配制成1×108/mL细胞悬液,复合于多孔人工骨上,在培养箱中孵育4 h备用。
1.5 动物模型的建立
参与实验的动物,采用Swiontkowski等的方法[2],模拟临床股骨颈骨折的过程,制作创伤性股骨头坏死的实验动物模型。犬俯卧位固定,40mg/kg硫贲妥钠腹腔注射麻醉。采用髋关节外侧入路,切开阔筋膜张肌,显露臀中肌和臀深部肌群,从间隙进入,切开关节囊,在股骨头半脱位的情况下,用摆锯造成股骨颈完全骨折。再重新解剖对位后,股骨头使用定制空心螺钉沿大粗隆下股外侧皮质向股骨头中心点行内固定,外侧皮质扩孔到10 mm,用套筒扳手将定制螺钉拧入,尽量使螺钉尾端深入外侧皮质内,以增加稳定性。A组造模后定制空心螺钉内固定,B组造模后,空心螺钉内固定,螺钉孔内克氏针填入人工骨并夯实,C组股骨头使用定制空心螺钉固定完成后,在螺钉钉孔内用克氏针填入复合有VEGF-165基因转染的MSCs的人工骨并夯实。D组股骨头使用定制空心螺钉固定,在螺钉钉孔内用克氏针填入复合有VEGF-165基因转染的MSCs的人工骨,夯实后在螺钉头端使用弹簧进行加压。术毕缝合伤口。所有实验动物术后24 h内限制活动。常规肌注青霉素G80万单位以预防感染。
1.6 标本制作和观察
①实验动物统一在20周后取材检测。取材前统一在电压55 kV、电流10 mAs、距离1 m 的条件下拍摄双侧股骨头正位片。②标本采集:取出股骨头,纵向锯开,一部分装入冻存管,深低温冰箱冻存;另一部分10%甲醛固定,5%乙二胺四乙酸(EDTA)脱钙液对样本进行充分脱钙。③切片组织学检测:将5%EDTA脱钙后的标本取出,逐级脱水,二甲苯透明,石蜡包埋,切片,厚度为4 µm,苏木精一伊红(HE)染色,光镜观察。④切片免疫组化血管染色检测并血管计数:切片厚度4 µm,按SABC三步法试剂盒说明书进行染色。一抗兔抗人CD34多克隆杭体1∶150,二抗生物素化羊抗兔IgG。阳性染色表现为棕黄色,定位于血管内皮细胞胞质。应用专业图像分析软件Image-Pro Plus 6.0进行血管计数,每片随机选取三个视野计数,取平均值。⑤Western blot检测骨组织中VEGF蛋白表达:4组冻存的股骨头标本,分别碾磨粉碎后,加入总蛋白提取液,用组织匀浆器匀浆至无明显肉眼可见固体。将匀浆物在4 ℃,10000 rpm条件下离心5 min,取上清与1×SDS凝胶上样缓冲液混合,并加入不超过4%体积的β一巯基乙醇(β-mercaptoethenal)一起煮沸5 min。上样经10% SDS-PAGE凝胶电泳后,转移至硝酸纤维素膜上,标记方向后1%脱脂奶粉室温封闭过夜。洗膜后加入兔抗人VEGF多克隆抗体(体积比1∶500)37 ℃下杂交2 h,随后洗膜3次,加入辣根过氧化物酶标记的羊抗兔IgG抗体(体积比1∶2000)室温杂交1 h,最后经显色反应并曝光于X线胶片上。选择GAPDH作为内参。应用Image-Pro Plus 6.0对图像的光密度比照内参条带光密度进行分析。
1.7 统计学方法
本研究实验数据采用SPSS18.0统计软件进行统计学处理,数据用()表示,差异的显著性用组间t检验,多组间比较用单因素方差分析,定义P<0.05为有统计学意义。
2 结 果
2.1 术后动物及股骨头肉眼观察
全部实验动物均术后存活,无明显伤口感染。术后实验动物精神稍差,活动减少,进食量减少,双侧后肢轻度跛行。1~2周后进食增加,步态转好,活动增加。2周后大部分伤口缝线自行脱落,伤口愈合。20周取材时,全部20只实验犬均能正常行走。
20周时,A组10只标本骨折处不同程度愈合,未见骨不连。股骨头外形基本规整,部分股骨头失去球形外形,呈扁平,有5只股骨头可见软节软骨部分剥脱,残留软骨呈苍白色。B组标本骨折基本愈合,10只股骨头外形基本规整呈圆形,有6只股骨头可见软节软骨不同程度剥脱,残留软骨呈苍白色,其中一只股骨头似可见轻度塌陷征象。C组标本骨折愈合,10只股骨头外形基本规整呈圆形,颜色稍苍白,未见明显软骨剥脱或表面粗糙。D组标本骨折愈合,10只股骨头外形基本规整呈圆形,颜色正常,未见明显软骨剥脱或表面粗糙。
2.2 X线片观察
A组10只标本骨折线模糊,内固定物未见松动,有2只股骨头内可见点片状密度增高影,5只股骨头软骨下可见不同程度小囊样变,骨质结构紊乱。B组10只标本骨折线模糊,头颈外形正常,内固定物未见松动,有5只股骨头软骨下可见囊状透光区,骨小梁结构紊乱。C组10只标本骨折线模糊,头颈外形正常,内固定物未见松动,软骨下未见囊样变,1只股骨头可在软骨下发现斑点状疏松。D组10只标本骨折线模糊,头颈外形正常,内固定物未见松动,软骨下未见囊样变或骨小梁结构紊乱。见表1。
说明定制的空心螺钉能牢固固定骨折端,满足稳定骨折端的技术要求,同时也发现术后不限制实验犬的活动,并不影响骨的愈合。

表1 各组股骨头缺血性坏死例数(经影像学检查)

图2 造模术后20周X线片(左髋D组、右髋A组)
2.3 HE染色结果
A组标本骨小梁可见部分中断,髓腔内充满肥大的脂肪细胞,骨细胞核消失,空骨陷窝明显增多(图3)。B组标本骨小梁萎缩、稀疏,骨髓内脂肪细胞大小不均匀。可见骨细胞核固缩、边聚,有较多空的骨陷窝(图4)。C组标本骨小梁排列较不规则,骨细胞大部分正常,有较多脂肪细胞,空骨陷窝可见(图5)。D组标本骨小梁排列规则、整齐,骨细胞清晰,骨髓内脂肪细胞分布均匀,空骨陷窝偶见(图6)。
从大体标本、X线表现和病理切片我们可以得出结论:通过股骨颈截骨再固定的方法,造成了了创伤性的股骨头缺血性坏死,说明①本实验创伤性股骨头缺血坏死造模成功;②空心螺钉固定能为骨质愈合创造良好条件,但并不能减少股骨头坏死的发病率;③X线平片对于股骨头缺血性坏死的诊断敏感性较低、有漏诊可能。见表2。
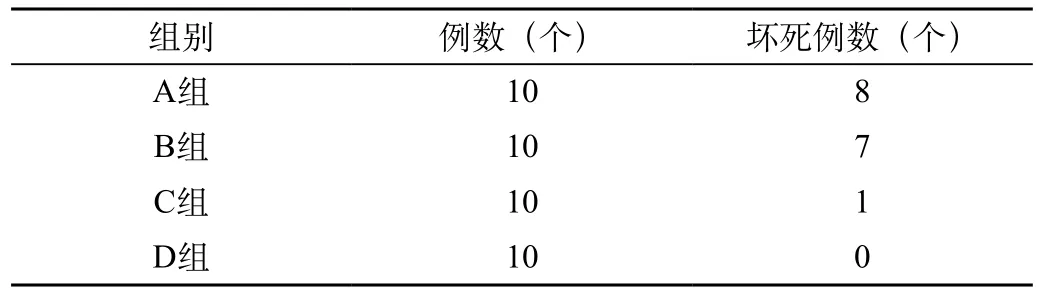
表2 各组股骨头缺血性坏死例数(经病理学检查)
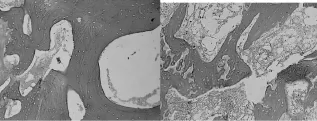
图3 A组标本病理学检查(×200) 图4 B组标本病理学检查(×200)
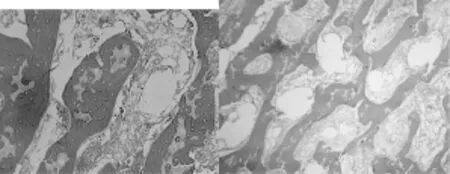
图5 C组标本病理学检查(×200) 图6 D组标本病理学检查(×200)
免疫组化染色
A、B组标本骨小梁表面的少数细胞出现VEGF阳性表达,染色较淡且稀疏(图7、8);C、D组可见骨小梁表面着色较深,且阳性表达细胞数量多,髓内出现大量阳性褐色颗粒(图9、10)。
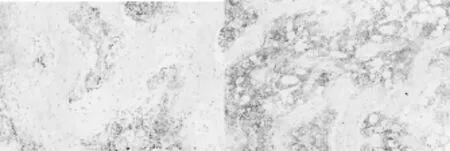
图7 A组标本免疫组化染色(×200) 图8 B组标本免疫组化染色(×200)
图9 C组标本免疫组化染色(×200) 图10 D组标本免疫组化染色(×200)
2.4 血管计数
通过Image-Pro Plus 6.0软件对免疫组化切片进行光密度测量,从而得出各组标本血管计数(表3)。A组血管计数水平最少,B组血管计数较A组多,但无统计学意义(P>0.05)。D组、C组血管计数较A组、B组明显增加,且有极显著差异(P<0.01),说明转染VEGF的骨髓基质干细胞确实起到了再生血管,加速骨修复的作用。D组和C组之间的统计学比较,有显著差异(P<0.05),证明骨内的微应力直接作用,能够进一步促进骨髓基质干细胞的成血管功能。
表3 各组血管计数结果()

表3 各组血管计数结果()
组别 例数(个) 血管计数(个)A组 10 9.12±1.41 B组 10 11.78±2.55 C组 10 26.22±2.13 D组 10 35.81±2.45
2.5 Western Blot检测各组VEGF蛋白表达
用Western Blot蛋白印迹法分析各组VEGF蛋白表达的影响。结果显示:四组股骨头组织中均检测出有VEGF蛋白的表达,其中D组表达量最高,较C组有显著性差别(P<0.05),较A、B组有极显著性差别(P<0.01)。A组表达量少,和B组无统计学差别。C组和A、B组有显著性差别(P<0.05)。说明转染VEGF的骨髓基质干细胞相较与单纯内固定而言促进血管的再生和修复,而适当的骨内应力能加速这种修复作用。见表4。

表4 各组股骨头VEGF蛋白表达
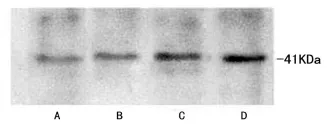
图11 Western blot检测各组VEGF蛋白表达
3 讨 论
和非创伤性股骨头缺血性坏死发病机制复杂,学说较多不同,创伤性股骨头缺血性坏死的发病机制相对清楚。比较一致的观念认为:股骨颈骨折后造成股骨头血供的中断,血液循环障碍是导致股骨头缺血坏死的根本原因。而在修复过程中,破骨细胞介导的骨质吸收往往超过新骨形成的速度,造成骨密度降低,削弱了股骨头的承重能力,从而在应力作用下发生塌陷。即创伤性股骨头坏死是生物学因素与生物力学因素共同作用的结果。其病理生理学基础在于:①新生血管形成障碍,局部血液供应不足;②骨组织损伤坏死或/和新生骨形成能力低下。
生物力学在创伤性股骨头坏死方面的研究越来越深入。Wolf定律提示我们,任何骨组织的修复与重建都是和其所承受的载荷密切关联的。Mannl等[3]发现机械应力刺激可以促进新骨的生成活力。另外纵向载荷产生的压应力对坏死股骨头的修复极为重要,它可以驱动软骨基质矿化和MSCs向成软骨细胞和成骨细胞方向分化,刺激成骨细胞的功能活性,提高骨密度,有助于骨的改建[4,5]。国内作者发现,股骨头塌陷与松质骨及软骨下骨生物力学特性关系密切,软骨下骨的生物力学强度在股骨头塌陷时下降较松质骨显著,是股骨头塌陷的关键因素[6]。因此我们设想,除了体外通过改变自体负重来达到影响股骨头修复的目的外,可否直接从体内构建一个能进行骨内应力传导的腔室,这样可以在治疗骨折的同时即对可能发生的股骨头坏死进行干预?通过对临床常用的空心加压螺钉进行适当的改进,结合弹簧的加压,我们构建了一个简单但加压持续可靠的骨内加压装置。从实验的结果看,骨内加压装置起到了3个方面的效用:①牢固固定骨折断端,为良好的骨愈合创造了条件;②可以力点准确的对软骨下骨进行适当加压,为软骨下骨提供了进一步的支撑;③给腔内填塞的MSCs施以一定的纵向压力,促进了成骨和成血管过程,有利于骨折后股骨头的再生和修复。
中青年股骨颈骨折患者多由高能量创伤引起,且常伴有多发性损伤,相较老年患者而言,股骨头坏死及骨不连的发生率较高。股骨颈骨折往往造成股骨头血管血供的中断,尤其是在有移位的情况下,这是造成创伤性股骨头坏死的根本原因 。股骨颈骨折后,骨折近端血供破坏.需依靠骨折远端的新生血管通过爬行进入股骨头,使之复活并新生骨,这一修复速度大概需7~8个月才能完成。组织学观察表明,股骨颈骨折后,有85%发生股骨头缺血坏死,然后经过再血管化、恢复血供、股骨头复活[7]。显然,由于股骨颈骨折后股骨头组织局部普遍存在血供不足和微循环障碍等问题,因此促进血管再生的治疗策略应有助于骨损伤修复。
本实验选择了能直接作用于血管内皮细胞促进血管内皮细胞增殖,增加血管通透性的血管内皮生长因子作为细胞因子,将VEGF基因通过分子生物学方法转染入MSCs中,使其能够稳定长期的表达,为股骨头内血管的再生和修复提供良好的保证。由于MSCs强大的分化潜能和增殖能力,使转染了VEGF基因的MSCs具有了更好的修复能力,本实验结果也表明:填入复合VEGF基因的骨髓间充质干细胞的股骨头在造模20周后VEGF的含量和血管的计数均高于单纯螺钉内固定组,说明转染后的间充质干细胞能够稳定的表达VEGF,促进了血管的新生,从而很好的避免了股骨头的坏死塌陷。
本次实验初步证实了通过骨内纵向加压促进了头内血管的再生和骨坏死的修复,获得了满意的效果。但是不足之处在于:没有测定钉头加压后对股骨头内压有何影响?是否会加重骨内高压反而造成股骨头缺血性坏死的出现或加重?骨内高压是由于骨内静脉回流受阻,静脉淤滞,组织水肿而造成内压的增高,组织的坏死。从理论上分析,螺钉钉道内的纵向加压,压力方向为钉尾至钉头,局限于钉孔内,不影响头内的血运,因而不会加重骨内压的发生。当然,这还需要进一步的实验验证。
[1] Jepsen KJ,Navy DT,Kraypow DT.The role of the lamellar interface during torsional yielding of human cortical bone[J].J Biomech,1999,32(3):303-310
[2] Swiontkowski MF,Tepic S,Rahn BA,et al.The effect offracture on femoral head blood fl ow.Osteonecrosis and revaseularization studied in miniature swine[J].Acta Orthop Scaad,1993,64(2):196-202.
[3] Mannl V,Huberl C,Kogiannil G,et a1.The inf l uenee of mechanical stimulation on osteoeyte apoptosis and bone viebility in human trabecular bone[J].J Musculoskelet Neuronal Interact,2006,6(4):4 08-417.
[4] Athanasiou KA,Zhu C,Lanetot DR,et a1.Fundmentnls of biomachanies in tissue engineering of bone[J].Tissue Eng,2000,6(4):36l-381.
[5] 唐兆鹏,赵德伟.不同应力刺激下犬坏死股骨头自然修复过程的研究[J].中国骨与关节外科,2011,4(1):45-50.
[6] 徐小良,王坤正,戴克戎,等.实验性股骨头骨缺损修复过程的生物力学研究[J].骨与关节损伤杂志,2002,17(3):196-198.
[7] Ahn J,Man LX,Park S,et a1.Systematic review of cemented and uncementedhemiarthroplasty outcomes for femoral neck fractures[J].Clin Oahop Relat Res,2008,466(10):2513-2518.
Vascular Endothelial Growth Factor Gene-modified Mesenchymal Stemcells for the Treatment of Traumatic Osteonecrosis of the Femoral Head in Internal Stress Environment of Bone
HUANG Tao1, TAO Jie2, ZHOU Zi-hui2, ZHOU Yuan1, SONG Deng-xin1, FU Yan-fei3
(1 Department of Orthopedic, Baoshan Branch of Shanghai First People's Hospital, Shanghai 200940, China; 2 Department of Orthopedic, Shanghai First People's Hospital, Shanghai 200080, China; 3 Department of Radiology, Baoshan Branch of Shanghai First People's Hospital, Shanghai 200940, China)
ObjectiveTo explore the effects of internal stress of bone on vascular endothelial growth factor gene-modified mesenchymal stem cells in repairing traumatic avascular necrosis of the femoral head in canine models.MethodsDesign and makethe hollow screws that can be intraosseous pressure,mesenchymal stem cell culture andVEGF-gene transfected.Animal model was set up by the femoral neck osteotomy.20 dogs were divided into 4 groups: Group A is the femoral neck fixating by hollow screw only; Group B is the femoral neck fixating by hollow screwand artificial bone; Group C is the femoral neck fixating by hollow screwand artificial bone composited VEGF transfected mesenchymal stem cells; Group D is the femoral neck fixating by hollow screwand artificial bone composited VEGF transfected mesenchymal stem cells,meanwhile, compressedscrew.After 20 weeks, repair effect of bone and blood vessel was determined by methods including Immunohistochemical technique, image analysis and Western blotting.ResultThe animal model of traumatic avascular necrosis of the femoral head was successfully produced through the operation.As shown in immunohistochemical techniqueand western blotting, Vessel count and VEGF-protein content, the Group D were significantly higher than the other three groups(P<0.05), the Group C were higher than the Group Aand the Group B(P<0.05)but lower than the Group A.There was no significant difference between the group A and the group B(P>0.05).ConclusionIntraosseous pressure can significantly improve revascularization with the VEGF transfected mesenchymal stem cells on traumatic avascular necrosis of the femoral head.Appropriate stress stimulation to necrotic femoral head can speed up the repair of the bone.
Femoral head necrosis; Stress; Mesenchymal stem cells; Vascular endothelial growth factor; Repair
R68
B
1671-8194(2014)22-0078-04
上海市卫生局科技发展基金项目(编号:2009229)
