二甘肽 木糖美拉德反应交联特性研究
2014-05-17邢亚阁张晓鸣
刘 平,邢亚阁,张晓鸣,黄 湛
(1.西华大学生物工程学院,四川成都610039;2.食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡214122)
目前,国内外对MRPs中非挥发性化合物的研究,主要是针对氨基酸-还原糖模式体系,研究集中于初级阶段的产物或高级阶段产物中低分子量的有色组分的分离[1]。而对肽-还原糖体系中MRPs的研究较少,主要研究的是单纯二肽或三肽模型体系的反应活性、挥发性化合物和抗氧化性[2-3],而对肽与氨基酸体系中所形成的非挥发性化合物的研究较少。一方面是由于美拉德反应的复杂性,另一方面由于大部分非挥发性MRPs的极性极强,且很多结构中没有发色团,很难通过传统的液相色谱-紫外联用手段来检测。虽然采用紫外检测器检测MRPs有一定的缺陷,但受目前条件和技术所限,国际上对MRPs中非挥发性成分的研究仍采用此法,许多报道[4-5]仍采用配备紫外检测器或(和)荧光检测器的液相色谱进行分离检测,同时结合LC-MS/MS进行分析。
Ogasawara等[6]通过二次超滤法利用 1000~5000u大豆肽制备的1000~5000u美拉德反应产物(即美拉德肽)具有良好的风味增强效果。但二次超滤成本较高,不适合工业化生产。
本研究以二甘肽-木糖美拉德模式反应体系,通过凝胶色谱及高效液相色谱分离其MRPs,并结合LC-MS及LC-MS/MS技术进行分析,并通过同位素示踪法验证糖肽交联产物的形成,以期为肽-糖美拉德反应产物(尤其是美拉德肽)的有效制备提供依据。
1 材料与方法
1.1 材料与仪器
二甘肽(diglycine,分子量132.12)上海亿欣生物科技有限公司;D-木糖 中国惠兴生化试剂有限公司;[13C5]-木糖 Omicron Biochemicals Inc,美国;葡聚糖凝胶G-10 国药集团化学试剂有限公司;其他化学试剂均为分析级。
玻璃层析柱(1.6×100cm) 上海厦美生化科技发展有限公司;SunfireTM C18柱(5μm,4.6×150mm) 美国 Waters公司;Ultimate® AQ-C18色谱柱(5μm,4.6×250mm)月旭材料科技(上海)有限公司;XBridge HILIC Hillic色谱柱(5μm,4.6×250mm)美国Waters公司;Atlantis T3柱(5μm,10×150mm)美国Waters公司。
HD-3紫外检测仪 上海青浦沪西分析仪器厂;恒流泵 上海青浦沪西仪器厂;XWT-S小型台式记录仪 上海仪表仪器厂;DBS-100电脑全自动部分收集器 青浦沪西分析仪器厂;TG16-WS台式高速离心机 湘仪离心机仪器有限公司;F-7000荧光分光光度计日立公司;液相色谱串联四极杆飞行时间质谱仪(MALDI SYNAPT Q-TOF MS)美国Waters公司。
1.2 实验方法
1.2.1 美拉德反应 将1.0g二甘肽与0.3g木糖溶于9mL去离子水中,混合均匀,用6N NaOH调节pH至7.4,定容至10mL,使混合溶液的最终浓度达到11.5%。每次取1mL混合液于反应瓶中,密封,在120℃下反应30、60、90和120min,反应结束后迅速采用冰水冷却,反应液于4℃下存放用于分析测定。
1.2.2 荧光强度的测定 根据Morales等[7]的方法稍作修改,将美拉德反应液稀释50倍,取200μL样品加入2.3mL pH8.5 0.2moL/L硼酸盐缓冲液,混匀,在347nm激发波长下进行发射波长扫描,同时以去离子水作空白。
1.2.3 分子量分布的测定 参考Liu等[8]方法。
1.2.4 MRPs的分离纯化方法
1.2.4.1 葡聚糖凝胶柱色谱分离 将二甘肽-木糖MRPs混合液在10000r/min离心10min,取出上清液,并配制成 50mg/mL的溶液,取 2mL样品上Sephadex G-10色谱柱分离,洗脱液为过0.45μm微孔滤膜的去离子水,以30mL/h的流速洗脱,用紫外检测仪在220nm下检测,收集峰Ⅰ,减压浓缩后冷冻干燥。
1.2.4.2 HPLC色谱柱的选择及分离 将Sephadex G-10收集到的峰Ⅰ组分,选用不同类型的色谱柱进行分离,分离条件如下:
Sunfire色谱柱:进样体积5μL;流速1mL/min;柱温35℃;检测波长,220nm;梯度洗脱条件:0~10min,5~30%B;10~25min,30%~85%B;25~35min,85%~100%B;35~40min,100%B(其中 A:含0.1%TFA的水溶液,B:含0.1%TFA的乙腈溶液)。
Hillic色谱柱:进样体积5μL;流速1mL/min;柱温35℃;检测波长220nm;梯度洗脱条件:0~10min,100~30%B;10~25min,30%~0%B(其中 A:50/50乙腈/10mmoL/L醋酸铵,pH9;B:95/5乙腈/10mmoL/L 醋酸铵,pH9)。
Ultimate® AQ-C18色谱柱:进样体积5μL;流速1mL/min;柱温35℃;检测波长220nm;梯度洗脱条件:0~20min,10~80%B(其中 A:含 0.1%TFA 的水溶液;B:含0.1%TFA的乙腈溶液)。
Atlantis色谱柱:进样体积5μL;流速1mL/min;柱温 35℃;检测波长 220nm;梯度洗脱条件:0~12min,2~16%B;12~20min,16~70%B;20~35min,70~100%B(其中 A:含0.1%TFA 的水溶液;B:含0.1%TFA的乙腈溶液)。
1.2.5 LC-MS及 LC-MS/MS分析 仪器名称:Waters Synapt MALDI Q-TOF MS(USA)。
液相色谱条件:仪器 Waters ACQUITY UPLC;BEH C-18色谱柱(1.7μm,2.1mm ×100mm);紫外检测器:检测波长范围200~400nm。进样体积:2μL,流速0.3mL/min。流动相:A:5%乙腈(含0.1%TFA),B:60%乙腈(含0.1%TFA)。梯度洗脱条件:0~5min,20%~30%B;5~10min,30% ~50%B;10~15min,50%~100%B。
质谱条件:离子源:ESI;离子模式:正离子;毛细管电压:3.5kV;锥孔电压:30V;离子源温度:100℃;脱溶剂气温度:400℃;锥孔反吹气流量:50L/Hr;脱溶剂气流量:500L/Hr;质量扫描范围:50~1000m/z;碰撞电压:6.0~20eV,数据采用MassLynxs 4.0软件分析。
2 结果与讨论
2.1 荧光强度的变化
美拉德反应过程中荧光性物质的形成符合零级动力学反应。MRPs具有典型的荧光波谱特征,激发波长为 340~370nm 和发射波长为 420~440nm[9-10]。通过荧光强度的变化,可分析MRPs中新物质的生成情况。二甘肽-木糖体系在不同反应时间下的MRPs在激发波长347nm下的荧光强度如图1所示。

图1 二甘肽-木糖MRPs的荧光强度随反应时间的变化Fig.1 Changes in fluorescence intensity of MRPs from diglycine-xylose systems as a function of time
由图1可知,美拉德反应开始前,体系中只有糖和肽时,肽在发射波长347nm处时有最大荧光强度。随着加热时间的延长,产物中肽的最大荧光强度值逐渐减小,同时有一新的峰生成,其在430nm处有最大荧光强度。随着反应时间的延长,产物荧光强度逐渐增强,这个现象与Morales等[7]的研究结果类似。通常荧光强度是衡量蛋白质糖苷化产物和荧光性反应产物生成量的指示剂。本研究的结果发现,肽糖的交联物也有此荧光性特征。由此说明,在美拉德反应中,肽的结构发生了变化,产物中有新的物质生成,这些新的物质包括糖肽的交联产物等。Baisier等[11]猜测荧光性化合物的积累来源于氨基化合物的Strecker降解或中间产物中活性还原性化合物的进一步反应形成的。荧光性物质和有色化合物的关系目前还不完全清楚,荧光性化合物通常被认为是有色物质形成的前体物。
2.2 分子量分布分析
为了进一步评价小肽与木糖在美拉德反应中的交联作用,采用凝胶液相色谱对二甘肽-木糖各体系在120℃下反应120min的产物的分子量分布进行了分析,结果如图2所示。
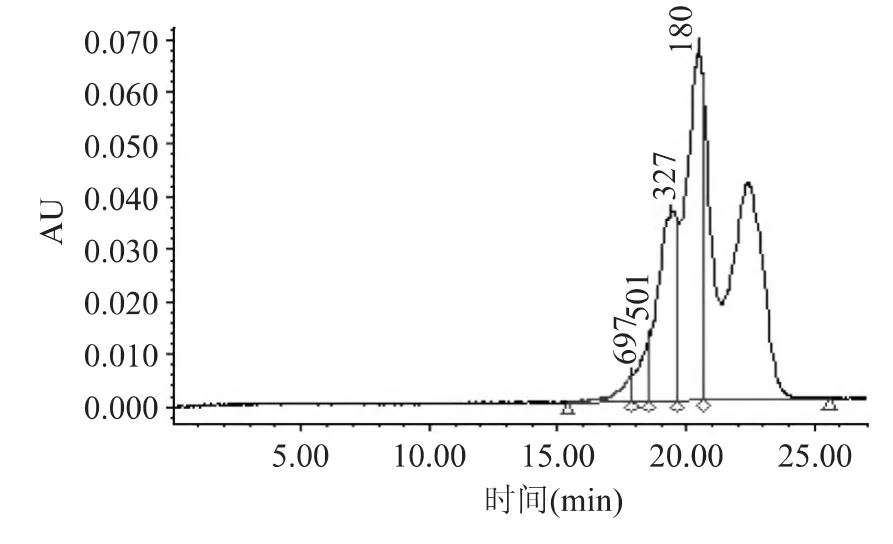
图2 二甘肽-木糖MRPs的分子量分布图Fig.2 Distribution of molecular weight of MRPs derived from diglycine-xylose system
由图2可知,在二甘肽-木糖体系中,相对分子质量700~5000的产物相对百分含量占1.86%,500~700产物占3.16%,180~500产物之间的占46.27%。由此可知,小肽与还原糖在高温下反应可形成较高分子量的 MRPs。Kim 等[12]研究发现,在100℃ 下加热甘氨酸/二甘肽/三甘肽-葡萄糖体系,各体系中大分子物质的比例随着加热时间的延长也显著增加。Clark等[13]研究发现蛋白质骨架与糖通过聚合形成含高分子量的化合物。
2.3 二甘肽-木糖体系MRPs的分离分析
2.3.1 葡聚糖凝胶柱色谱的分离 葡聚糖凝胶是根据分子量差异进行分离的一种技术,是蛋白质和肽等化合物分离中常用的分离手段,近年来的研究将其用于MRPs中不同分子量组分的分离[14]。由于二甘肽—木糖MRPs中分子量几乎都是相对分子质量小于700的组分,因此选用葡聚糖凝胶G-10对此体系120min的产物进行初步分离,结果如图3所示。从图3可知,经葡聚糖凝胶G-10分离后,可得到三个组分,组分Ⅰ和组分Ⅱ是有色物质,组分Ⅲ是无色物质。其中,组分Ⅰ中分子量分布较大的产物的比例相对较高,因此收集该组分并进行进一步的分离。
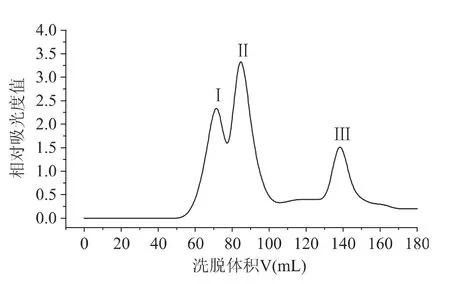
图3 凝胶过滤色谱G-10分离二甘肽-木糖MRPs在220nm下的图谱Fig.3 UV-vis spectrum at 220nm of MRPs derived from diglycine-xylose system purified by Sephadex G-10
2.3.2 液相色谱柱的筛选 根据MRPs具有较强的极性特性,选用 Sunfire、Hillic、Ultimate和 Atlantis T3色谱柱对葡聚糖凝胶G-10中收集到的组分Ⅰ进行分离,经分离条件初步优化后,在各柱较好的分离条件下的分离结果如图4所示。
由图4可知,经Sunfire、Hillic和Ultimate色谱柱分离后,出现的峰较少,分离效果较差,表明该三种色谱柱不适合二肽-木糖高温MRPs的分离。相比之下,采用Atlantis T3色谱柱分离后,分离效果较好,色谱图中出现的峰较多,表明该柱子较适合该类产物的分离。因此,选用 Atlantis T3色谱柱对二甘肽-木糖的MRPs进行分离。
2.3.3 Atlantis T3色谱柱对二甘肽-木糖MRPs的分离 对葡聚糖凝胶G-10中分离得到的组分Ⅰ采用Atlantis T3色谱柱进行分离,经分离条件优化后,得到的最佳条件下的分离结果如图5所示。
如图5所示,图谱中出现六个峰,各峰经液质检测发现,各峰中仍含有多种化合物,峰Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅵ中检测到的主要是质荷比较小的物质,而峰Ⅴ中的既有质荷比较小的物质也有较大的物质,因此集中收集峰Ⅴ,并采用液相色谱对其进一步分离。
2.3.4 二次液相色谱的分离 对第一次液相色谱分离收集到的峰Ⅴ组分,仍采用液相色谱进行二次分离,经液相色谱柱的进一步筛选后,发现Atlantis T3色谱柱分离效果较好,因此仍采用此柱继续分离,结果如图6所示。
由图6发现,经第二次液相色谱分离,图谱中出现8个峰,表明待分离组分在Atlantis T3色谱柱上被较好的分离,将收集到的8个组分进一步采用LC-MS技术进行分析。
2.3.5 LC-MS分析 通过选择合适的电喷雾电压、碰撞能量等质谱分析条件,并在正、负离子两种扫描方式下分别对二次HPLC技术分离得到的8个组分进行一级全扫描质谱分析,得到分子离子峰,该美拉德在正离子下信号相应值较高。结果发现各峰的一级质谱中仍含有多个离子峰,其中峰Ⅱ中有离子峰较大的组分,其它组分中的离子峰均较小,因此着重对峰Ⅱ进行研究,其紫外图谱和总离子流图谱如图7所示。

图4 不同液相色谱柱的分离效果图Fig.4 HPLC spectrums from different columns
由图7所示,紫外图上显示有两个主要的峰,在4min以前化合物基本上从色谱柱上洗脱下来。与紫外图谱上的两个峰上的保留时间对应,在总离子流图上在4min以前也基本有两个峰。经分析发现,第一个峰中各化合物的分子离子峰基本上均不超过m/z 379,第二个峰中各化合物的分子离子峰m/z较小,主要是低于300的离子峰。在二甘肽-木糖美拉德反应体系中,尽管分子量分布测出MRPs中相对分子质量超过500以上的产物比例超过5%,而通过质谱并未检测出这段分子量所对应物质的质荷比,这种现象可能是由于该体系中高分子量的MRPs在质谱上的信号较弱所致[15-16]。
2.3.6 LC-MS/MS分析 为了进一步分析糖肽交联产物的结构,采用二甘肽-[13C5]-木糖体系作对照反应。在对照体系所形成的MRPs中,相同保留时间下LC-MS图谱中未观察到分子离子峰为m/z 379,而检测出一新的分子离子峰m/z 389,推测m/z 389和m/z 379所对应的MRPs实为同位素标记和未标记的结构相同的化合物。对分子离子峰m/z 379和m/z 389采用LC-MS/MS技术进行分析,所得的二级质谱结果如图8所示。
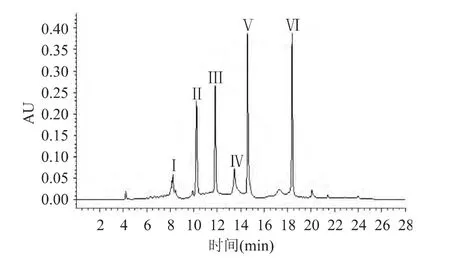
图5 二甘肽-木糖MRPs经Atlantis T3色谱柱分离的液相色谱图Fig.5 HPLC spectrum of MRPs derived from diglycine-xylosel system purified by Atlantis T3 column
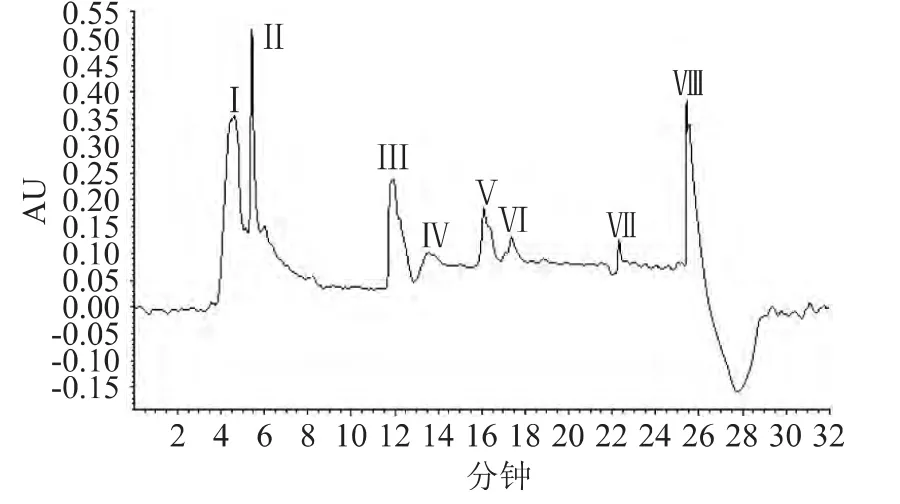
图6 二甘肽-木糖体系MRPs经Atlantis T3色谱柱二次分离的液相色谱图Fig.6 The second HPLC spectrum of MRPs derived from diglycine-xylose system purified by Atlantis T3 column
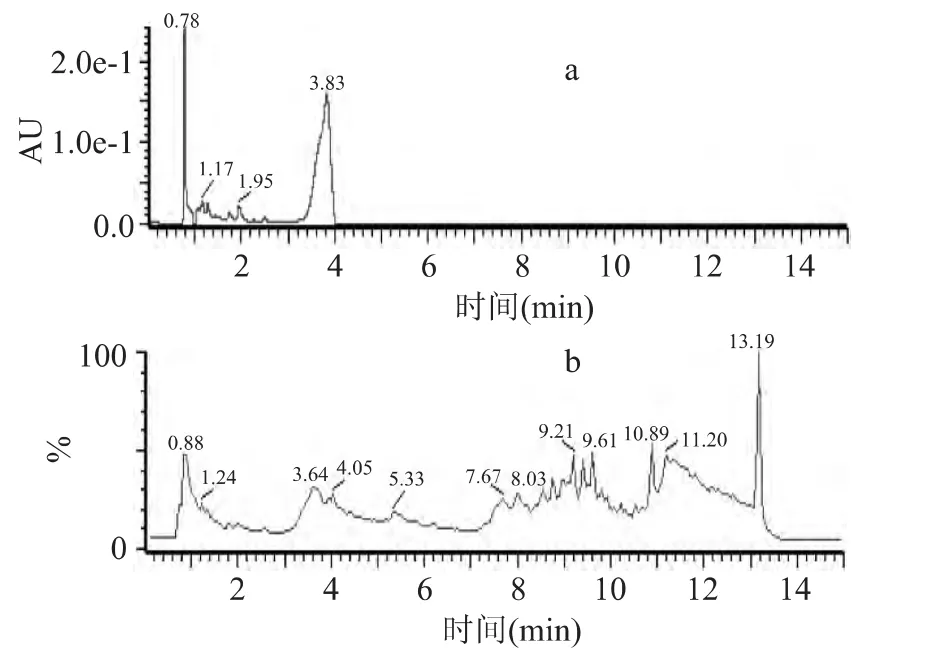
图7 峰Ⅱ的紫外图谱(a)和总离子流图(b)Fig.7 UV and total ion currency(TIC)profiles of peakⅡ by LC-MS
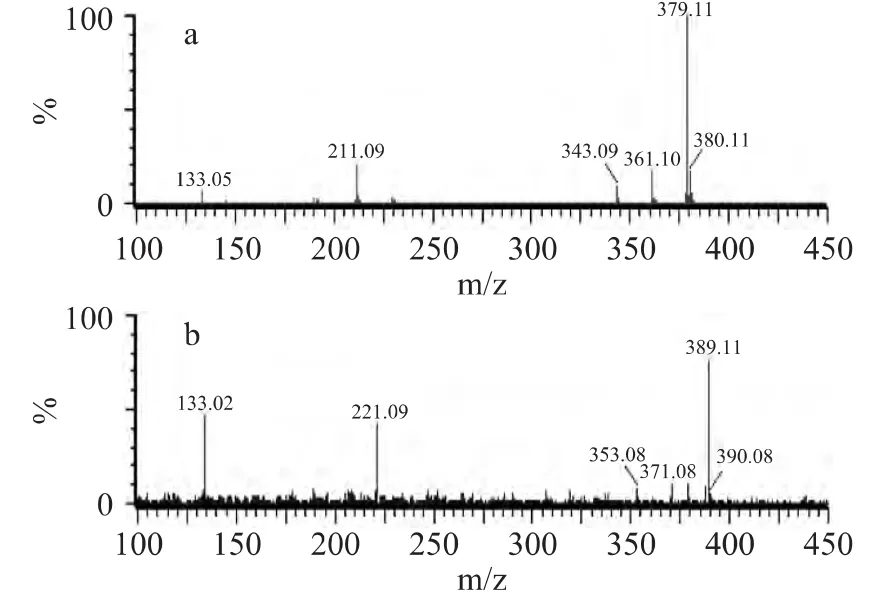
图8 分子离子峰m/z 379和m/z 389的二级质谱图Fig.8 LC-MS/MS profile of molecular ion peak m/z=379 and m/z 389
由图8a中的二级质谱数据可知,在二甘肽-木糖体系所形成的MRPs中,m/z 379为分子离子峰,m/z 361、343、221和133是其裂解产生的碎片离子峰。由分子离子峰m/z 379及其碎片离子峰可推测,分子离子峰m/z 379经连续2次脱水分别形成碎片离子峰m/z 361和m/z 343,后者进一步断裂成碎片离子峰m/z 211和m/z 133。
由图8b可知,在二甘肽-[13C5]-木糖对照体系所形成的MRPs中,m/z 389为分子离子峰,其裂解产生的碎片离子峰有 m/z 371、353、221和133。由此可知,分子离子峰m/z 379和m/z 389有相同的特征片段m/z 133,其余对应的碎片离子峰在m/z上相差10,进一步验证m/z 379和m/z 389可能为结构相同的物质,m/z的差异主要是由于后者反应底物为同位素标记的[13C5]-木糖产生的。由此可初步推测,分子离子峰m/z 379所对应的化合物所含有的碳原子中有10个来源于木糖或木糖的降解产物,除碎片m/z 133外其余的碎片均为含糖碎片。
3 结论
肽与还原糖经高温美拉德反应后,产物变得极为复杂,分离困难,直接获得糖肽单一的MRPs难度较大,通过同位素示踪法初步推断美拉德反应产物的形成及结构是一种较好的选择。除了形成挥发性风味物质外,小肽在高温下与还原糖或其降解产物可形成较大分子量的交联产物。由此推测,可通过一定分子量的肽开发具有风味增强特性的美拉德肽(1000~5000u MRPs)。
[1]Mennella C,Visciano M,Napolitano A,et al.Glycation of lysine- containing dipeptides[J].Journal of Peptide Science,2006,12(4):291-296.
[2]Hao Z,Lu CYJ,Xiao B,et al.Separation of amino acids,peptides and corresponding Amadori compounds on a silica column at elevated temperature[J].Journal of Chromatography A,2007,1147(2):165-171.
[3]Kim J S,Lee Y S.Antioxidant activity of Maillard reaction products derived from aqueous glucose/glycine,diglycine,and triglycine model systems as a function of heating time[J].Food Chemistry,2009,116(1):227-232.
[4]Frolov A,Hoffmann R.Separation of Amadori peptides from their unmodified analogs by ion-pairing RP-HPLC with heptafluorobutyric acid as ion - pair reagent[J].Analytical and Bioanalytical Chemistry,2008,392(6):1209-1214.
[5]Dai Z,Nemet I,Shen W,et al.Isolation,purification and characterization of histidino-threosidine,a novel Maillard reaction protein crosslink from threose,lysine and histidine[J].Archives of Biochemistry and Biophysics,2007,463(1):78-88.
[6]Ogasawara M,Katsumata T,Egi M.Taste properties of Maillard-reaction products prepared from 1000 to 5000 Da peptide[J].Food Chem,2006,99(3):600-604.
[7]Morales F,Van Boekel M.A study on advanced Maillard reaction in heated casein/sugar solutions:colour formation[J].International Dairy Journal,1998,8(10-11):907-915.
[8]Liu P,Huang M G,Song S Q,et al.Sensory characteristics and antioxidant activities of Maillard reaction products from soy protein hydrolysates with different molecular weight distribution[J].Food and Bioprocess Technology,2012,5(5):1775-178.
[9]Jing H,Kitts D D.Chemical and biochemical properties of casein-sugar Maillard reaction products[J].Food and Chemical Toxicology,2002,40(7):1007-1015
[10]Benjakul S,Lertittikul W,Bauer F.Antioxidant activity of Maillard reaction products from a porcine plasma protein-sug ar model system[J].Food Chemistry,2005,93(2):189-196.
[11]Baisier W M,Labuza T P.Maillard browning kinetics in a liquid model system[J].Journal of Agricultural and Food Chemistry,1992,40(5):707-713.
[12]Kim J S,Lee Y S.Study of Maillard reaction products derived from aqueous model systems with different peptide chain lengths[J].Food Chemistry.2009,116(4):846-853.
[13]Clark A V,Tannenbaum S R.Isolation and characterization of pigments from protein-carbonyl browning systems.Models for two insulin- glucose pigments[J].Journal of Agricultural and Food Chemistry,1974,22(6):1089-1093.
[14]Gu F,Kim J M,Hayat K,et al.Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein- glucose model system[J].Food Chemistry,2009,117(1):48-54.
[15]KislingeT,HumenyA,Peich C C,etal.Relative Quantification of N-(Carboxymethyl)lysine,Imidazolone A,and the Amadori Product in Glycated Lysozyme by MALDI-TOF Mass Spectrometry.Journal of Agricultural and Food Chemistry,2003,51(1),51-57.
[16]Meyer B,Al- Diab D,Vollmer G,et al.Mapping the glycoxidation productN-carboxymethyllysine in the milk proteome.Proteomics,2011,11(3),420-428.
