刺参自溶过程中水分变化规律的研究
2014-05-17仪淑敏王雪琦纪晓林李学鹏励建荣李钰金
仪淑敏,王雪琦,纪晓林,李学鹏,励建荣,* ,李钰金
(1.渤海大学食品科学研究院,渤海大学化学化工与食品安全学院,辽宁锦州121013;2.泰祥集团山东海洋食品营养研究院,山东荣成264300)
海参(Acaudina molpadioidea)为棘皮动物门(Echinodermata)海参纲(Hothuridea)循手目(Aspidochirot)的软体动物[1]。其中,刺参(Stichopus japonicus)具有极高的营养价值和药用价值,有抗肿瘤、抗疲劳、提高免疫力、抗真菌、降血脂等作用[2-5],目前已成为我国最重要的人工养殖经济品种之一,也是目前市场最畅销、经济效益最显著的水产品之一。近几年关于刺参的生物活性物质的研究越来越深入,但对刺参的大量研究主要集中于营养成分方面的分析[6-8],而鲜刺参由于含有大量的自溶酶而使其能在一定的条件下水解[9],长途运输可减重80%,因运输和储存困难,内陆人很难吃到鲜活刺参,所以一般将刺参等制作成干参或盐渍参,但是大量营养物质和生物活性成分在加工过程中流失[10-11]。有研究表明在对复水干海参的水分含量、分布及状态变化研究中发现随着复水时间延长,海参体内自由水、不易流动水含量增加,水分自由度增加[12]。目前,国内外关于水分分布状态对鲜刺参等物化特性影响的研究较少。本文研究了鲜刺参自溶过程中水分变化规律,运用低场核磁测刺参含水性具有无损、快速的优点,可实时监测刺参自溶过程的水分变化,可为刺参生鲜加工和贮运提供一种新的探索思路。
1 材料与方法
1.1 实验材料
刺参 购自锦州福清海鲜空运行。
1.2 实验设备
核磁共振成像仪 NMI20,上海纽迈电子科技有限公司;电热干燥箱:DHG-9055A 上海一恒科学仪器有限公司;电子天平 MS105DV,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 刺参的预处理 取刺参用刀从腹部划开,取内脏,倒出刺参体内水分,将刺参置于干净的烧杯中。将刺参切成细条状,然后切碎,用滤纸擦干刺参表面的水分备用。
1.3.2 水分含量的测定 参考国标GB5009.3-2010。
1.3.3 水分分布变化 将处理好的样品刺参放入核磁管中,每隔3h测一次,每次6组平行。核磁共振成像仪:线圈直径15mm,频率22.913MHz,温度控制在(32±0.01)℃范围。利用 Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列测定刺参的自旋-自旋弛豫时间 T2,参数:TD=700156,τ(us)=350,NS=8,EchoCnt=10000。
1.3.4 数据处理 数据采用MultiExplny Analysis软件进行反演,此软件使用综合迭代法算法,结果为离散型与连续性相结合的T2谱,得到相应数据。
2 结果与分析
2.1 室温下刺参自溶48h过程中水分含量的变化
刺参具有极强的自溶能力,在受到外界物理因素、化学因素和生理因素等刺激后,会出现吐肠和体壁软化的现象[13]。由图1可以看出,刺参在自溶过程中水分含量由开始的90.60%逐渐上升至94.60%,说明刺参在自溶过程中水分含量不断增加,刺参中液体含量增大,固形物含量减少可能是由于其中的蛋白质、脂肪等被刺参中的一些自溶酶分解产生了一些水分。

图1 刺参自溶48h过程中水分含量的变化Fig.1 The change of the moisture content of stichopus japonicus in the process of autolysis
2.2 刺参水分分布变化
由图2可以知道,刺参自溶过程中H质子的弛豫时间分布可以表明在刺参组织中存在3个水分群,弛豫时间越短说明水分与底物结合越紧密,弛豫时间越长说明水分越自由[14]。T2分为 T21(0~15ms)、T22(16~160ms)、T23(300~620ms)分别对应刺参中的结合水、不易流动水、自由水,从而可以用低场核磁共振研究刺参中水分的分布和流动。
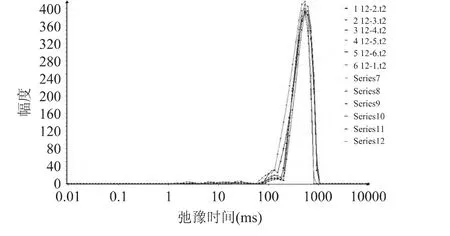
图2 刺参T2反演图谱Fig.2 The inversion map of T2in stichopus japonicus
2.2.1 弛豫时间T21峰值变化 刺参自溶48h过程中核磁共振T21(0~15ms)变化如图3所示,弛豫时间T21的水分代表的是与蛋白质等氨基、羰基以氢键相结合的单层水[15]。结合水的冰点很低,在-40℃,不易解离和蒸发[16],并不易受蛋白质结构和电荷变化的影响,因此对水分子的迁移影响不大。这部分水由图3中可以看出一直不断减少,可能是因为刺参在自溶过程中自身的组织结构遭到了破坏,水分逐渐挣脱原有束缚向外部迁移,所以结合力减弱,含量逐渐减少[15]。前12h下降速度快,峰比例的0.12%降至0.06%,后 12h下降速度平缓,由 0.06%至0.05%,最后24h峰比例由0.05%降至0.01%。可能是因为刚开始刺参自溶反应较快,后期自溶酶逐渐失活导致反应速度减慢。

图3 刺参自溶48h过程中核磁共振T21变化Fig.3 The change of the proportion of T21 in stichopus japonicus in the process of autolysis
2.2.2 弛豫时间T22峰值变化 刺参自溶48h过程中核磁共振T22(16~160ms)变化如图4所示,T22是位于高度组织化蛋白质结构内部的水(含肌原纤维蛋白的F-肌动蛋白/肌球蛋白与肌动球蛋白之间)即不易流动的水[16],范围为16~160ms。在刺参自溶过程中保持在0.29%~0.94%之间,能溶解盐类及其他物质,在0℃或稍低温度下结冰,通常情况下水分子的分布状态与迁移性质主要由这部分水决定。T22整体呈下降的趋势,且分别在 6、24、30、36、45h 时由上升趋势变为下降趋势,在15、27、33、42h时由下降趋势变为上升趋势,表明随着放置时间的延长,在自溶酶的作用下,疏松多孔结构被破坏,使得束缚水存在的微观结构遭到破坏,造成空隙体积的缩小,引起水分的迁移,使得不易流动的水向自由水移动[17],使T22值减少。李伟妮在冷藏山羊肉品质变化中发现,T22与总水分相对含量随着冷藏时间的变化呈下降趋势,并且T2值与羊肉的品质变化有显著的相关性,结果表明NMR技术能够很好地表征山羊肉冷藏期间有关水分及品质变化情况[18]。

图4 刺参自溶48h过程中核磁共振T22变化Fig.4 The change of the proportion of T22 in stichopus japonicus in the process of autolysis
2.2.3 弛豫时间T23峰值变化 刺参自溶48h过程中核磁共振T23(300~620ms)变化如图5所示,T23是刺参结构内部的自由水,范围是300~620ms,自由水是存在于细胞外间隙中的水分。由图5可知,刺参在室温条件下,随自溶时间的增加自由水含量不断增加,当至21h时达到最高点,峰比例由开始时的92.60%增至 99.14%,然后逐渐减少,峰比例由99.14%降至95.38%。可能是因为刺参自溶使自身的组织结构遭到破坏,使空隙体积减少,使不易流动的水向自由水移动,造成 T23的值增加[17]。另一方面,由于水分的蒸发作用,使测量的自由水含量在达到最高点后逐渐减少。Bertram[19]对猪肉和牛肉在贮藏过程中水分的迁移情况进行了研究,结果发现而随着冻藏时间延长,肉中的自由水的含量也明显增多。
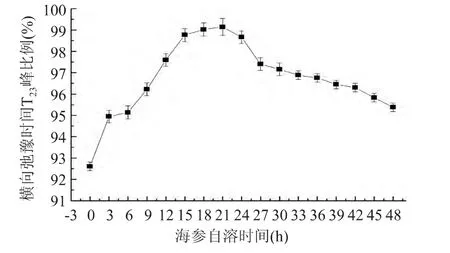
图5 刺参自溶48h过程中核磁共振T23变化Fig.5 The change of the proportion of T23 in sea cucumber in the process of autolysis
2.2.4 弛豫时间T2变化 图6为刺参弛豫时间T21(0~15ms),T22(16~160ms),T23(300~620ms)随着自溶时间的变化,结果表明随着刺参的自溶,T21,T22,T23为波浪式变化,但整体上仍呈上升趋势,也就是说,刺参自溶的过程中,结合水和不易流动的水的弛豫时间均延长,二者逐渐向自由水转变,使得自由水的弛豫时间呈上升的趋势。原因可能是刺参在自溶酶的作用下,刺参自身的结果遭到破坏,引起水分迁移,结合水和不易流动的水存在的微观结构遭到破坏,使得这两部分水向自由水转变。海参自溶过程中会有总糖的溶出,但是刺参自溶过程中的总糖的溶出基本不受温度变化的影响,且自溶酶的最高活性在50℃左右[20]。本文虽然在32℃下进行实验,而室温25℃左右,但由于内脏已去除,可能对刺参体壁中的自溶酶活性的影响不大。鲜刺参由于含有大量的自溶酶而使其能在一定的条件下水解,因此导致运输和储存困难,内陆人很难吃到鲜活刺参,如若将刺参等制作成干参或盐渍参,使得大量营养物质和生物活性成分流失,本文通过NMR对刺参自溶过程中的水分变化的研究,获得更详尽的水分信息,以便在贮藏和运输中,更快速、准确的进行水分动态的监测,并根据水分的变化来鉴定刺参的自溶程度,从而更好的防止由于刺参的自溶所带来的的经济损失。
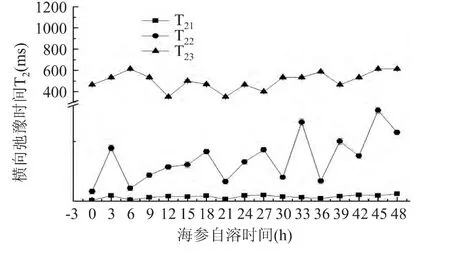
图6 刺参自溶48h过程中核磁共振弛豫时间T2变化Fig.6 The change of T2of stichopus japonicus in the process of autolysis
3 结论
运用低场核磁测刺参含水性具有无损、快速的优点,可实时监测刺参自溶过程的水分变化,为刺参生鲜加工和贮运提供一种新的探索思路。
刺参在自溶过程中的水分可分为结合水(T21)、不易流动水(T22)、自由水(T23)3种流动性不同的水。随着时间的延长,刺参在自溶过程中自由水(T23)含量先增加,然后由于水分的蒸发后缓慢下降,结合水(T21)含量不断下降,由开始时的峰比例0.12%降至0.01%,不易流动的水(T22)呈波浪形,无明显变化规律,刺参中的水分的横向弛豫时间(T21、T22和T23)呈波浪式变化,但整体呈上升趋势,同时刺参中的水分含量则从90.60%增加到94.60%。
[1]谭国福,刘佳仟,吴德刚,等.海参的加工及产品质量[J].食品与药品,2007,9(10):69-71.
[2]周湘盈,徐贵发.东海刺海参冻干粉对荷瘤小鼠的抑瘤作用及其免疫指标的影响[J].卫生研究,2008,37(1):30-32.
[3]Yuan ZH,Ba LF,Zun LY,et al.Antihypertensive effect and purification of an ACE inhibitory peptide from sea cucumber gelatin hydrolysate[J].Process Biochemistry,2007,42(12):1586-1591.
[4]Shen H,Chen J,Li H,et al.Progress of studies on the culture techniques of Sea Cucumber worldwide[J].Hebei Fisheries,2007,(6):3-5.
[5]刘小芳,薛长湖,王玉明.乳山刺参体壁和内脏营养成分比较分析[J].水产学报,2011,35(4):587-594.
[6]王哲平,刘淇,曹荣,等.野生与养殖刺参营养成分的比较分析[J].南方水产科学,2012,8(2):64-70.
[7]袁文鹏,刘昌衡,王小军,等.仿刺参不同部位营养成分的分析及综合评价[J].食品工业科技,2010,31(5):348-350.
[8]王永辉,李培兵,李天,等.刺参的营养成分分析[J].氨基酸和生物资源,2010,32(4):35-37.
[9]谭国福,梁陈长生,刘佳仟.海参的加工及产品质量[J].食品与药品,2007,9(10):69-72..
[10]夏远景,刘志军,李宁.超高压处理对海参自溶酶活性影响的研究[J].高压物理学报,2009,23(5):377-384.
[11]Zhu BW,Han B.Characterization and purification of Holothurians autoenzyme[J].Food and Fermentation Indus-tries,2004,30(4):132-137.
[12]张文杰,薛长湖,丛海花,等.低场核磁共振及成像技术对海参复水过程水分状态变化的研究[J].食品工业科技,2012,33(23):90-93.
[13]郑杰,吴海涛,董秀,萍,等.基于主要化学成分变化建立的海参自溶评价指标[J].大连工业大学学报,2010,20(6):391-395.
[14]姜晓文,韩剑众.生鲜猪肉持水性的核磁共振研究[J].食品工业科技,2009,30(7):128-131.
[15]成昕,张锦胜,钱菲等.核磁共振技术研究普通玉米淀粉与玉米抗性淀粉对肉糜持水性的影响[J].食品科学,2011,32(7):21-24.
[16]夏天兰,刘登勇,徐幸莲,等.低场核磁共振技术在肉与肉制品水分测定及其相关品质特性中的应用[J].食品科学,2011,32(21):253-256.
[17]崔宏博,宿玮,薛长湖.冷冻干燥南美对虾贮藏过程中各种变化之间的相关性研究[J].中国食品学报,2012,12(1):141-146.
[18]李伟妮,韩剑众.冷藏山羊肉品质变化的核磁共振研究[J].食品工业科技,2010,31(1):125-127.
[19]Bertram HC.NMR relaxometry and differential scanning calorimetry during meat cooking[J].Meat Science,2006,74(4):684-689.
[20]郑杰.海参自溶过程中生化变化及抗氧化活性寡肤的研究[D].镇江:江苏大学,2012.
