鸡肝脏蛋白质组学双向电泳方法的建立及初步分析
2014-05-10杭柏林孟令辉胡建和王青徐彦召张庆华魏晓晓
杭柏林,孟令辉,胡建和,王青,徐彦召,张庆华,魏晓晓
(1.河南科技学院,河南新乡453003;2.辉县市畜牧局,河南辉县453600)
随着蛋白质组学(proteomics)理论与技术的不断发展,从整体水平和动态水平上认识组织、器官、生物群落或生态环境中的各种生命现象或生物学规律已经实现[1-2].蛋白质组学中最重要的技术就是对混合样品中蛋白质的分离,而后进行鉴定.双向电泳(two dimensional gel electrophoresis,2-DE)技术是蛋白质组学技术中最经典的蛋白分离方法[3].双向电泳结合质谱(massspectrometry,MS)技术在畜牧兽医领域已经得到了多方面的应用[1,4-5].肝脏(liver)是机体的重要器官之一,执行着代谢等功能.据估计,在任意给定的时间点,有超过10 000个生物化学反应在肝脏中发生[6].然而,肝脏也易受到外界各种异物的危害,进而导致肝脏损伤.某些病原如禽多杀性巴氏杆菌、禽白血病病毒、马立克病病毒、组织滴虫等感染均可造成肝脏的损伤[7].因此,研究鸡肝脏蛋白质组双向电泳技术具有重要意义.
双向电泳试验操作繁琐,很多环节会影响到试验结果的可靠性、重复性与再现性[5].因此,针对不同的样品需要根据不同的试验条件摸索出比较切实可行的试验条件.本文以SPF鸡的肝脏为研究对象,对可能影响因素进行了优化,成功建立了鸡肝脏蛋白质组学双向电泳技术,为后续研究各种病原感染致鸡肝脏损伤病理机制等方面提供了可靠的技术支持.
1 材料与方法
1.1 试剂
尿素、CHAPS、三羟甲基氨基甲烷(Tris Base)、十二烷基磺酸钠(SDS)、甘氨酸(glycine)、丙烯酰胺(acrylamide)、甲叉双丙烯酰胺(methylene bisacrylamide)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、考马斯亮蓝G-250为 AMRESCO公司产品.二硫苏糖醇(DTT)为上海生工公司产品.碘乙酰胺(iodoacetamide)、矿物油、双向电泳蛋白定量试剂盒(Protein Assay)为Bio-Rad公司产品.IPG缓冲液(Bio-Lyte)、IPG干胶条为GE公司产品.低熔点琼脂糖(agarose)、蛋白酶抑制剂鸡尾酒混合液(Protease Inhibitor Cocktail)为Sigma公司产品.盐酸、磷酸、冰乙酸、甲醇、硫酸铵及其他试剂均为国产分析纯.
1.2 仪器
试验用到的仪器主要有超声破碎仪(Vibra Cell)、高速冷冻离心机(Eppendorf)、紫外分光光度仪(NanoDrop1000)、涡旋仪(Scientific Industries)、水平摇床(HY-4)、超低温冰箱(Thermo)、水化槽(GE Healthcare)、等电聚焦仪(GEHealthcare)、垂直电泳仪(GEHealthcare)、低温水循环系统 GEHealthcare)、纯水仪(Millipore)、扫描仪(UMAX)等,数据分析采用 PDQuest8.0.1图像分析软件(Bio-Rad).
1.3 试剂溶液的配制
样品裂解液和水化液、Tris-HCl、平衡缓冲液、SDS电泳缓冲液、30%聚丙烯酰胺贮液、1%溴酚蓝储备溶液、10%SDS、琼脂糖封胶液等试剂溶液均按照GE公司的推荐配方进行配置.10%过硫酸铵和固定液(V(水)∶V(乙醇)∶V(乙酸)=5∶4∶1)现配现用.胶染色液(1 L):去离子水 100mL,H3PO4100mL,充分混匀;(NH4)2SO4100 g,边搅拌边加入,充分溶解;加入考马斯亮蓝G-250 1.2 g,长时间搅拌溶解;去离子水定容至800mL,边搅拌边加入甲醇200mL;终体积1 000mL;分装后室温保存.
1.4 鸡肝脏样品的采集
30日龄SPF白莱航鸡颈静脉放血后,剖开胸腹腔,取肝脏组织一小块,置于冷的灭菌去离子水中,清洗10 s左右,置于滤纸上吸干水分,放入冻存管中,置液氮中保存.
1.5 鸡肝脏总蛋白的制备
从液氮中取出肝脏组织,置预冷的清洁研钵中,研磨成粉末;取0.1mg左右的粉末加入裂解液1mL,用移液器吹吸混匀;涡旋仪上混摇2 min,放冰上,置旋转摇床上摇30 min,重复4次;超声裂解,30Amplitute,3min,9 s/pulse,重复4次;15 000 r/min,30min,16℃;取中间层于另一个EP管中;15 000 r/min,15min,16℃;取上层于另一个EP管中;分装,置-70℃保存.
1.6 蛋白定量
为保证蛋白上样量的一致性,对提取的总蛋白进行定量.应用BIO-RADProtein Assay试剂盒对提取的肝脏蛋白进行Bradford法[8]测定.定量后的蛋白溶液进行分装,-70℃保存.
1.7 IPG胶条的水化及等电聚焦
胶条水化:将胶条从-20℃取出,室温下放置20~30min;将蛋白样品与水化液混合,终体积400μL,充分混合,室温静置15min;15 000 r/min,15min,16℃;取上层液体,均匀线性加入水化槽中;去除胶条保护膜,将胶面与液面接触,避免产生气泡;将水化槽置于水平位置,水化12 h以上.
等电聚焦:将水化好的胶条置于聚焦槽的相应位置,对好正负极;将浸泡过去离子水的电极纸放在胶条的两端,与胶面接触;加上矿物油,防止聚焦过程中水分蒸发;在胶条两端的电极纸上加上电极板;盖上盖子,启动电源,设置并启动等电聚焦程序(见表1).

表1 等电聚焦程序Tab.1 Program of isoelectric focusing electrophoresis
1.8 胶条平衡
胶条分2次平衡:将胶条置于去离子水中5 s左右,去除表面矿物油;将胶条置于滤纸上,先水平再垂直,避免胶面与滤纸的接触,去除多余水分;将胶条置于平衡管中,加入平衡液10mL(含1%DTT),置水平摇床上平衡15min;取出胶条,置于滤纸上,先水平再垂直,去除多余平衡液;将胶条置于另一个平衡管中,加入平衡液10mL(含2.5%碘乙酰胺),置水平摇床上平衡15min;取出胶条,置于滤纸上,去除多余平衡液.
1.9 SDS-PAGE电泳
提前3~5 h配制好12%的SDS-PAGE凝胶,用去离子水清洗玻璃板,用1×SDS电泳缓冲液润洗胶面,然后用滤纸吸去多余液体;将胶条在1×SDS电泳缓冲液中润洗3~5 s,垂直置于滤纸上3~5 s;将胶条朝上置于长玻璃板上,用压板轻轻向下推,置胶面上方0.5~1 cm处;在凝胶上方加入已融化好的低熔点琼脂糖封胶液(约40℃)2~3mL;用胶板将胶条向下推,使其与凝胶面完全接触,同时避免胶面与胶条之间产生气泡,室温下静置10min;将凝胶板转入电泳槽中,加上层电泳缓冲液;电泳:5W、30min,10W、4~6 h;待溴酚蓝指示剂到达底部边缘约0.5~1 cm时,结束电泳.
1.10 固定与染色
将凝胶转入固定液中,置于水平摇床上,轻轻摇晃2~3 h;用去离子水漂洗4次,15min/次;加入考马斯亮蓝G-250染色液,染色12 h以上;用去离子水漂洗至背景清楚.
1.11 图像扫描与分析
凝胶用扫描仪进行图像透射扫描,分辨率为300 dpi;用PDQuest软件过滤或去除图像的背景和条纹,并检测蛋白质斑点数.
2 结果与分析
2.1 肝脏蛋白制备率
使用1mL组织裂解液按照本研究的制备程序进行了2次蛋白样品制备,所制备的肝脏总蛋白质质量浓度范围在5.67~5.72mg/mL,表明提取蛋白的方法可靠.
2.2 不同长度胶条和蛋白上样量的影响
为了选择合适长度的IPG胶条,分别对24 cm pH3-10和18 cm pH3-11的IPG胶条的分离效果进行了比较,结果如图1所示.按照公司的推荐,18 cm胶条的蛋白最大上样量为200μg,24 cm胶条的蛋白最大上样量为400μg.
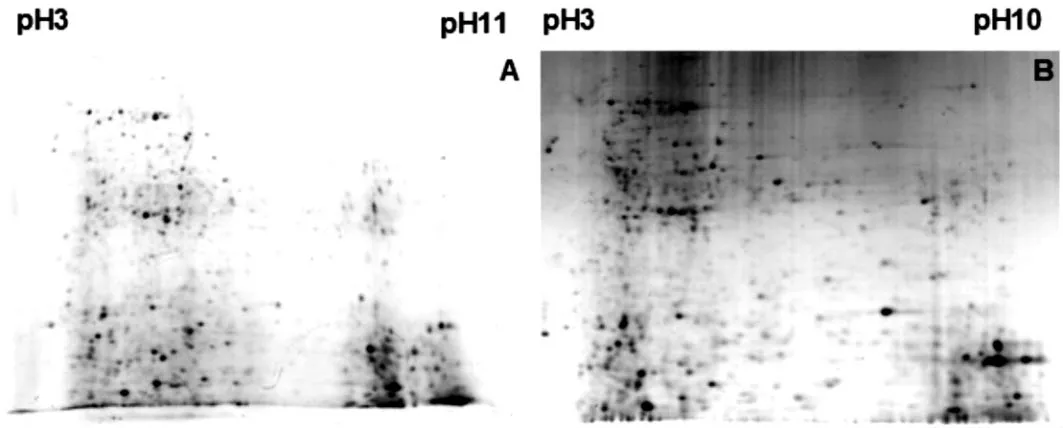
图1 鸡肝脏蛋白不同长度胶条双向电泳结果Fig.1 2-DE results of chicken liver proteins using different long strips
从图1可以看出,24 cm的IPG胶条的蛋白分离效果明显好于18 cm的IPG胶条,蛋白点数明显增多,特别是在上方高分子量区域.同时,还可以看出,当蛋白上样量增加后,许多相同位置的斑点面积变得更大.基于蛋白分离的清晰及有利于图像分析的考虑,选择24 cm的IPG胶条进行后续试验.
2.3 不同聚焦时间和水化液中DTT的含量的影响
为了得到一个比较清晰的双向电泳图谱,需要对双向电泳的参数进行优化.在双向电泳图谱中,最常见到的是蛋白点的纵向拖尾和横向拖尾.因此,需要对引起蛋白点横向拖尾和纵向拖尾的因素进行优化.在本研究中,几乎没有出现纵向条纹,但出现了横向条纹.本文主要对DTT含量和等电聚焦时间进行优化,结果如图2所示.
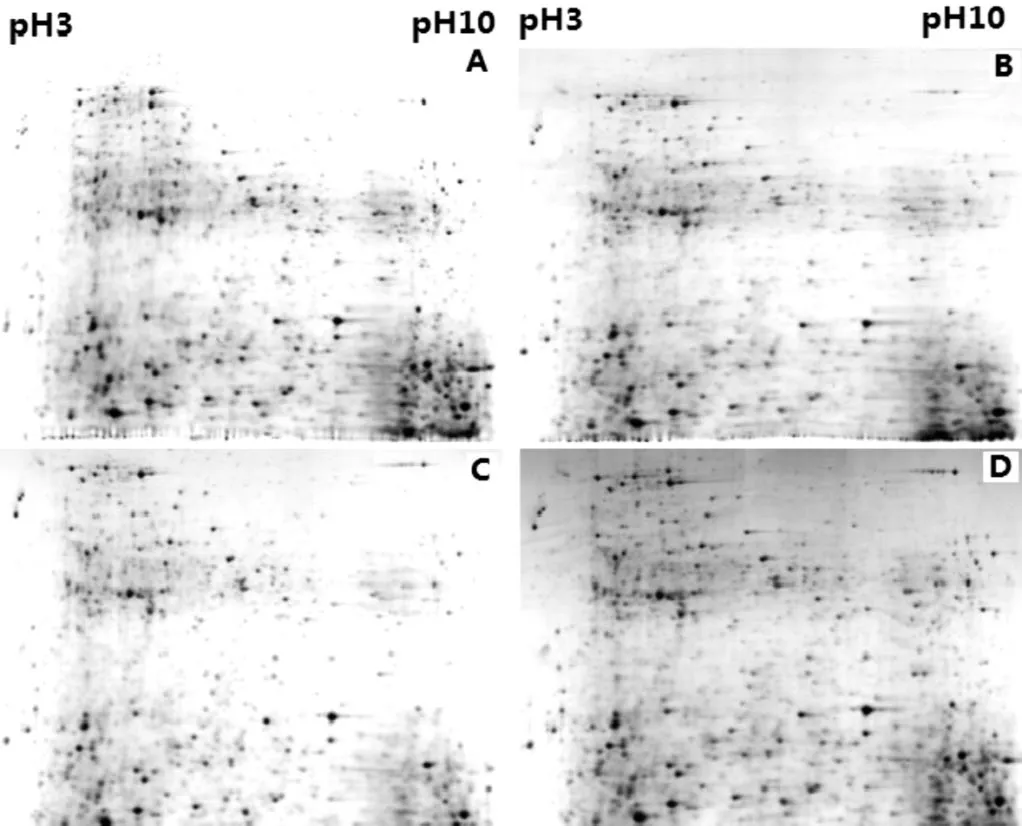
图2 聚焦时间和DTT的量对肝脏蛋白双向电泳结果的影响Fig.2 Effects of time and DTT concentration on 2-DE of chicken liver proteins
由图2可知,当水化液中DTT含量一致时,等电聚焦时间越长,蛋白点拖尾的现象就越明显.当等电聚焦时间一致时,水化液中DTT含量稍低时效果稍好一点.当在8 000 V下等电聚焦伏特小时为45 000时,水化液中4mol/LDTT 2.5μL时,斑点的横条纹几乎没有.因此,本文认为8 000 V时等电聚焦伏特小时为45 000,同时水化液(500μL)中4mol/LDTT 2.5μL为鸡肝脏双向电泳的较优的等电聚焦时间.
2.4 鸡肝脏双向电泳图谱特征分析
图2(C)是较好的鸡肝脏蛋白质组双向电泳图谱.从左至右,蛋白的等电点逐渐升高,从上到下,蛋白的分子量逐渐降低.酸性端的蛋白点比较多,而碱性端的蛋白点主要集中在低分子量部分.但是,在等电点大约7~8的地方,有比较模糊的区域,这个现象在多次的试验中均如此.通过软件分析,可以至少检测到1 200多个点.
3 结论与讨论
在蛋白质组学的研究技术中,双向电泳(又称二维电泳)是最常用的一种技术.双向电泳是利用蛋白质的等电点和相对分子量的差异将各种蛋白质分离开来的一种有效手段.肝脏是机体的重要器官之一,是机体内多种重要信息调控分子的集散地,执行着物质代谢、能量转化等多种生命功能.而生命功能的主要执行者是蛋白.因此,建立鸡肝脏蛋白质组学二维电泳方法对研究和探寻鸡在收到不同刺激(如病原感染、营养差异、中毒等)后肝脏中的差异蛋白及为揭示这种刺激的机制具有重要意义.
在本研究中,使用GE公司双向电泳的各种试剂配方较快捷地对鸡肝脏蛋白质组学双向电泳方法进行了优化.在优化过程中,使用了18 cm和24 cm的胶条.18 cm胶条的电泳图谱上没有横向拖尾,但在右侧上方区域有不是很明显的纵向拖尾,同时中间部分有几乎空白的不清晰区域.而24 cm胶条的电泳图谱上没有纵向拖尾,但有少部分的横向拖尾;18 cm胶条的电泳图谱上中间不清晰区域在24 cm胶条的电泳图谱上呈现出较多的蛋白点.因此,选择24 cm的胶条继续进行优化,以最大可能消除横向拖尾.
双向电泳中蛋白点的横向拖尾可由很多因素造成[9],如样品的制备及预处理、等电聚焦程序、蛋白的溶解性、残留多量核酸、盐浓度过高、聚焦不足或过度、上样量过大、胶条表面残留蛋白以及过多的DTT等.本研究通过多次超声裂解和多次离心以去除不溶解的颗粒和核酸以便保证样品中的蛋白均处于溶解状态,通过长时间的主动水化和聚焦后用去离子水彻底清除胶条表面的残留蛋白以及使用公司推荐的上样量基本上达到了试验要求.同时,本研究对等电聚焦程序、聚焦时间、除盐、DTT含量进行了重点优化.在等电聚焦早期,低电压具有除盐的作用.本实验中,将等电聚焦时低电压维持了较长时间,充分达到了除盐的目的.对聚焦时间和DTT含量的优化结果表明,在鸡肝脏双向电泳中,水化液(500μL)中2.5μL 4mol/LDTT和45 000 Vh的聚焦是较优的条件,成功减少了横向拖尾的出现.
本文通过对胶条的长度和等电聚焦程序以及水化液中DTT的量进行了简单的优化,初步建立了鸡肝脏蛋白质组学双向电泳方法,为后续研究鸡肝脏的功能及病原对肝脏的损伤机制提供了有效方法.
[1]Doherty M K,McLean L,Beynon R J.Avian proteomics:advances,challenges and new technologies[J].Cytogenetic and Genome Research,2007,117(1/4):358-369.
[2]Wilmes P,Bond P L.Metaproteomics:studying functional gene expression in microbial ecosystems[J].Trends in Microbiology,2006,14(2):92-97.
[3]阮松林,马华升.植物蛋白质组学[M].北京:中国农业出版社,2009.
[4]Theron L,Fernandez X,Marty-Gasset N,et al.Proteomic analysis of duck fatty liver during post-mortem storage related to the variability of fat loss during cookingof“foie gras”[J].JournalofAgriculturaland Food Chemistry,2013,61(4):920-930.
[5]卢占军,秦爱建,陈欣虹,等.雏鸡法氏囊蛋白质组学双向电泳技术的建立及其初步分析[J].畜牧兽医学报,2009,40(6):944-951.
[6]Gazzana G,Borlak J.An updateon themouse liver proteome[J].Proteome science,2009,7:35.
[7]陈溥言.兽医传染病学[M].北京:中国农业出版社,2006:377-381.
[8]Hammond JB,Kruger N J.Thebradfordmethod forprotein quantitation[J].Methods in Molecular Biology,1988,3:25-32.
[9]吴星烨,傅仲学,李明洋,等.RNA干扰SW480细胞HIF-1α双向凝胶电泳中横向拖尾的消除及条件的优化[J].中国生物制品学杂志,2009,22(8):748-752.
