血管紧张素Ⅱ及氯沙坦对小鼠足细胞葡萄糖转运蛋白4表达的影响
2014-05-03王泽彬傅君舟周姗姗
王泽彬,傅君舟,周姗姗
(1.广州医科大学附属第二医院肾内科,广东 广州 510260;2.广州医科大学附属广州市第一人民医院肾内科,广东 广州 510182)
血管紧张素Ⅱ及氯沙坦对小鼠足细胞葡萄糖转运蛋白4表达的影响
王泽彬1,傅君舟2,周姗姗2
(1.广州医科大学附属第二医院肾内科,广东 广州 510260;2.广州医科大学附属广州市第一人民医院肾内科,广东 广州 510182)
目的观察血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)对足细胞葡萄糖转运蛋白4(GLUT4)表达的影响,及血管紧张素1型受体阻断剂氯沙坦(Losartan,Lo)能否抑制AngII对足细胞GLUT4的作用。方法将小鼠MPC5足细胞分成对照组、AngⅡ10-6mmol/L组、AngⅡ10-8mmol/L组、AngⅡ10-10mmol/L组、Lo10-6mmol/L+AngⅡ10-6mmol/L组,半定量聚合酶链反应(RT-PCR)检测足细胞GLUT4mRNA的水平,间接免疫荧光检测GLUT4蛋白的表达。结果与对照组相比,AngⅡ10-6mmol/L组能够显著抑制GLUT4的表达及蛋白合成,GLUT4 mRNA的表达下降了56.1%(P=0.041),间接免疫荧光表达下降了54.9%(P<0.05)。AngⅡ10-8mmol/L组及AngⅡ10-10mmol/L组GLUT4的表达与对照组相比有所下降,但差异无统计学意义(P>0.05),AngⅡ10-8mmol/L组对GLUT4抑制强于AngⅡ10-10mmol/L组,两组间差异无统计学意义(P>0.05)。Lo 10-6mmol/L+AngⅡ10-6mmol/L组GLUT4的表达显著升高,与AngⅡ10-6组相比,mRNA升高176.3%(P=0.006),蛋白表达升高87.8%(P<0.05)。结论AngⅡ能够显著抑制足细胞GLUT4的表达及合成,具有浓度依赖性,这种作用能被氯沙坦所阻断。
血管紧张素Ⅱ;氯沙坦;足细胞;葡萄糖转运蛋白4
足细胞是构成肾小球三层滤过屏障的最后一道屏障,通过足突间的nephrin等分子结构将相邻的足细胞紧密铆合在一起,阻止白蛋白等大分子物质的滤出。足细胞是胰岛素敏感细胞[1],能够通过表达GLUT1及GLUT4从而快速转运葡萄糖,为足细胞的调节提供能量,维持肾小球滤过屏障的完整。AngⅡ已经被证明能够通过多种途径导致肾脏损伤,目前仍无实验证明AngⅡ是否对足细胞GLUT4的表达具有影响,从而导致滤过屏障的损伤。本实验通过AngⅡ对体外小鼠足细胞GLUT4的影响,探讨AngⅡ在肾脏损伤中的新机制。
1 材料与方法
1.1 主要试剂 RPMI 1640培养基、胰蛋白酶、Ⅰ型胶原(美国Gibco),胎牛血清(Hyclone),γ-干扰素(PEPROTECH INC)RNA提取试剂盒、Taq Platinum PCR MasterMix(TIANGEN),MMLV逆转录酶(Promega)。
1.2 足细胞的来源及分组 小鼠MPC5足细胞株由美国Mundel教授惠赠,北京大学第一医院丁洁教授转赠,本实验所用的足胞为13~14代。分组:将足细胞分为正常对照组、AngⅡ10-6mol/L组、AngⅡ10-8mol/L组、AngⅡ10-10mol/L组及Lo10-6+AngⅡ10-6组。
1.3 细胞培养 采用含10%(体积分数)的胎牛血清,20 μ/ml γ-干扰素的1640培养液,在33℃的培养箱(5%的CO2)中培养传代,然后细胞转入不含γ-干扰素的10%胎牛血清1640培养液中培养8~10 d,使足细胞成熟分化。待细胞长满培养瓶约80%,换无血清培养液孵育24 h,使细胞同步于G0期,按分组计划加入各组刺激药物培养液,作用4 h,每组设三复瓶。
1.4 总RNA的提取 用TIANGEN总RNA提取试剂盒,按说明书操作,提取各组细胞的总RNA,用紫外分光光度计测260 mm的紫外吸收值,根据OD260的值计算RNA的浓度。
1.5 GLUT4 mRNA的检测 引物合成:用Prime Primer5.0软件设计GLUT4寡核甘酸引物:正义链 5'-TGTTGCGGATGCTATGGG-3',反义链5'-CAGGGGGAATGAGGGGTA-3',长度为376 bp。按文献[3]合成GADPH引物:正义链5'-CTCATGACCACAGTCCATGC-3',反义链5'-CACATTGGGGGTAGGAACACcDNA-3'长度为201 bp。RT-PCR:取各组细胞5 μg的RNA逆转录成cDNA,然后进行PCR,反应,扩增条件:95℃预变性5 min,95℃30 s,55℃30 s,72℃30 s,29次循环,72℃延伸5 min,取5 μl的PCR产物于2%的聚丙烯酰胺凝胶中电泳,紫外灯下凝胶成像系统成像,用Image-J图像分析处理系统进行灰度分析,待测指标与GADPH的灰度比值表示其相对含量。
1.6 间接免疫荧光染色检测GLUT4蛋白表达 间接免疫荧光染色:取出各组玻片,用磷酸盐缓冲液(PBS)冲洗,95%的乙醇固定30 min,0.1%Triton X-100室温透化10 min,BSA封闭。滴加一抗(兔抗鼠GLUT4抗体,SANTA公司),4℃过夜,PBS冲洗,滴加二抗(TRITC标记的羊抗兔抗体,中杉金桥),室温2 h,防荧光衰减液封片,用荧光显微镜观察和记录各组足细胞GLUT4的蛋白表达。用Image Pro Plus 5.0图象分析系统测定荧光强度。
1.7 统计学方法 采用SPSS13.0软件进行统计学分析,计量资料以均数±标准差()表示,方差齐性的两均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 AngⅡ及氯沙坦对足细胞GLUT4 mRNA表达的影响 与对照组比较AngⅡ10-10mmol/L、AngⅡ10-8mmol/L、AngⅡ10-6mmol/L能够降低足细胞GLUT4 mRNA的表达,随着AngⅡ浓度增加,GLUT4 mRNA的表达逐渐下降。但AngⅡ10-10mmol/L组、AngⅡ10-8mmol/L组与对照组比较差异均无统计学意义;AngⅡ10-6mmol/L能够显著抑制GLUT4 mRNA的表达(P<0.05),见图1和表1。因此,本实验选取AngⅡ10-6mmol/L组作为氯沙坦的干预组,先用氯沙坦10-6mmol/L作用于足细胞,再加入AngⅡ10-6mmol/L,在 Lo10-6+AngⅡ 10-6mmol/L组,GLUT4 mRNA的表达显著高于AngⅡ10-6mmol/L组(P<0.05),见图1和表1。恢复到对照组的水平,与对照组比较差异无统计学意义(P>0.05)。
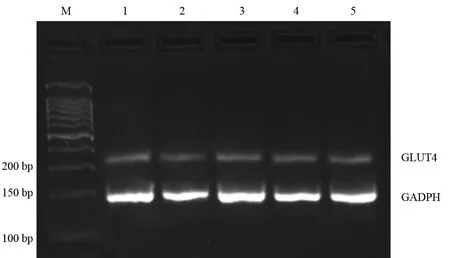
图1 各组GLUT4mRNA的表达
2.2 AngⅡ及氯沙坦对足细胞GLUT4蛋白表达的影响 在间接免疫荧光中,与对照组比较,AngⅡ 10-10mmol/L、AngⅡ10-8mmol/L、AngⅡ10-6mmol/L能够降低足细胞GLUT4蛋白的表达,随着AngⅡ浓度增加,GLUT4蛋白的表达逐渐下降。但AngⅡ10-10mmol/L组、AngⅡ10-8mmol/L组与对照组比较差异无统计学意义;AngⅡ10-6mmol/L能够显著抑制GLUT4蛋白的表达(P<0.05),见图2和表2。因此,本实验选取AngⅡ10-6mmol/L组作为氯沙坦的干预组,先用氯沙坦10-6mmol/L作用于足细胞,再加入AngⅡ10-6mmol/L,在Lo10-6+AngⅡ10-6mmol/L组,GLUT4蛋白的表达显著高于AngⅡ10-6mmol/L组(P<0.05),见图2和表2。恢复到对照组的水平,与对照组比较差异无统计学意义(P>0.05)。
表1 各组GLUT4 mRNA的表达(,mmol/L)

表1 各组GLUT4 mRNA的表达(,mmol/L)
注:a与CON组比较,P<0.05;b与Lo10-6+AngⅡ10-6比较,P<0.05。
组别CON组AngⅡ10-6组AngⅡ10-8组AngⅡ10-10组Lo10-6+AngⅡ10-6组孔数33333 GLUT4 mRNA 0.212±0.109 0.093±0.041ab0.184±0.085 0.192±0.077 0.257±0.229
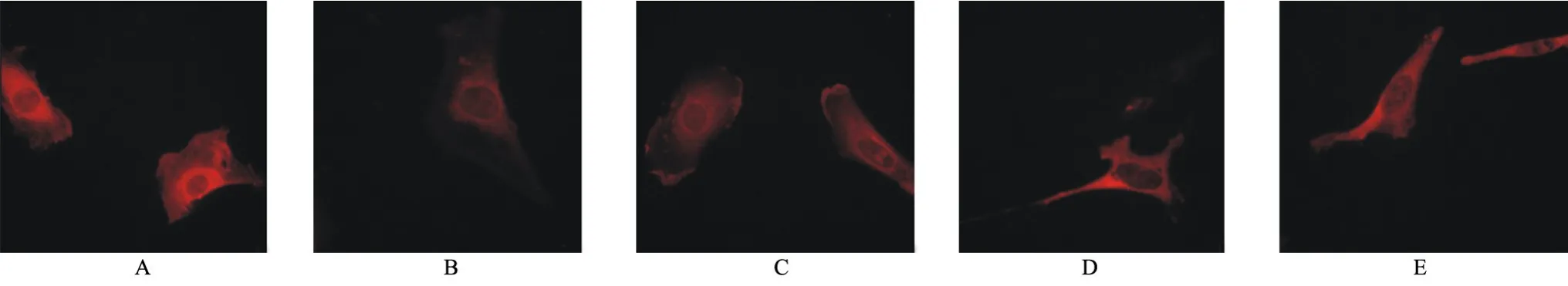
图2 各组GLUT4免疫荧光表达
表2 各组GLUT4蛋白的表达(,mmol/L)

表2 各组GLUT4蛋白的表达(,mmol/L)
注:a与CON组比较,P<0.05;b与Lo10-6+AngⅡ10-6组比较,P<0.05。
组别Con AngⅡ10-6AngⅡ10-8AngⅡ10-10Lo10-6+AngⅡ10-6孔数33333 GLUT1 mRNA 28.04±10.82 12.64±4.68ab23.59±9.25 24.39±8.06 23.75±6.13
3 讨 论
血管紧张素Ⅱ(AngⅡ)能够通过多种途径损伤肾脏,其中有血流动力学的因素[2],例如引起肾血管收缩,导致肾脏缺血,肾小球率过滤下降,造成缺血性损伤;也有非血流动力学的因素[3],AngⅡ能够通过刺激转化生长因子β(TGF-β)的合成导致肾小球系膜基质大量增生,而且能够通过血管紧张素Ⅱ2型受体作用,导致小鼠肾小球上皮细胞凋亡脱落[4],从而引起肾小球硬化。足细胞是高度分化的终末细胞,通过足突相互嵌合并粘附于基底膜,目前已经发现足细胞病变是某些先天性肾病综合征及肾病综合征早期蛋白尿产生的重要原因[5-6],在1型及2型糖尿病肾病早期[7-8],即出现足细胞功能异常及脱落。葡萄糖转运蛋白(GLUT)是哺乳类动物摄取葡萄糖并加以利用的重要分子[9],目前发现人类足细胞中有GLUT1及GLUT4的表达[1],在足细胞转运葡萄糖中起到重要作用,其功能异常可能是足细胞胰岛素抵抗的重要原因,是糖尿病早期蛋白尿产生的重要因素。本文通过AngⅡ对足细胞GLUT4的影响,探讨AngⅡ在糖尿病肾病中可能起到的病理生理作用,为糖尿病肾病的早期诊断治疗提供一定的理论依据。
本研究中,体外培养的足细胞在AngⅡ的刺激下GLUT4的转录及蛋白表达明显降低,AngⅡ10-6mmol/L的刺激浓度与对照组比较,GLUT4 mRNA的表达下降了56.1%(P<0.05),蛋白表达下降了54.9%(P<0.05);AngⅡ10-10mmol/L、AngⅡ10-8mmol/L浓度刺激下,GLUT4表达与对照组比较,虽然差异无统计学意义,但仍有明显的下降趋势,随着浓度的增加,GLUT4的表达越受到抑制,这说明AngⅡ对GLUT4的转录及蛋白表达的抑制作用呈剂量依赖性。在足细胞用血管紧张素1型受体(AT1)阻断剂氯沙坦(Lo)作用后,再用AngⅡ刺激足细胞,发现GLUT4的转录及蛋白表达与AngⅡ10-6mmol/L比较,分别升高了176.3% (P=0.006)及87.8%(P<0.05),说明AngⅡ通过其1型受体对足细胞进行作用,AT1受体阻断剂能在受体水平阻断这种作用。与骨骼肌一样,足细胞也能通过GLUT1及GLUT4将组织间液中的葡萄糖快速转运入细胞内,为细胞的运动调整提供能量,足细胞作为肾小球滤过屏障的最后一层结构,需要不断地调整自身结构维持屏障的完整,这需要通过细胞骨架的构型变换完成[10],足细胞通过GLUT1、GLUT4吸取葡萄糖为这种调整提供能量。目前已经发现足细胞能够表达AT1受体[11],为AngⅡ作用于足细胞提供条件,从而引起GLUT4的表达下降,引起足细胞的胰岛素抵抗,造成肾小球滤过屏障的损伤,从而导致蛋白尿的生成。但目前最新的研究[12]表明,小鼠足细胞还能够表达血管紧张素转化酶2(ACE2),能够降解AngⅡ为Ang1-7,对足细胞有保护作用。因此,AngⅡ对足细胞的具体作用还需要更多的实验加以证实。
本研究发现AngⅡ能够从转录水平及蛋白合成水平阻止足细胞GLUT4的合成,这种作用能够被血管紧张素受体1阻断剂氯沙坦所阻断,证明的AngⅡ是通过AT1受体发挥作用,导致足细胞的损伤,并且这种作用具有浓度依赖性。足细胞GLUT4的表达下降可能与足细胞的胰岛素抵抗有关,从而引起滤过屏障的损伤,导致蛋白尿的产生。
[1]Coward RJ,Welsh GI,Yang J,et al.The human glomerular podocyte is a novel target for insulin action[J].Diabetes,2005,54: 3095-3102.
[2] Matsusaka T,Hymes J,Ichikawa I.Angiotensin in progressive renal diseases:theory and practice[J].J Am Soc Nephrol,1996,7: 2025-2043.
[3]Kagami S,Border WA,Miller DE,et al.AngiotensinⅡ stimulates extracellular matrix protein synthesis through induction of transforming growth factor expression in rat glomerular mesangial cells[J].J Clin Invest,1994,93:2431-2437.
[4]Guohua DING,Krishna REDDY.AngiotensinⅡinduces apoptosis in rat glomerularepithelial cells[J].Am J Physiol Renal Physiol, 2002,283:F173-F180.
[5]Boute N,Gribouval O,Roselli S,et al.NPHS2,encoding the glomerular protein podocin,is mutated in autosomal recessive steroid-resistant nephritic syndrome[J].Nat Genet,2000,24:349-354.
[6]Kaplan JM,Kim SH,North KN,et al.Mutations inACTN4,encoding alpha-actinin-4,cause familial focal segmental glomerulosclerosis[J].Nat Genet,2000,24:251-256.
[7]Bjorn SF,Bangstad HJ,Hanssen KF,et al.Glomerular epithelial foot processes and filtration slits in IDDM patients[J].Diabetologia,1995,38:1197-1204.
[8]White KE,Bilous RW,Marshall SM,et al.Podocyte number in normotensive type 1 diabetic patients with albuminuria[J].Diabetes,2002,51:3083-3089.
[9]Rothman DL,Shulman RG,Shulman GI.31P nuclear magnetic resonance measurements of muscle glucose-6-phosphate.Evidence for reduced insulin-dependent muscle glucose transport or phosphorylation activity in non-insulin-dependent diabetes mellitus[J].J Clin Invest,1992,89(4):1069-1075.
[10]詹俊琳,王泽彬,傅君舟.血管紧张素Ⅱ对足细胞骨架的影响[J].国际医药卫生导报,2010,16(18):2201-2204.
[11]Sharma M,Sharma R,Greene AS,et al.Documentation of angiotensinⅡ receptors in glomerular epithelial cells[J].Am J Physiol Renal Physiol,1998,274:F623-F627.
[12]Nadarajah R,Milagres R,Dilauro M,et al.Podocyte-specific overexpression of human angiotensin-converting enzyme 2 attenuates diabetic nephropathy in mice[J].Kidney Int,2012,82:292-303.
Influence of angiotensinⅡand losartan on GLUT4 expression in cultured mouse podocyte cells.
WANG Ze-bin1,FU Jun-zhou2,ZHOU Shan-shan2.
1.Nephrology Department,Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260,Guangdong,CHINA;2.Nephrology Department,Guangzhou First People's Hospital Affiliated to Guangzhou Medical University,Guangzhou 510182,Guangdong,CHINA

ObjectiveTo investigate the influence of angiotensinⅡ(AngⅡ)on the expression of GLUT4 and whether losartan(Lo)could depress the function of AngⅡon podocytes.MethodsThe mouse podocyte clone 5 (MPC5)were divided into five groups:the control group,AngⅡ at the concentration of 10-6,10-8,10-10mmol/L groups,and Lo 10-6mmol/L+AngⅡ10-6mmol/L group.The GLUT4 mRNA level was detected by semi-quantitativeRT-PCR and the expression of GLUT4 by indirect immunofluorescence.ResultsCompared to the control group,in group AngⅡ10-6mmol/L,the GLUT4 expression and protein synthesis were significantly decreased,GLUT4 mRNA transcription was decreased by 56.1%(P=0.041),and indirect immunofluorescence expression was decreased by 54.9%. The GLUT4 expression of AngⅡ10-10mmol/L and AngⅡ10-8mmol/L group was decreased compared with the control group,but there were no statistically significant difference.AngⅡ10-8mmol/L depressed more GLUT4 expression than the AngⅡ10-10mmol/L did,and there were also no statistically significant difference(P>0.05).As for the Lo 10-6mmol/L+ AngⅡ10-6mmol/L group,the GLUT4 expression was significantly increased,when compared with the AngⅡ10-6group its GLUT4 mRNA transcription was increased by 176.3%(P=0.006),and indirect immunofluorescence expression increased by 87.8%(P<0.05).ConclusionAngⅡcould significantly decrease the GLUT4 expression and synthesis,and the effect was concentration dependent therefore could be hampered by Losartan.
AngiotensinⅡ;Losartan;Podocyte;Glucose transporter 4
R-332
A
1003—6350(2014)24—3592—04
10.3969/j.issn.1003-6350.2014.24.1404
2014-06-08)
