基于低温醇水体系的均相沉淀法制备纳米FePO4
2014-04-23伍丽萍郑典模田泽由黄同林李海港
伍丽萍, 郑典模,田泽由,黄同林,李海港
(1.江西省工业安全工程技术研究中心,江西南昌 330030;2.南昌大学环境与化学工程学院,江西南昌 330031;3.江西省化学工业设计院,江西南昌 330030)
随着环境保护和电动汽车技术等领域的发展,对安全、高效、价格低廉的新能源需求日益增加。LiFePO4作为锂离子电池的正极材料,具有原料丰富、价格低廉、放电比容量大(170mAh/g)[1]、无毒性、环境友好等优点。目前,锂离子电池使用的LiFePO4粉体粒径一般在5μm左右,较大颗粒的LiFePO4粉体中锂离子扩散困难,扩散系数低,导致锂离子电池的电化学性能不够理想。超细LiFePO4可以缩短锂离子的扩散路径,提高其扩散系数,纳米化的LiFePO4可一定程度上抑制正极材料发生不可逆相变,大为改善锂离子电池的电化学性能[2-4]。FePO4是制备LiFePO4的骨架材料,其制备的LiFePO4颗粒比FePO4大,只有超细(纳米)尺度的FePO4才可能制备超细(纳米)的 LiFePO4。
传统液相法制备纳米粉体的普遍性问题是粒径尺寸难控制、颗粒易团聚,将醇水体系应用到液相法制备纳米粉体,可提高粉体分散性和均匀性[5-6]。本文探讨在低温醇水体系中制备纳米FePO4粉体的工艺。
1 实验材料和方法
1.1 试剂和仪器
试剂:七水合硫酸亚铁(FeSO4·7 H2O,AR),硫酸(H2SO4,AR),磷酸(H3PO4,AR),双氧水(H2O2,AR),氨水(NH3,AR),SDS(AR),无水乙醇(AR),蒸馏水等。实验采用傅里叶红外光谱仪(FTIR,FT-IR360,NICOLET)进行样品成分分析,采用场发射扫描电子显微镜(FESEM,HITACHI,S4800,加速电压 30 kV)检测样品的形貌和粒度,采用粉末X射线衍射仪(XRD、D8 FOCUS、AXS)进行样品晶型分析,采用粒度分布仪进行样品粒度分布分析。
1.2 实验方法和条件
制备FePO4反应如下:
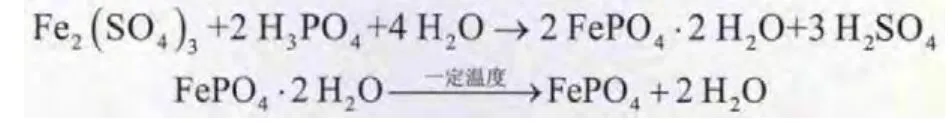
将适量FeSO4·7 H2O溶解于去离子水中,加入适量H2SO4和H2O2,配制成一定浓度的Fe2(SO4)3溶液,同时配制同等摩尔浓度的H3PO4溶液。取一定体积无水乙醇和表面活性剂于反应器内搅拌混合均匀,同时以5m L/min加入Fe2(SO4)3溶液和H3PO4溶液,反应一定时间后,用氨水调节pH至1.9±0.5,陈化1 h后进行抽滤,用去离子水和无水乙醇洗涤抽滤,进行喷雾干燥后于450℃煅烧2 h,即得到FePO4粉体。
实验方案流程图如图1所示。
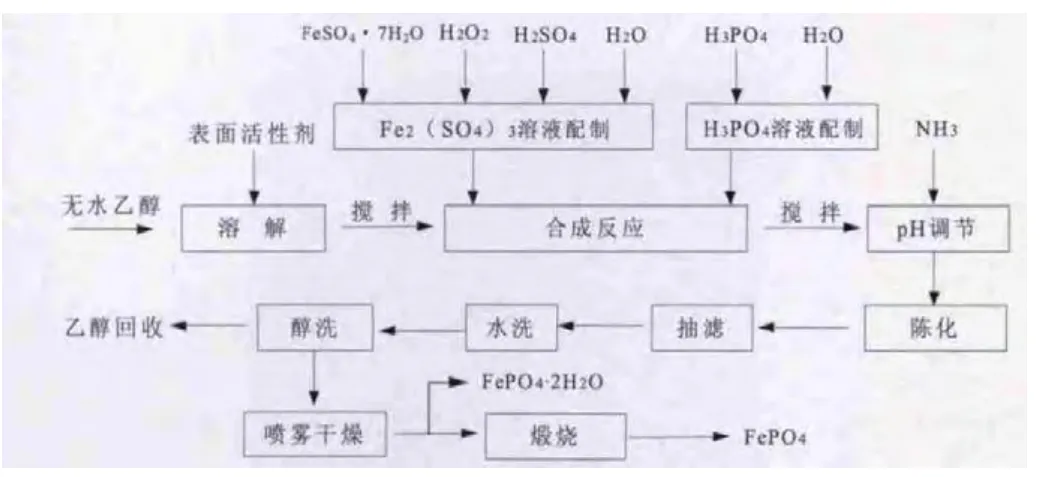
图1 实验流程图
2 实验结果的讨论
实验考察了醇水比例、反应物浓度、搅拌速度和反应时间对FePO4粉体粒度的影响。
2.1 实验
2.1.1 醇水比例对FePO4平均粒径影响
在反应物浓度为0.4mol/L,搅拌速度为3 000 r/m in,反应温度为35℃,反应时间为1 h的条件下,考察醇水比例为1∶8、1∶4、1∶2、1∶1、2∶1 时醇水比例对 FePO4粉体粒度的影响。实验结果如图2所示,当醇水比例<1时,粉体粒度随着醇水比例增加显著降低,而当醇水比例≥1后,粉体粒度随醇水比例增大而基本不变,因此醇水比例取1∶1比较合适。

图2 醇水比例与平均粒度的关系
文献[7]报道醇水体系中,其介电常数随乙醇加入量增加而减小,醇水体系中的反应产物的颗粒粒径随之减小。对于水溶液体系而言,若生成的沉淀粒子颗粒尺寸小,比表面积大,就很容易形成团聚体,加入乙醇后,醇水可以无限互溶,使得颗粒表面吸附的水分子大量替换为醇分子,降低了颗粒的表面张力和表面能,从而有效减轻了颗粒间的团聚趋势。另外,乙醇分子大于水分子,颗粒表面的乙醇分子能起到一定的空间位阻作用[8],降低颗粒间碰撞的几率,利于生成尺寸小、分散性好的颗粒。
2.1.2 搅拌速度对FePO4平均粒径影响
在醇水比例为1∶1,反应物浓度为0.4mol/L,反应温度为35℃,反应时间为1 h的条件下,考察了搅拌速度为100、500、1 000、2 000、3 000 r/min 时搅拌速度对 FePO4粉体粒度的影响。实验结果如图3所示,当转速≤2 000 r/min时,FePO4粉体粒度随着搅拌速度增大而增大;当转速>2 000 r/m in,继续增大转速,FePO4粉体粒度呈现减小的趋势。

图3 搅拌速度与平均粒度的关系
FePO4粉体粒度随着搅拌速度的增大呈现先增大后减小的趋势,其原因是由于初始时搅拌速度的增大加剧了颗粒之间的相互碰撞,使团聚加剧,形成了较大的团聚体颗粒;随着搅拌速度的增大,流体中的涡流剪切力随之增大,团聚体的破碎机率也增大,因此团聚体不会无限增大,最终在某个搅拌速度出现一个最大值,继续增大搅拌速度,颗粒将会随之减小[9]。
2.1.3 反应物浓度对FePO4平均粒度影响
在醇水比例为1∶1,搅拌速度为3 000 r/min,反应温度为35℃,反应时间为1 h,的条件下,考察了反应物浓度为0.2、0.4、0.6、0.8、1.2mol/L 时反应物浓度对 FePO4粉体制备的影响。
从图4可见,随着反应物浓度的增加,FePO4粉体粒径呈先增大后减小趋势。根据结晶过程原理,结晶过程包括晶核形成和晶核生长过程,在较低浓度时,随着反应物浓度的增大,反应中形成的晶核数目增加,晶核之间的接触概率增大,核化速率加快,导致晶粒增大;但是当达到一定的反应物浓度时,体系能迅速形成大量的晶核,单个晶核所能得到的反应生成的结晶物少,较难形成较大的晶粒[9]。
2.1.4 反应时间对FePO4平均粒径影响
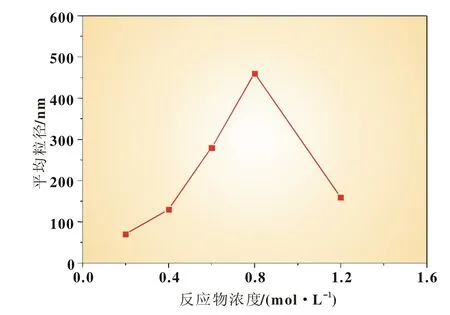
图4 反应物浓度与平均粒径的关系
在醇水比例为1∶1,反应物浓度为0.4mol/L,反应温度为35℃,反应时间为1 h的条件下,考察了反应时间为0.5、1、2、4、8 h时反应时间对FePO4粉体粒度的影响。实验发现,当反应时间在0~8 h,随着反应时间增加FePO4粉体粒度呈增大趋势,如图5所示。
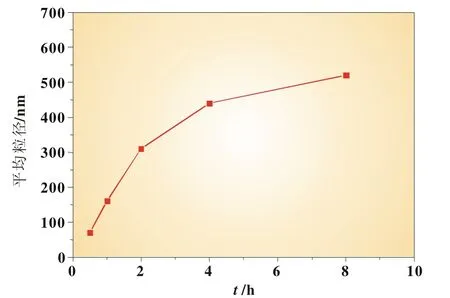
图5 反应时间与平均粒径的关系
根据结晶原理,结晶过程包括晶核的形成和生长过程,随着反应时间的增加,反应初期形成的大量晶核的相互碰撞团聚机会增大,晶核生长的时间更长,易形成更大的颗粒[9]。根据实验数据,反应时间0.5 h最佳,其反应已经彻底完成,且可得到较细的反应产物。
2.2 样品表征
在醇水比例为1∶1,反应物浓度为0.2mol/L,搅拌速度为3 000 r/min,反应时间为0.5 h,反应温度为35℃条件下制得FePO4·2 H2O样品,将所得FePO4·2H2O样品于450℃煅烧2 h制得FePO4样品,对样品进行FITR、XRD和FESEM检测分析。
2.2.1 FePO4·2H2O样品的红外光谱分析(FTIR)测定
图6是FePO4·2 H2O样品的红外吸收光谱图。FePO4·2 H2O的光谱活性主要由结晶水和磷酸根基团引起[10]。其中PO43-的吸收带主要有两个,即位于1 120~940 cm-1区间的强吸收峰和650~540 cm-1区间的中强吸收峰;结晶水的主要吸收能带3 650~3 100 cm-1区间的伸缩振动和1 800~1 500 cm-1区间的弯曲振动。图6的样品红外光谱中3 388 cm-1和1 636 cm-1分别是所带结合水(或者游离水)的伸缩振动(νOH)及弯曲振动(δOH);1 117 cm-1和 982 cm-1分别属于 PO43-的 ν3(F2)(即PO反对称伸缩振动)和ν1(A1)(即PO对称伸缩振动);539 cm-1的中强吸收峰为 PO43-的 ν4(F2)(即 PO2反对称弯曲振动)。
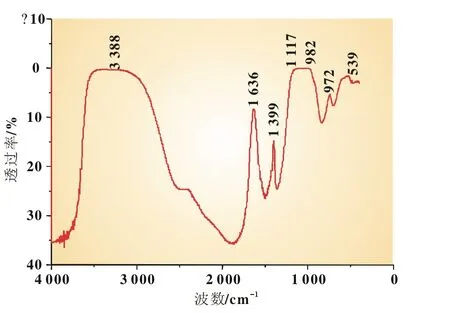
图6 FePO4·2 H2O的红外谱图
2.2.2 FePO4·2H2O样品的场发射扫描电子显微镜测定
由图7可见,所制得的FePO4·2 H2O样品呈不定形态,颗粒分散比较均匀,大小约为50~100 nm,分散性较好;由图8可以看出,所制得的FePO4为片状,大小约为100~300 nm,分散性较好。

图7 FePO4·2 H2O样品的FESEM照片

图8 FePO4样品的FESEM照片
2.2.3 FePO4样品的X-射线衍射分析测定
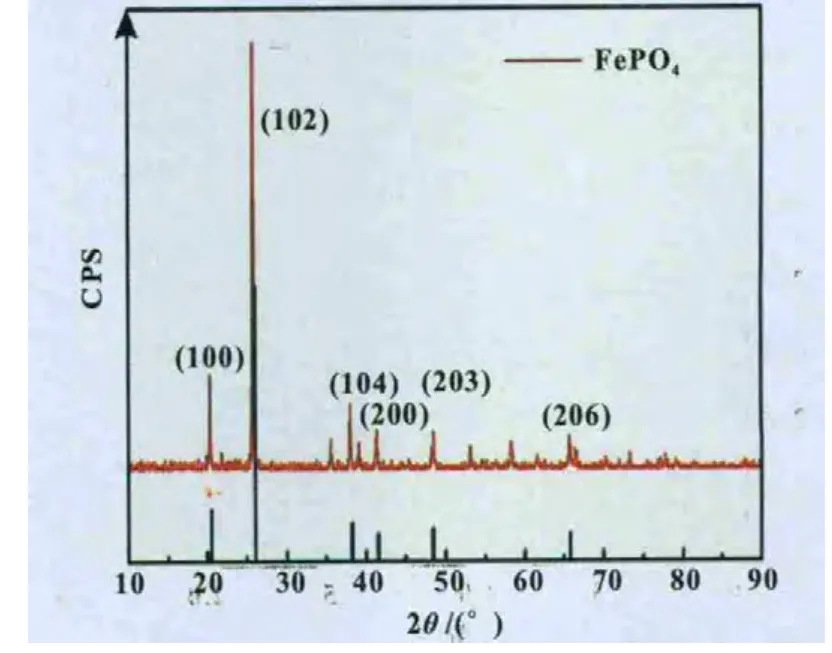
图9 FePO4样品及标准卡片29-0715的XRD谱图
图9为FePO4样品(煅烧后)XRD图谱,从图谱可见样品为α-石英晶型(即六方晶型)结构,样品图谱特征峰形尖锐,结晶度好,样品的图谱和衍射数据与FePO4(卡号:29-0715)标准谱和衍射数据非常相似,且X射线衍射谱中并未观察到其它的杂质峰,说明通过本实验制备得到的样品是纯相的FePO4,属于六方晶系,空间群是P321(150)。说明煅烧后无定形态的FePO4·2 H2O转变为六方晶系结构的FePO4。
通过对样品图谱的指标化计算处理,发现它的晶胞参数与标准PDF卡片29-0715极其相近,结果见表1。
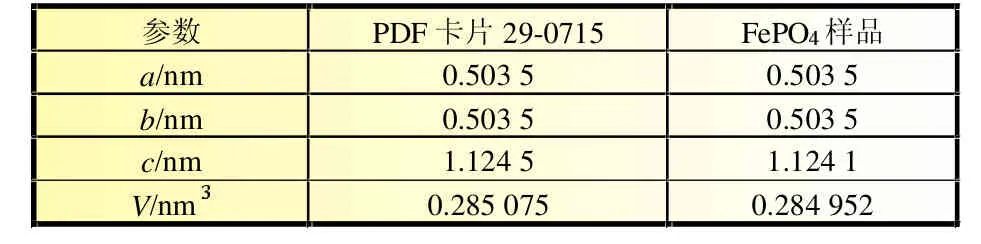
表1 标准PDF卡片29-0715与FePO样品的晶胞参数
3 结论
本实验对传统均相沉淀法制备FePO4粉体工艺进行改进,在低温醇水体系中,以FeSO4·7H2O和H3PO4为原料,制备FePO4粉体;讨论了醇水比例、反应物浓度、搅拌速度和反应时间等因素对FePO4粉体粒度的影响。
研究表明:粉体粒度随着醇水比例增大而降低;随着搅拌速度和反应物浓度增大都呈现出先增加后减小的趋势;反应时间增加使得FePO4粉体粒度逐渐增大。在醇水比例为1∶1,反应物浓度为0.2mol/L,搅拌速度为3 000 r/m in,反应时间为0.5 h,反应温度为35℃条件下制得的样品,表征结果显示其为粒度约50~500 nm的六方晶系结构高纯FePO4粉体。在低温醇水体系中,采用均相沉淀法制备FePO4粉体的工艺路线,具有产物纯度高、晶型完整、粒度小、反应温度低、反应时间和陈化时间短等优势。
[1]SYLVAIN F,FREDERIC L C,CAROLE B,et al.Comparison between different LiFePO4synthesis routes and their influence on it sphysico chem ical properties[J].Journal of Power Sources,2003,119:252-257.
[2]PROSINIPP,CAREWSKA M,SCACCIA S,et al.Long-term cyclability of nanostructured LiFePO4[J].Electrochem Acta,2003,48(28):4205-4211.
[3]WANGY G,WANGY R,HOSONO E,etal.The design of a LiFePO4/carbon nanocomposite w ith a core-shell structure and its synthesis by an in situ polymerization restrictionmethod[J].Angew Chem Int Ed,2008,47(39):7461-7465.
[4]高飞,唐致远,薛建军,等.喷雾干燥-高温固相法制备纳米LiFe-PO4与LiFePO4/C材料及性能研究[J].无机化学学报,2007,23(9):1603-1608.
[5]MOON Y,PARK H K,KIMD K,eta1.Preparation ofmonodisperse and spherical zirconia powders by heating of alcohol-aqueous salt solution[J].JAm Ceram Soc,1995,78(10):2690-2694.
[6]FANG C S,CHEN Y W.Preparation of titania particles by thermal hydrolysis of TiCI4in propanol solution[J].Preparation of titania particles by thermal hydrolysis of TiCI4in propanol solution[J].Materials Chemistry and Physics,2003,78(3):739-745.
[7]GOSTA A O.Dielectric constants of some organic solvent water m ixtures at various temperatures[J].Journal of the American Chemical Society,1932,54(11):4125-4139.
[8]陈建清.超细二氧化铈制备及其化学机械抛光机理研究[D].镇江:江苏大学,2004.
[9]叶铁林.化工结晶过程原理及应用[M].北京:北京工业大学出版社,2006:27-60.
[10]易均辉.FePO4和LiFePO4的制备、表征及电化学性能研究[D].广西:广西大学,2010.
