黄芩素PLGA纳米粒的体外评价及细胞相容性研究*
2014-04-14李楠刘志东范丽丽李琳王爱潮郭丽丽潘卫三
李楠,刘志东,范丽丽,李琳,王爱潮,郭丽丽,潘卫三
(1.天津市现代中药重点实验室-省部共建国家重点实验室培育基地,现代中药发现与制剂技术教育部工程研究中心,天津中医药大学,天津 300193;2.沈阳药科大学,沈阳 110016)
·中药研究·
黄芩素PLGA纳米粒的体外评价及细胞相容性研究*
李楠1,刘志东1,范丽丽1,李琳1,王爱潮1,郭丽丽1,潘卫三2
(1.天津市现代中药重点实验室-省部共建国家重点实验室培育基地,现代中药发现与制剂技术教育部工程研究中心,天津中医药大学,天津 300193;2.沈阳药科大学,沈阳 110016)
[目的]制备黄芩素聚(乳酸-羟基乙酸)共聚物(PLGA)纳米粒,并对其理化性质、体外释药以及体外角膜细胞相容性进行研究。[方法]使用乳化溶剂挥发法制备黄芩素PLGA纳米粒,评价其性质和体外缓释效果,主要包括:纳米粒粒径,纳米粒包封率,药物载药量和体外缓释曲线等。采用细胞增殖实验评价黄芩素PLGA纳米粒的细胞毒性。[结果]黄芩素PLGA纳米粒粒径(92.5±2.35)nm、Zeta电位(-21.1±2.5)mV、包封率(92.5±2.35)%、载药量(23.12±1.45)%。体外缓释实验提示:突释阶段黄芩素释放率在1 d内达(8.37±0.31)%,缓释阶段纳米粒可稳定释放,在10 d时释放达(51.30±0.50)%,细胞增殖实验提示黄芩素PLGA纳米粒对细胞体外生长无不良影响,细胞相容性好。[结论]采用乳化溶剂挥发法制备的黄芩素PLGA纳米粒具有良好的缓释效应和良好的细胞相容性。
缓释;PLGA纳米粒;黄芩素;细胞相容性
黄芩素是黄芩的主要活性成分之一,具有抗菌[1]、抗氧化[2]、抗病毒、抗辐射、抗肿瘤[3]等药理活性。聚(乳酸-羟基乙酸)共聚物(PLGA),通过了美国FDA认证,是一类可降解的有机聚合物,生物相容性好、无毒、无刺激性、具有缓释特性[4]。纳米粒(NP)为药物的良好载体,PLGA常用于制备微粒或纳米粒。本文以PLGA为载体,制备了黄芩素PLGA纳米粒,考察其理化性质,体外释药、细胞相容等特性。
1 仪器和试药
高效液相色谱仪(Agilent 1200,美国),KQ-300B超声清洗器(天津Autoscience公司),Ap205电子天平(METTLER TOLEDO,瑞士),电动搅拌机(EWKA,德国),激光粒径测定仪(马尔文NanoZS,英国),超声波细胞粉碎机(JY92-IIN宁波新型生物科技股份有限公司),高速冷冻离心机(J-25美国BECKMAN),溶出仪(ZRS-8G天大天发科技有限公司)。
黄芩素对照品(中国药品生物制品检定所,批号111595-200905),黄芩素提取物(成都欧康医药有限公司,含量>95%),聚乙烯醇(PVA,天津市光复精细化工研究所),聚乳酸-羟基乙酸共聚物(PLGA,济南岱罡生物科技有限公司),磷酸盐缓冲液(PBS溶液,Hyclone公司),DMEM/F-12培养液(Hyclone公司),PAA胎牛血清(上海索莱宝生物科技有限公司),CCK-8(日本同仁化学研究所),0.25%胰蛋白酶乙二胺四乙酸(EDTA)液(Sigma公司),甲醇、乙腈(天津市康科德科技有限公司,色谱纯),磷酸(天津市化学试剂科贸有限公司,色谱纯),其他试剂均为分析纯。
2 方法
2.1 纳米粒的制备及性质考察
2.1.1 黄芩素纳米粒的制备及性质考察采用乳化挥发法制备PLGA纳米粒,前期实验确定最优处方:PVA浓度为1%,分子量15 000 PLGA(75/25),PLGA浓度20g/L,有机相中丙酮∶无水乙醇=3∶1,有机相与水相体积比为1∶50,药物与PLGA比例为1∶40,制备PLGA纳米粒。采用超速冷冻离心法测定其包封率及载药量,激光粒径测定仪测定其粒径分布及Zeta电位值。将黄芩素PLGA纳米粒胶体溶液稀释50倍以后,滴至载玻片上,再滴至专用铜网上,使粒子在铜网上沉积。用透射电镜观察纳米粒的形态并照相。
2.1.2香豆素-6纳米粒的制备采用乳化-溶剂挥发法制备PLGA纳米粒,取适量PLGA和香豆素-6溶解于一定量丙酮中作为有机相,取适量聚乙烯醇(PVA)溶于水中作为水相。在电动搅拌下,将有机相缓慢滴加到水相中。持续搅拌2~4 h,直至丙酮完全挥干,将初乳于超声波细胞破碎仪中超声分散,经微孔滤膜过滤后,即得香豆素-6 PLGA纳米粒混悬液[5]。
2.2 纳米粒体外释放实验选用pH 6.8的磷酸盐缓冲溶液为溶出介质,中国药典2010版溶出度测定浆法。取黄芩素PLGA纳米粒胶体溶液、与纳米粒等浓度药物溶液2 mL分别置于透析袋中,平行6份,悬于200 mL释放介质中(100 r/min),分别于2 h、4 h、6 h、8 h、12 h、20 h、24 h、2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d、10 d取样2 mL并补同温度溶出介质,样品经15 200 r/min离心15 min,取上清液10 μL进样分析[6]。
2.3 香豆素-6 PLGA纳米粒眼部滞留性研究选取6只新西兰大白兔,分别取载相同量香豆素-6的PLGA纳米粒及溶液0.1 mL滴入家兔左眼结膜囊内,给药后使家兔眼睛被动闭合8~10 s,另一侧眼作为空白对照,每组平行3只。每隔15 min用裂隙灯观察兔眼角膜表面连续荧光层强弱[7]。角膜表面连续荧光层消失的时间即为眼部滞留时间,连续测定3次。
2.4 纳米粒细胞毒性实验
2.4.1 样品的制备按2.1项下确定的最终处方制备含药纳米粒及空白纳米粒。按纳米粒含药浓度以1‰浓度二甲基亚砜(DMSO)配置黄芩素药物溶液。所制备样品均过滤除菌,4℃保存。
2.4.2 细胞培养
2.4.2.1 细胞复苏从液氮中取出冻存的人角膜上皮细胞(HCEpic),置于37℃温水中,并轻轻摇动冻存管,其内容物融化后,消毒,移入超净台开启,采用吸管将细胞悬液移入加好全培基的培养瓶中,放入37℃培养箱静置培养,隔天换液[8]。
2.4.2.2 细胞传代采用10%胎牛血清DMEM/F-12培养基,置于37℃、5%CO2及饱和湿度条件下培养,待细胞长至培养瓶底面积80%~90%时,采用0.25%胰蛋白酶EDTA液消化细胞5 min,置于倒置显微镜下观察,等胞质回缩,细胞间隙逐渐增大,并有部分细胞漂起后,立即加入含10%胎牛血清的全培基培养液终止消化,轻轻吹打贴壁细胞,使细胞完全脱离瓶壁,形成单细胞悬液。800 r/min离心5 min,弃上清后加入新的完全培养基,细胞以1∶3比例传代[9]。
2.4.3 CCK-8法检测样品对角膜上皮细胞的毒性取生长状态良好并处于对数生长期的角膜上皮细胞,用0.25%胰蛋白酶EDTA液消化,并反复吹打制备成单细胞悬液,将细胞悬液的浓度调整为105个/mL接种于96孔板,每孔体积100 μL然后将培养板移入CO2培养箱中,在37℃、5%CO2及饱和湿度条件下培养24 h待细胞贴壁后,采用无血清培基对细胞同步化24 h。PBS溶液漂洗后,按浓度梯度在各孔中分别加入培基稀释的药物溶液、PLGA含药纳米粒各100 μL,培基作为空白对照,每组重复6孔,培养24 h后,PBS溶液漂洗后各孔加入10μL CCK-8,37℃孵育2 h后,通过酶标仪(450 nm)检测细胞增殖活力[10]。
2.5 统计学分析采用SPSS 18.0统计软件处理数据,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(one-wayANOVA),以P<0.05为差异有统计学意义。
3 结果
3.1 黄芩素PLGA纳米粒性质采用乳化挥发法制备纳米粒,纳米粒的理化性质见表1。黄芩素PLGA纳米粒透视电镜照片见图1。
表1 纳米粒理化性质(±s,n=3)

表1 纳米粒理化性质(±s,n=3)
项目包封率(%)载药量(%)粒径(nm)电位(mV)PLGA纳米粒92.5±2.3523.12±1.45128.4±4.2-21.1±2.5

图1 黄芩素PLGA纳米粒透射电镜照片
3.2 纳米粒体外释放实验体外释放结果见图2。结果显示,药物溶液迅速从透析袋中释放出来,24 h内释放达(97.78±3.15)%。纳米粒初期存在突释现象,在第1天内释放了(8.37±0.31)%,第2天至第10天纳米粒稳定释放,释放量达(51.30±0.50)%。纳米粒较溶液具有明显的缓释特征。
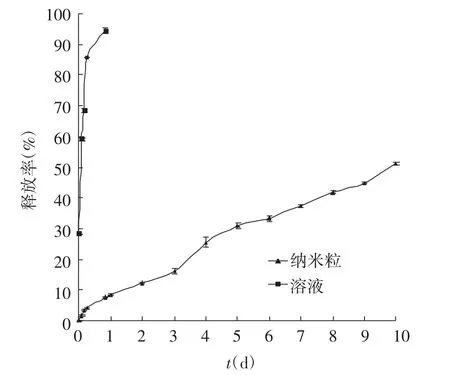
图2 药物溶液与载药PLGA纳米粒的体外释药曲线(n=6)
3.3 香豆素-6 PLGA纳米粒眼部滞留性研究香豆素-6 PLGA纳米粒组的眼部滞留时间为(240± 30)min,香豆素-6溶液组的眼部滞留时间则为(45±15)min。PLGA纳米粒的眼部滞留时间较溶液剂增加了5.3倍,显著延长了药物在眼部的滞留时间。
3.4 纳米粒细胞毒性实验见表2。
表2 培养24 h后细胞增殖情况(±s,n=6)
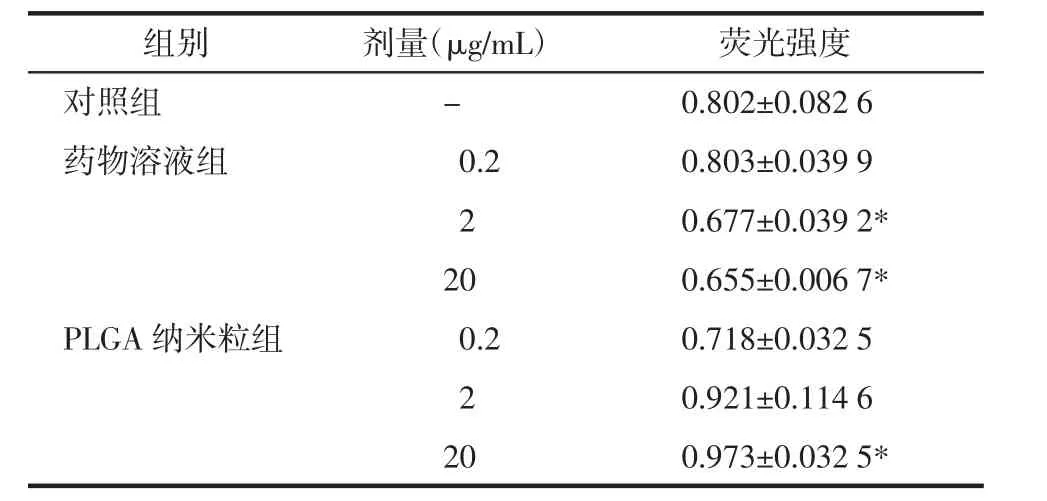
表2 培养24 h后细胞增殖情况(±s,n=6)
注:与对照组比较,*P<0.05。
组别剂量(μg/mL)荧光强度对照组-0.802±0.082 6药物溶液组0.20.803±0.039 9 2 0.677±0.039 2* 200.655±0.006 7* PLGA纳米粒组0.20.718±0.032 5 2 0.921±0.114 6 200.973±0.032 5*
由表2结果显示,与对照组相比,溶液低浓度组(0.2 μg/mL)平均细胞活性无统计学差异(P>0.05),溶液高浓度组(20 μg/mL)、中浓度组(2 μg/mL)平均细胞活性下降,其差异具有统计学意义(P<0.05)。纳米粒低、中浓度组较对照组平均细胞活性无统计学差异(P>0.05),纳米粒高浓度组较对照组平均细胞活性增强,其差异具有统计学意义(P<0.05)。纳米粒明显提高了细胞对药物溶液的耐受性,具有促进细胞增殖的作用。
4 讨论
在体外释放实验中,黄芩素PLGA纳米粒在37℃、pH 6.8的PBS溶液中的释放具明显规律性,黄芩素从纳米粒中的释放可分为两个阶段,各阶段释放行为明显。第一阶段为突释阶段[11],主要由吸附在纳米粒表面黄芩素快速释放造成;第二阶段为缓释阶段[12-13],由于构成纳米粒的PLGA缓慢降解,释放介质逐渐扩散至纳米粒内部,药物溶解缓慢释放出来。该阶段药物释放时间取决于PLGA的降解速度,因PLGA在无酶条件下降解缓慢,体外持续很长时间。10 d释放量为(51.30±0.50)%,适合长效给药。
细胞毒性实验结果显示了黄芩素PLGA纳米粒具有良好的细胞相容性,将药物制备成PLGA纳米粒后,细胞对药物浓度的耐受性提高,提示该制剂类型对于提高局部药物浓度的局部给药研究具重要意义[14-15]。
本研究初步考察了PLGA纳米粒的体外释放及细胞相容性情况,实验结果显示本实验制备的黄芩素PLGA纳米粒能够显著延长药物释放时间,控制药物平稳释放,可以到达临床长效给药目的。后期还需开展制剂体内外相关性研究。
[1]华晓东,巩媛媛,芮菁,等.黄芩素对皮肤过敏治疗作用的实验研究[J].天津中医药,2007,23(3):241-244.
[2]Rice-Evans C.Flavonoid antioxidants[J].Curr Med Chem, 2001,8(7):797-807.
[3]Lee MJ,Wang CJ,Tsai YY,et al.Inhitory effect of 12-Otetradecanoyphorbol-13-acetate-caused tumor promotion in benzopyrene-initiated CD-1 mouse skin by baicalein[J]. Nutr Cancer,1999,34(2):185-191.
[4]Mundargi RC,Babu VR,Rangaswamy V,et al.Nano/microtechnologies for delivering macromolecular therapeutics usingpoly(D,-lactide-co-glycolide)and its derivatives[J].J Contr Rel,2008,125(3):193-209.
[5]李琳,赵海南,李佳玮,等.盐酸小檗碱离子型眼用原位凝胶的研究[J].天津中医药大学学报,2011,30(4):229-231.
[6]陈国广,周本谦,李学明,等.5-氟尿嘧啶PLGA纳米粒的制备及其体内外释药研究[J].中国药科大学学报,2006,37(5):423-427.
[7]田鹏程,王军.阿昔洛韦壳聚糖滴眼液的制备及眼部滞留性考察[J].广东药学院学报,2013,29(3):225-228.
[8]李想.基于提高药物角膜透过性的布洛芬眼部传递系统的设计与评价[D].沈阳:沈阳药科大学,2009.
[9]Susi B,Patri Zia C,Daniela M,et al.Cytotoxiclty of potential ocular Toxilollett,permeation enhancers evaluated on rabbit and human corneal epithelial cellines[J].Toxicollett,2001, 122(1):1-8.
[10]Ying XY,Cui D,Yu L,et al.Solid lipid nanopartides modified with chitosan oligosaccharides for the controlled release of doxorubicin[J].Carbohydrate Polymers,2001,84:1357-1364.
[11]Fu K,Harrell R,Zinski,et al.A potential approach for decreasingbursteffectofproteinfrom PLGA microspheres[J]. J Pharmaceut Sci,2003,92(8):1582-1591.
[12]Li Y,Ogris M,Pelisek J,et al.Stability and release characteristics of poly(D,L-lactide-co-glycolide)encapsulated CaPi-DNA coprecipitation[J].Int J Pharmaceut,2004,269 (1):61-70.
[13]Ho ML,Fu YC,Wang GJ,et al.Controlled release carrier of BSA made by W/O/W emulsion method containing PLGA and hydroxyapatite[J].J Contr Rel,2008,128(2):142-148.
[14]曹建军,李源,程龙,等.装载肝素PLGA纳米粒的制备及体外细胞相容性研究[J].华中科技大学学报,2012,41(5):541-544.
[15]饶卫兵,郝存江,魏丽,等.薄膜超声分散法制备川芎嗪固体脂质钠米粒[J].天津中医药,2009,26(6):503-505.
In vitro evaluation and cellular biocompatibility of Scutellarein-loaded PLGA nanoparticle
LI Nan1,LIU Zhi-dong1,FAN Li-li1,LI Lin1,WANG Ai-chao1,GUO Li-li1,PAN Wei-san2
(1.Tianjin State Key Laboratory of Modern Chinese Medicine,Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique,Tianjin Univesity of TCM,Tianjin 300193,China;2.Shenyang Phanmaceatieal University,Shenyang 110016,China)
[Objective]To prepare Scutellarein loaded PLGA nanoparticles and characterize the physicochemical properties,in vitro release behavior and biocompatibility of HCEpic cells.[Methods]The PLGA nanoparticles were prepared by emulsion solvent diffusion method.The characterization and release effect of PLGA NPs in vitro were evaluated.The main outcome measures included size,Zeta potential,Encapsulation efficiency,the drug content of the final nanoparticles etc.The in vitro release curve was drawn.The cytotoxicity of PLGA NPs were evaluated by cell proliferation assay.[Results]The particle sizes,Zeta potential,Encapsulation efficiency and the drug content of the final nanoparticles were 128.4 nm,-21.1 mV,(92.5±2.35)%and(23.12±1.45)%,respectively.The release of Scutellarein from PLGA nanoparticles were markedly reduced compared with Scutellarein solution.Cell proliferation assay revealed the PLGA-NPs did not damage the cell growth in vitro,indicating a good compatibility.[Conclusion] The PLGA-NPs prepared by emulsion solvent diffusion method have a good release effect and good biocompatibility in vitro.
controlled release;PLGA nanoparticles;Scutellarein;biocompatibility
10.11656/j.issn.1673-9043.2014.01.10
R285.5
A
1673-9043(2014)01-0028-04
2013-09-20)
重大新药创制-现代中药发现和评价技术平台建设项目(2012ZX09304007);教育部新世纪优秀人才支持计划(NCET-12-1068);天津市自然科学基金项目(12JCYBJC18700)。
李楠(1982-),女,博士,从事中药制剂方向的研究。通讯作者:潘卫三,E-mail:ppwwss@163.com。
