银屑片治疗小鼠银屑病的实验研究
2014-04-12韩姗姗党翔吉牛倩倩陈梦钰焦海胜
韩姗姗, 李 辉, 党翔吉, 牛倩倩, 陈梦钰, 焦海胜
(1.兰州大学药学院, 甘肃 兰州 730000; 2.兰州大学第二医院药学部, 甘肃 兰州 730030)
银屑片治疗小鼠银屑病的实验研究
韩姗姗1, 李 辉1, 党翔吉1, 牛倩倩1, 陈梦钰1, 焦海胜2*
(1.兰州大学药学院, 甘肃 兰州 730000; 2.兰州大学第二医院药学部, 甘肃 兰州 730030)
目的 考察银屑片 (萆薢、 当归、 红花、 栀子等) 对银屑病样小鼠模型的治疗作用。 方法 采用咪喹莫特诱导的小鼠银屑病样模型及鼠尾鳞片颗粒层模型,观察银屑片对皮损形态学变化及对表皮颗粒层形成的影响。结果 咪喹莫特模型组小鼠皮肤出现红斑、鳞屑、皮肤增厚现象,皮损组织表现为棘层增厚、角化不全。与模型组相比,银屑片各剂量组小鼠银屑病样皮损症状减轻, 银屑病皮损面积和疾病严重程度 (PASI) 评分降低, 角化不全和表皮增厚现象得到改善, 增殖细胞核抗原 (PCNA) 的表达有所降低。 与正常对照组相比, 银屑片各剂量组对小鼠鼠尾鳞片颗粒层的形成有促进作用。结论 银屑片对上述小鼠银屑病模型具有一定的治疗作用。
银屑片;银屑病;小鼠
银屑病是一种常见且易复发的慢性炎症性皮肤病,也是一种多基因遗传背景下发生的由T细胞介导的免疫性疾病[1-3]。 银屑病 的基本 病理特点为表皮细胞过度 增 殖 和角化不全。 咪 喹 莫特 ( imiquimod, IMQ) 是 Toll样受体 ( Toll-like receptor,TLR) -7/8 的免疫激活剂[4], 可诱导小鼠出现银屑病样皮损症状和 组织学 改变[5-8]。 成 年小鼠尾部鳞片表皮呈不全角化,类似银屑病角化不全病理生理改变。银屑片由萆薢、当归、红花、栀子等中药制成,具有泻火除烦、清热凉血、活血驱风等功能, 临床用于银屑病的治疗取得满意疗效[9-10]。 本实验采用咪喹莫特诱导的小鼠皮肤银屑病样皮损模型和鼠尾鳞片颗粒层模型,观察银屑片的疗效,为其临床应用提供实验依据。
1 材料
1.1 实验动物 昆明种小鼠, 体质量 (20 ± 2) g, 由兰州大学动物实验中心提供,合格证书号:SCXK(甘) 200806。
1.2 药品与试剂 银屑片 (兰州大学第二医院制剂室, 批号 20130426); 雷公藤多苷片 (安徽新陇海药业有限公司产品, 批号 130201);5%咪喹莫特乳膏 (湖北科益药业股份有限公司产品, 批号130303); 兔抗增殖细胞核抗原 (PCNA) 多克隆抗体 (武汉三鹰生物技术有限公司); 兔超敏二步法免疫组化检测试剂盒 SP-9001 (北京中杉金乔生物技术有限公司)。
1.3 实验仪器 GTZA型精密电子天平;BX-50 奥林巴斯显微镜;切片机;自动封闭式组织脱水机;包埋机;病理组织漂烘机。
2 方法与分组
2.1 咪喹莫特模型分组 取 48 只昆明种小鼠背部除毛后单笼饲养。随机分为6组,即正常对照组,模型组,银屑片高、中、低剂量组和雷公藤多苷阳性药物对照组。 各组小鼠 (除正常对照组) 背部每日涂抹 5%咪喹莫特乳膏 42 mg, 同时灌胃给药,每天2次,连续8 d: 正常对照组与模型组给予等容积生理盐水;中剂量的选择按照不同种属动物间等效剂量的直接折算公式计算,高、中、低剂量选择4 ∶2 ∶1 的比例, 则银屑片高、 中、 低剂量组分别给予银屑片溶液 0.68 g生药/(kg·d)、 0.34 g生药/(kg·d)、 0.17 g生药/(kg·d); 雷公藤多苷片 组给予雷公藤 多苷片 溶液 0.094 g生药/(kg·d)。
2.2 鼠尾鳞片颗粒层模型分组 正常小鼠尾部鳞片表皮天然缺少颗粒层,类似人类银屑病表皮分化障碍的病理改变,故采用此模型来评价药物促进颗粒层形成的作用。 取昆明种小鼠 40 只, 随机分为5组,分别为正常对照组,银屑片高、中、低剂量组,雷公藤多苷片组,每组8只。正常对照组给予等容积生理盐水,银屑片高、中、低剂量组分别给药 0.68 g生药/(kg·d)、 0.34 g生药/(kg·d)、0.17 g生药/(kg·d),雷公藤多苷片组 0.094 g生药/(kg·d)。 每天 2 次, 连续灌胃 21 d。
3 检测指标与方法
3.1 咪喹莫特模型检测指标[11]
3.1.1 小鼠银屑病样皮损面积和疾病严重程度(psoriasis area and severity index, PASI) 评分[5-6]观察各组小鼠每天的皮损变化情况, 依据 PASI评分标准 给 予 小 鼠 皮 损 处 红 斑 ( erythema) 、 鳞 屑(scales)和浸润增厚程度 ( thickness) 0 ~4 的积分:0, 无;1, 轻度;2, 中度;3,重度;4, 极重度。 将三者积分相加得到总积分 (0 ~12), 对各组小鼠积分取平均值后绘制趋势线。
3.1.2 小鼠背部皮损病理学改变 采用苏木精-伊红 (HE) 染色观察。剪取各组小鼠背部皮损皮肤固定于4%多聚甲醛, 经脱水、 石蜡包埋、 切片、HE染色后观察皮肤病理学改变, 并测量表皮厚度。
3.1.3 小鼠背部皮损 PCNA的表达 剪取各组小鼠背部皮损皮肤,进行包埋,石蜡切片经抗原热修复、 抗体孵育、 DAB显色、 苏木精复染, 同步设立阴性对照。
3.2 鼠尾鳞片颗粒层模型检测指标
3.2.1 鼠尾鳞片颗粒层形成情况 末次给药 24 h后处死小鼠, 在距尾根部约 2 cm处取背面皮肤一长条 (1.5 cm×0.2 cm), 4%多聚甲醛固定, 石蜡包埋,切片,HE染色。光镜下观察鼠尾鳞片颗粒层形成, 计数连续100 个鳞片中有颗粒层的鳞片数,并对各组数据进行统计学处理。
4 统计学处理
采用 SPSS 17.0 统计分析软件, 实验数据均以均数±标准差 (), 组间比较采用单因素方差分析方法, 以 P<0.05 为差异有统计学意义。
5 结果
5.1 咪喹莫特诱导的小鼠银屑病样动物模型皮损的形态学变化 图1可见,与正常对照组相比,咪喹莫特模型组在咪喹莫特涂抹1~2 d后皮肤即出现红斑、 鳞屑及皮肤增厚现象,皮损症状在7~8 d最为严重,呈典型的银屑病样改变。随着时间延长,模型组皮损日益严重:红斑由少量淡粉色斑点变为大面积深红偏棕褐色斑块;鳞屑由琐碎状增多增厚,过渡至布满裸露皮肤的层状鳞屑;皮肤逐渐褶皱、隆起,增厚浸润明显。银屑片高、中、低剂量组和雷公藤多苷组皮损症状与模型组相比明显减轻,鳞屑较少,红斑量少且色浅,增厚浸润程度较轻。
5.2 银屑片对咪喹莫特诱导的小鼠银屑病样动物模型皮损的病理学变化的影响 HE染色显示:正常对照组小鼠皮肤可见菲薄的角质层、颗粒层、棘细胞层;咪喹莫特模型组小鼠皮肤过度角化、角化不全、棘层肥厚;银屑片高、中、低剂量组小鼠皮肤角化过度减轻、棘层变薄,表皮层厚度明显低于模型组, 见图2。 通过测量表皮层厚度发现: 模型组小鼠表皮层增厚明显,银屑片组表皮层增厚程度低,与模型组比较有显著差异 (P<0.05), 见表1。
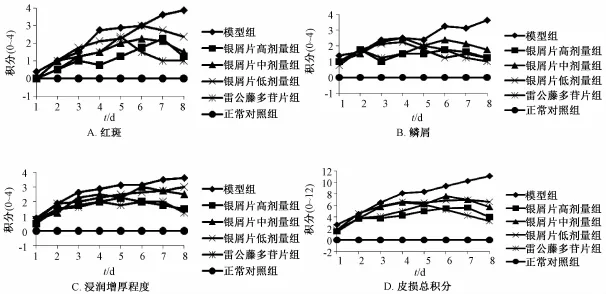
图1 各组小鼠皮损积分趋势Fig.1 PASI scores of mouse skin lesions induced by im iquimod
表1 各组小鼠治疗8 d皮损处表皮层厚度的比较 (,n=8)Tab.1 Com parison of epiderm is thickness in skin lesions at day 8 of treatment(, n=8)
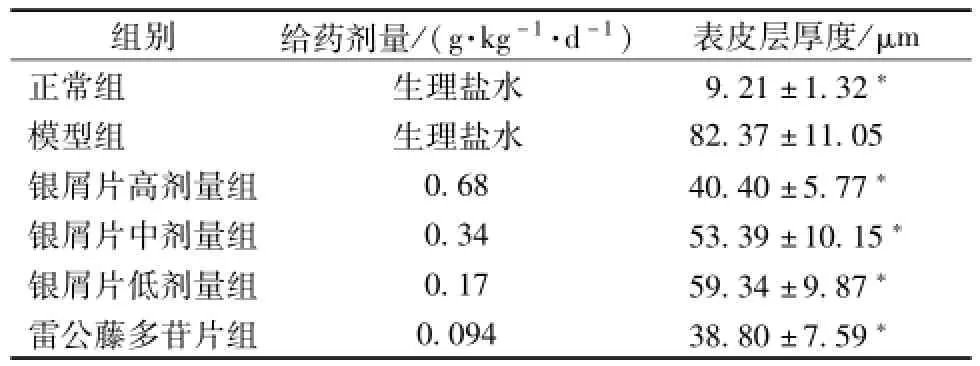
表1 各组小鼠治疗8 d皮损处表皮层厚度的比较 (,n=8)Tab.1 Com parison of epiderm is thickness in skin lesions at day 8 of treatment(, n=8)
注: 与模型组比较,*P<0.05
组别 给药 剂量 /( g·kg-1·d-1) 表 皮层厚 度 /μm正常组 生理盐水 9.21 ±1.32*模型组 生理盐水 82.37 ±11.05银屑片高剂量组 0.68 40.40 ±5.77*银屑片中剂量组 0.34 53.39 ±10.15*银屑片低剂量组 0.17 59.34 ±9.87*雷公藤多苷片组 0.094 38.80 ±7.59*
5.3 银屑片对咪喹莫特诱导的小鼠银屑病样动物模型皮损 PCNA的表达的影响 正常对照组小鼠PCNA阳性表达仅限于表皮基底层, 呈线状排列;咪喹莫特模型组阳性细胞不仅局限于基底层,表皮中下层也有表达,着色细胞层数和数量明显增多;银屑片高、中、低剂量组着色细胞层数较模型组少,见图3。 经统计学分析, 与模型组比较银屑片组 PCNA表达显著降低 (P<0.05), 见表 2。

图 3 各组小鼠治疗 8 d皮损处 PCNA的表达 ( ×400)Fig.3 PCNA expression of skin lesions at day 8 of treatment( imm unohistochem ical staining, ×400)
表2 各组小鼠治疗8 d皮损处 PCNA的表达 (, n=8)Tab.2 Expression of PCNA in skin lesions at day 8 of treatment(, n=8)
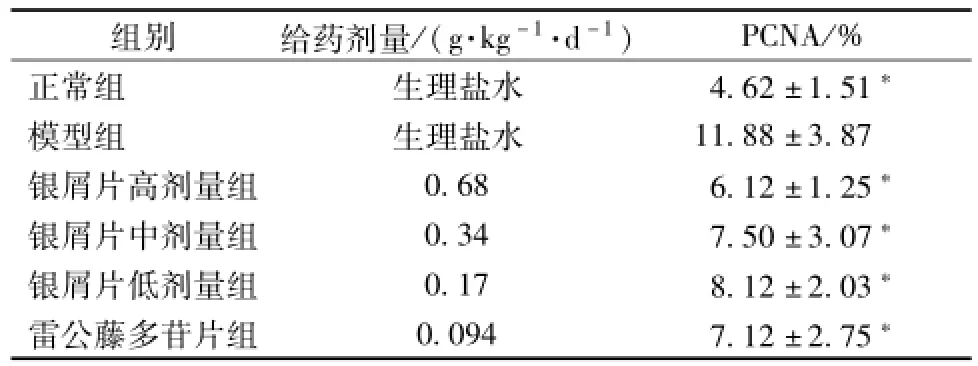
表2 各组小鼠治疗8 d皮损处 PCNA的表达 (, n=8)Tab.2 Expression of PCNA in skin lesions at day 8 of treatment(, n=8)
注: 与模型组比较,*P<0.05
组别 给药 剂量 /( g·kg-1·d-1) PCNA/%正常组 生理盐水 4.62 ±1.51*模型组 生理盐水 11.88 ±3.87银屑片高剂量组 0.68 6.12 ±1.25*银屑片中剂量组 0.34 7.50 ±3.07*银屑片低剂量组 0.17 8.12 ±2.03*雷公藤多苷片组 0.094 7.12 ±2.75*
5.4 银屑片对鼠尾鳞片颗粒层形成的影响 结果表明,正常对照组缺乏或仅有少量的颗粒层,银屑片高、中、低剂量组和雷公藤多苷片组颗粒层细胞均有不同程度的增加,促进表皮正常分化。与对照组相比,银屑片高、中、低剂量组均可显著促进鼠尾鳞片表皮颗粒层的形成 (P<0.05), 且有良好的量效关系,见表3。
表3 各组小鼠鼠尾鳞片表皮颗粒层的形成 (, n=8)Tab.3 Formation of granular layer in scale ep iderm is of m ice tails(, n=8)
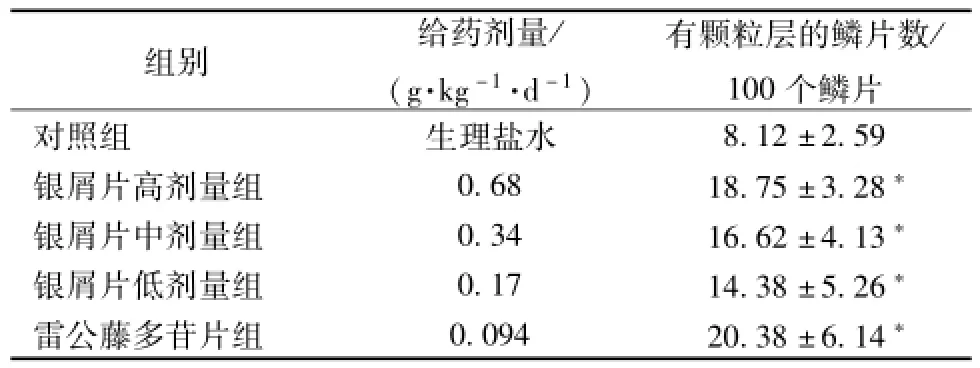
表3 各组小鼠鼠尾鳞片表皮颗粒层的形成 (, n=8)Tab.3 Formation of granular layer in scale ep iderm is of m ice tails(, n=8)
注: 与对照组比较,*P<0.05
个鳞片对照组 生理盐水组别 给药剂量/( g·kg-1·d-1)有颗粒层的鳞片数/ 100 8.12 ±2.59银屑片高剂量组 0.68 18.75 ±3.28*银屑片中剂量组 0.34 16.62 ±4.13*银屑片低剂量组 0.17 14.38 ±5.26*雷公藤多苷片组 0.094 20.38 ±6.14*
6 讨论
咪喹莫特是 Toll样受体激动剂。 近年临床应用时发现在咪喹莫特外用治疗已控制良好的银屑病患者合并的日光性角化病及基底细胞癌时,可诱导或加重原有 银屑 病 病 情[12-14]。 研究 进 一 步发 现 咪 喹莫特外用于小鼠皮肤可诱导出典型银屑样炎症[5-8]。 鼠尾鳞片因 表皮正 常角化缺乏颗粒层, 为自然角化异常,类似银屑病角化不全病理生理改变。 Jarrett[15]和 Spearman 等[16]最早提出利用鼠尾鳞片表皮天然的角化形式模拟银屑病表皮角化不全的特点。这两种动物模型模拟了人类银屑病的某些病理生理学改变,可应用于抗银屑病药物的筛选。
咪喹莫特诱导的小鼠银屑病样动物模型有时间窗的限制,可认为前8 d为疾病的发生、发展阶段[17]。咪喹莫特模型组小鼠在涂药 2 d 后即出现淡红色斑点、片状鳞屑和皮肤褶皱浸润现象。随着药物作用,红斑增多且颜色变深,鳞片堆积渐成层,皮肤浸润增厚, 皮损症状在7~8 d最为严重。结果表明银屑片能使咪喹莫特诱导的小鼠银屑病样皮损症状得到明显缓解, PASI评分显著降低, 组织形态变化趋于正常, 降低皮损中 PCNA的表达水平。并能显著促进鼠尾鳞片表皮颗粒层的形成,改善角化不全症状。因此研究认为银屑片对于银屑病症状有很好的改善作用。此研究为临床使用银屑片治疗银屑病提供理论依据,而在治疗银屑病过程中银屑片干预作用的靶点和通路将是今后继续研究的方向和重点。
[ 1 ] Mrowietz U, Reich K.Psoriasi-new insights into pathogenesis and treatment[J] .Deutsches Arzteblatt Inter, 2009, 106(1/2) : 11.
[ 2 ] Flatz L, Conrad C.Role of T-cell-mediated inflammation in psoriasis:pathogenesis and targeted therapy[ J] .Psoriasis: Targets Therapy, 2013 , 3:1-10.
[ 3 ] Cai Y, Fleming C, Yan J.New insights of T cells in the pathogenesis of psoriasis[ J] .CellMole Immunol, 2012, 9(4) :302-309.
[ 4 ] Lowes M A, Russell C B, Martin D A, et al.The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses[ J] .Trends Immunol, 2013, 34(4):174-181.
[ 5 ] van der Fits L, Mourits S, Voerman JS A, et al.Imiquimodinduced psoriasis-like skin inflammation in mice ismediated via the IL-23/IL-17 axis[ J] .J Immunol, 2009, 182 ( 9 ) : 5836-5845.
[ 6 ] Baek JO, Byamba D, Wu W H, et al.Assessment of an imiquimod-induced psoriatic mouse model in relation to oxidative stress[ J] .Arch Dermatol Res, 2012, 304(9) :699-706.
[ 7 ] Van Belle A B, de Heusch M, Lemaire M M, et al.IL-22 is required for imiquimod-induced psoriasiform skin inflammation in mice[ J].J Immunol, 2012, 188(1) :462-469.
[ 8 ] 赖奇伟.咪喹莫特诱发银屑病的机制研究新进展[J].中国当代医药, 2013, 20(20):25-27.
[9] 唐富山, 焦海胜, 邱 雯, 等.银屑片质量标准的研究[ J] .中成药, 2005, 27(3) :285-288.
[10] 王 翼, 焦海胜, 邱雯.正交设计优选银屑片的提取工艺[ J] .中国药师, 2006, 9(10) :920-922.
[11] 底婷婷, 赵京霞, 王 燕, 等.凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损的干预作用[J].中国病理生理杂志, 2012, 28(4):718-722.
[12] Rajan N, Langtry JA A.Generalized exacerbation of psoriasis associated with imiquimod cream treatment of superficial basal cell carcinomas[ J] .Clin Exp Dermatol, 2006, 31 ( 1 ) : 140-141.
[13] Fanti P A, Dika E, Vaccari S, et al.Generalized psoriasis induced by topical treatment of actinic keratosis with imiquimod[ J] .Inter JDermatol, 2006, 45(12) :1464-1465.
[14] Patel U, Mark NM, Machler BC, etal.Imiquimod 5%cream induced psoriasis:a case report, summary of the literature and mechanism[ J] .British JDermatol, 2011, 164(3) :670-672.
[15] Jarrett A.The physiology and pathophysiology of the skin[ J],London:Academic Press, 1973:123.
[16] Spearman R I C, Jarrett A.Biological comparison of isomers and chemical formsof vitamin A(retinol) [ J] .British JDermatol, 1974, 90(5) :553-560.
[17] 赵京霞, 底婷婷, 王 燕, 等.IL-23/IL-17 炎症轴在咪喹莫特诱导的小鼠银屑病样皮肤损害中的作用[J].中国病理生理杂志, 2013, 29(6):1086-1094.
Effects of Yinxie Tablets on m ice w ith psoriasis
HAN Shan-shan1, LIHui1, DANG Xiang-ji1, NIUQian-qian1, CHEN Meng-yu1, JIAOHai-sheng2*
(1.College of Pharmacy, Lanzhou University, Lanzhou730000, China;2.Maternity Department, The Second Hospital of Lanzhou University, Lanzhou 730000, China)
AIM To evaluate the effects of Yinxie Tablets( Angelicae sinensis Radix, Carthami Flos, Cardeniae Fructus, etc.) on mice models for psoriasis.METHODS Imiquimod-induced psoriasis-like skin inflammation and the formation of scale epidermis granular layer inmouse tailwere used to study the therapeutic effects of Yinxie Tablets.RESULTS Compared with the model group, the cutaneous symptoms in Yinxie Tablets groups were alleviated, with psoriasis area and severity index( PASI) scores decreased, epidermal parakeratosis and epidermal over-proliferation relieved, the expression of PCNA decreased.Compared with the normal group, the formation of scale epidermis granular layer inmouse tail in Yinxie Tablets groupswaspromoted.CONCLUSION Yinxie Tablets exhibit beneficial therapeutic effects on both psoriasismodels.
Yinxie Tablets;psoriasis;mice
R285.5
:A
1001-1528(2014)12-2463-04
10.3969/j.issn.1001-1528.2014.12.004
2013-11-24
韩姗姗 (1989—), 女, 硕士生, 从事临床药学研究工作。 Tel: (0931) 8942753
*通信作者: 焦 海胜 (1962 —) , 男, 教 授, 硕 士生导 师, 主要 从事 新剂 型和临 床药 学研究 工 作。 Tel: ( 0931 ) 8942571 , E-mail: ldeyjhs@sohu.com
