不同产地美花石斛内生细菌分离及促生潜力比较
2014-04-09童文君薛庆云侯北伟丁小余
童文君, 张 礼, 薛庆云, 侯北伟, 丁小余
(南京师范大学生命科学学院, 江苏 南京 210023)
在植物的健康组织或器官内存在大量微生物,在不引起植物病变的同时这些微生物能与植物建立良好的相互合作关系,Petrini将这种在其生活史中某个阶段或全部阶段不会引起植物组织或器官明显变化的细菌称为植物内生细菌(endophyte bacteria)[1]。兰科(Orchidaceae)植物与内生细菌存在着复杂的微生态关系,细菌可通过气孔、皮孔及伤口等开放性结构进入植物组织,然后在植物组织间隙或细胞间质形成具有生态功能的群落,同时植物组织也可保护内生细菌免受紫外线或干燥等其他有害环境的伤害,从而保障内生细菌生存[2]。至今,已从90多种兰科植物中分离出大量内生细菌,这些内生细菌对兰科植物具有重要的生物学功能,如解磷、解钾、分泌IAA、促进植物生长及抗植物病原菌等[3]。
石斛属(DendrobiumSw.)为兰科第2大属, 包括 1 400多个种,主要分布于亚洲热带和亚热带地区、太平洋岛屿以及大洋洲[4]。目前中国已记载石斛属植物81种2变种,其中18种为中国特有种[5]。近年来有关石斛属内生细菌的研究已有报道,表明有些内生细菌菌株能直接促进石斛属植物的生长。俞婕等[6]从铁皮石斛(DendrobiumofficinaleKimura et Migo)中分离到1株内生细菌SH1,将其发酵原液接种于铁皮石斛组培苗的基部,其组培苗的生长速率明显提高;Tsavkelova 等[7]从杓唇石斛〔Dendrobiummoschatum(Buch.-Ham.) Sw.〕气生根内分离出大量可进行光合作用且为宿主提供氮素营养的内生细菌。因而,研究石斛内生细菌可为石斛生长和产量的提高等提供理论依据和技术支持。
美花石斛(DendrobiumloddigesiiRolfe)又名环草石斛、小环草和小黄草等,主要分布在广西、广东、贵州和云南等地,具有滋阴清热、生津益胃、润肺止咳等功效[8]。近年来,随着市场需求的增加价格上涨,美花石斛被大量采挖,其野生资源遭到极大破坏。由于美花石斛在自然状态下生长周期长、繁殖系数低,所以近年来主要采用组织培养技术实现其大量繁殖,但其组培苗移栽成活率低以及生长缓慢仍是阻碍美花石斛产业化的主要问题。朱国胜等[9]的研究结果表明:美花石斛生长缓慢主要是因为缺乏共生菌根真菌。但有关美花石斛内生细菌与其生长的关系鲜见研究。
作者以采自广西、云南和广东的美花石斛为研究对象,对其根、茎和叶中的可培养内生细菌进行分离,剔除重复菌株并通过16SrDNA序列测定和比对鉴定分离出的菌株,同时利用扩增核糖体DNA限制性酶切分析(amplified ribosomal DNA restriction analysis, ARDRA)方法对内生细菌菌株的多样性进行分析[10-11],并测定所有分离菌株的促生相关特性(包括解磷、解钾和产生长素IAA能力);在此基础上,以既能解磷、解钾又能产生长素的菌株作为促生实验菌株,研究这些菌株对美花石斛试管苗的促生效应。以期为寻找与美花石斛生长相关的内生细菌、改善其人工生长环境提供平台,并为美花石斛人工培育产业研发奠定理论和应用基础。
1 材料和方法
1.1 材料
1.1.1 植物采集及组培 供试的野生美花石斛植株于2011年至2012年采自广西、云南和广东,样株编号分别为GX20120601—GX20120603、YN20111201—YN20111203和GD20111101—GD20111105,合计11株,均由南京师范大学生命科学学院丁小余教授鉴定,活体植株保存于南京师范大学生命科学学院植物资源与环境研究所。美花石斛试管苗由本课题组培养,培养条件为温度21 ℃~25 ℃、光照度1 500 lx、光照时间12 h·d-1、空气相对湿度60%~80%。
1.1.2 美花石斛内生细菌的分离、保存和活化 从11株美花石斛的根、茎和叶上分别取质量相等的样品,共33份;称取质量后用体积分数2.5% NaClO溶液浸泡10 min,并用无菌水淋洗3次(取最后1次淋洗液0.1 mL均匀涂于NA培养基[12]上,若48 h后无菌落出现则可确认表面消毒干净);将表面消毒后的植物样品置于灭菌研钵中,加入相当于样品质量9倍的灭菌水并研磨,分别取0.1 mL研磨液涂于NA培养基上,置于28 ℃恒温箱培养1~3 d,待菌落长出后根据菌落的形态进行纯化;常温下用水保存,同时用体积分数40%甘油保存于-80 ℃条件下。每份样品设置3个重复。
所有菌株均用NA培养基活化。挑取常温下用水保存或-80 ℃下用体积分数40%甘油保存的菌株,划线分离培养,于28 ℃培养48 h;挑取单菌落至NA培养液中,于28 ℃、250 r·min-1培养24 h,备用。
1.2 方法
1.2.1 解磷能力测试 吸取待测菌液10 μL,分别滴到有机磷培养基(OPA)和无机磷培养基(NPA)[13]平板上,于28 ℃培养48 h;观察NPA及OPA平板上透明菌圈的有无并测量菌圈半径(cm),每一菌株重复检测3次。
1.2.2 解钾能力测试 参照文献[14]的方法配制含有钾长石的培养基,吸取待测菌液10 μL,滴至钾长石培养基平板上,于28 ℃培养72 h;观察平板上有无形成透明光滑油滴,并统计能形成透明光滑油滴的菌株数量,每一菌株重复检测3次。
1.2.3 产生长素能力测试 用含200 mg·L-1L-色氨酸的NA液体培养基,于28 ℃、180 r·min-1条件下培养菌液48 h;取1 mL菌悬液滴于白色瓷板上,并加1 mL Salkowski比色液[15],对照组仅滴加1 mL比色液;将白色瓷板置于室温条件下避光放置30 min后观察其颜色变化,并记录颜色变化强度,每一菌株重复检测3次。
1.2.4 ARDRA分析 采用CTAB法[16]提取内生细菌DNA,利用细菌通用引物8f和1492r对内生细菌的16SrRNA片段进行扩增[17];用AluI和MspI(MBI Fermentas,Vilnius,Lithuania)2种限制性内切酶对16SrRNA扩增产物进行联合酶切;取酶切后的样品进行电泳,并在UVP凝胶成像系统上进行观察[18]。
利用GelCompar Ⅱ软件分析酶切产物图谱。基于Pearson相关指数的相似性系数、采用UPGMA法(unweighted pair-group method using arithmetic averages)绘制聚类树状图,具体参数如下:optimization(0.66%); position tolerance(1.3%); chance towards end of fingerprint(0%);minimum height(0%);minimum surface(0%);uncertain bands(ignore)。以70.0%相似度为基准对菌株进行聚类分析;从菌株活化到酶切,对5个菌株进行重复,5个菌株相似度均大于70.0%则聚在一簇。
选取各ARDRA簇的代表菌株进行16SrDNA测序,并在NCBI数据库中进行BLAST比对,获得各菌株的分类鉴定结果。
1.2.5 试管苗促生潜力观察 将既能解磷、解钾又能产生长素的菌株接种到200 mL NA液体培养基中,于28 ℃、250 r·min-1条件下培养至对数期,至菌液的OD600值约为1×108CFU·mL-1,用无菌NA培养液稀释100倍备用。
取300株试管苗, 按照 3~4 cm、2~3 cm和1~2 cm株高分为3组,其中,株高3 cm试管苗分至第2组,株高2 cm试管苗分至第3组,每组100株。分别吸取1 mL稀释菌液(1×106CFU·mL-1)添加至试管苗根部,对照组仅添加1 mL NA培养液;每组5个重复。将试管苗置于温度(25±2) ℃、光照度1 500 lx、光照时间12 h·d-1、空气相对湿度60%~80%的条件下培养,每隔10 d观察1次,连续观察2个月,分别记录培养瓶中试管苗的株高和根长变化。
2 结果和分析
2.1 不同产地美花石斛内生细菌分布特征
分离结果显示:从来源于广西、云南及广东3个产地的美花石斛根、茎和叶中分别分离获得内生细菌菌株42、11及14株,共计67株内生细菌菌株。从分离部位看,分离自茎的菌株占总菌株数的51%(34株),数量最多;分离自根的菌株占31%(21株);分离自叶的菌株仅占18%(12株),数量最少。
2.2 美花石斛内生细菌促生特性分析
2.2.1 解磷能力分析 测定结果显示:在分离获得的67株美花石斛内生细菌菌株中,有54株菌株能够在OPA培养基(有机磷培养基)上产生明显的透明菌圈,且菌圈半径为0.3~1.6 cm。按产地划分,其中有40株菌株分离自来源于广西的植株,占74%;有9株菌株分离自来源于云南的植株,占16%;有5株菌株分离自来源于广东的植株,占10%。按分离部位划分,其中有50%(27株)的菌株分离自茎,30%(16株)的菌株分离自根,20%(11株)的菌株分离自叶。
可在NPA培养基(无机磷培养基)上产生明显透明菌圈的有30株菌株。按产地划分,其中90%(27株)分离自来源于广西的植株,3%(1株)分离自来源于云南的植株,7%(2株)分离自来源于广东的植株;按照分离部位划分,其中47%(14株)分离自茎,30%(9株)分离自根,23%(7株)分离自叶。此外,所有能解无机磷的菌株均表现出解有机磷的特性。
2.2.2 解钾能力分析 测定结果显示:在分离获得的67株美花石斛内生细菌菌株中,有22株菌株能形成透明的光滑油滴状菌落,说明这些菌株具有解钾能力。按产地划分,其中68%(15株)分离自来源于广西的植株,22%(5株)分离自来源于云南的植株,10%(2株)分离自来源于广东的植株;按照分离部位划分,其中64%(14株)分离自茎,36%(8株)分离自根,而分离自叶的菌株均无解钾能力。
2.2.3 产生长素能力分析 测定结果显示:在分离获得的67株内生细菌菌株中,有24株菌株可使Salkowski比色液变红,说明这些菌株具有产生长素能力。按照产地划分,其中75%(18株)分离自来源于广西的植株、17%(4株)分离自来源于云南的植株、8%(2株)分离自来源于广东的植株;按照分离部位划分,其中67%(16株)分离自茎,21%(5株)分离自根,12%(3株)分离自叶。
此外,在所有67株菌株中,有8株菌株同时兼具解无机磷、解有机磷、解钾以及产生长素的特性,并且这些菌株均分离自来源于广西的植株茎部。
2.3 美花石斛内生细菌多样性分析
根据ARDRA分析结果,采用UPGMA法对67株内生细菌进行聚类分析,结果见图1。聚类分析结果显示:67株内生细菌共表现出50种不同的ARDRA谱型,根据70.0%的相似度划分,67株菌株被分为31个ARDRA簇(图1)。其中,仅包含1株菌株的ARDRA簇有18个, 而其他13个ARDRA簇则包含2株及2株以上的菌株。按照产地划分,其中分离自广西植株的42株菌株分属于22个ARDRA簇,分离自云南植株的11株菌株分属于5个ARDRA簇,分离自广东植株的14株菌株分属于7个ARDRA簇。最大的ARDRA簇(第12簇)包含3个产地的13株菌株,其中6株分离自茎;第二大簇(第3簇)包含分离自广西植株根、茎和叶的9株菌株,其中5株菌株分离自根。
从31个ARDRA簇中分别选出1个代表性菌株,对其16SrDNA片段序列进行测序,并与NCBI核酸数据库中的序列进行比对,31个ARDRA簇代表性菌株的比对结果及促生特性见表1。结果显示:分离获得的67株内生菌株属于12个属,分别是假单胞菌属(Pseudomonas)、微杆菌属(Microbacterium)、肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)、葡萄球菌属(Staphylococcus)、嗜冷杆菌属(Psychrobacter)、副球菌属(Paracoccus)、泛菌属(Pantoea)、短波单胞菌属(Brevundimonas)、涅斯捷连科氏菌属(Nesterenkonia)和沙雷氏菌属(Serratia)。其中,芽孢杆菌属、微杆菌属和肠杆菌属为美花石斛内生细菌的优势属。芽孢杆菌属在3个产地植株的根、茎和叶中均有分布,肠杆菌属仅在广西植株的根、茎和叶中有分布,鞘氨醇单胞菌属仅分布于广西植株的根中,葡萄球菌属仅分布于广西植株的叶中,嗜冷杆菌属仅分布于广东植株的茎中,副球菌属仅分布于广东植株的根中,涅斯捷连科氏菌属仅分布于云南植株的根和茎中。
2.4 美花石斛内生细菌促生潜力分析
由表1可见:8株兼具3种促生特性的菌株分别隶属于芽孢杆菌属、肠杆菌属和假单胞菌属。因3个产地的植株中均分布有芽孢杆菌属菌株,故将芽孢杆菌菌株DLB20作为促生实验菌株。观察结果显示:当加入1×106CFU·mL-1DLB20后,菌落在培养基上生长缓慢,并逐渐与美花石斛试管苗形成稳定的生长环境。接种10 d后,株高不同的3个实验组的试管苗长势均正常,培养基表面有少许菌落产生。接种30 d后,第3实验组的试管苗根部细菌开始繁殖,植株开始萎蔫发黄;第1与第2实验组的试管苗生长良好,长势没有明显差异。接种60 d后,第3实验组的植株死亡,第1与第2实验组的试管苗长势良好且株高无明显区别,但第1实验组试管苗的生根状况优于第2实验组;3个对照组的试管苗均正常生长,但第1和第2对照组的试管苗长势弱于实验组。3个实验组和3个对照组试管苗的生长状况对比见图2。

图1 美花石斛67株内生细菌的ARDRA指纹图谱及其聚类图
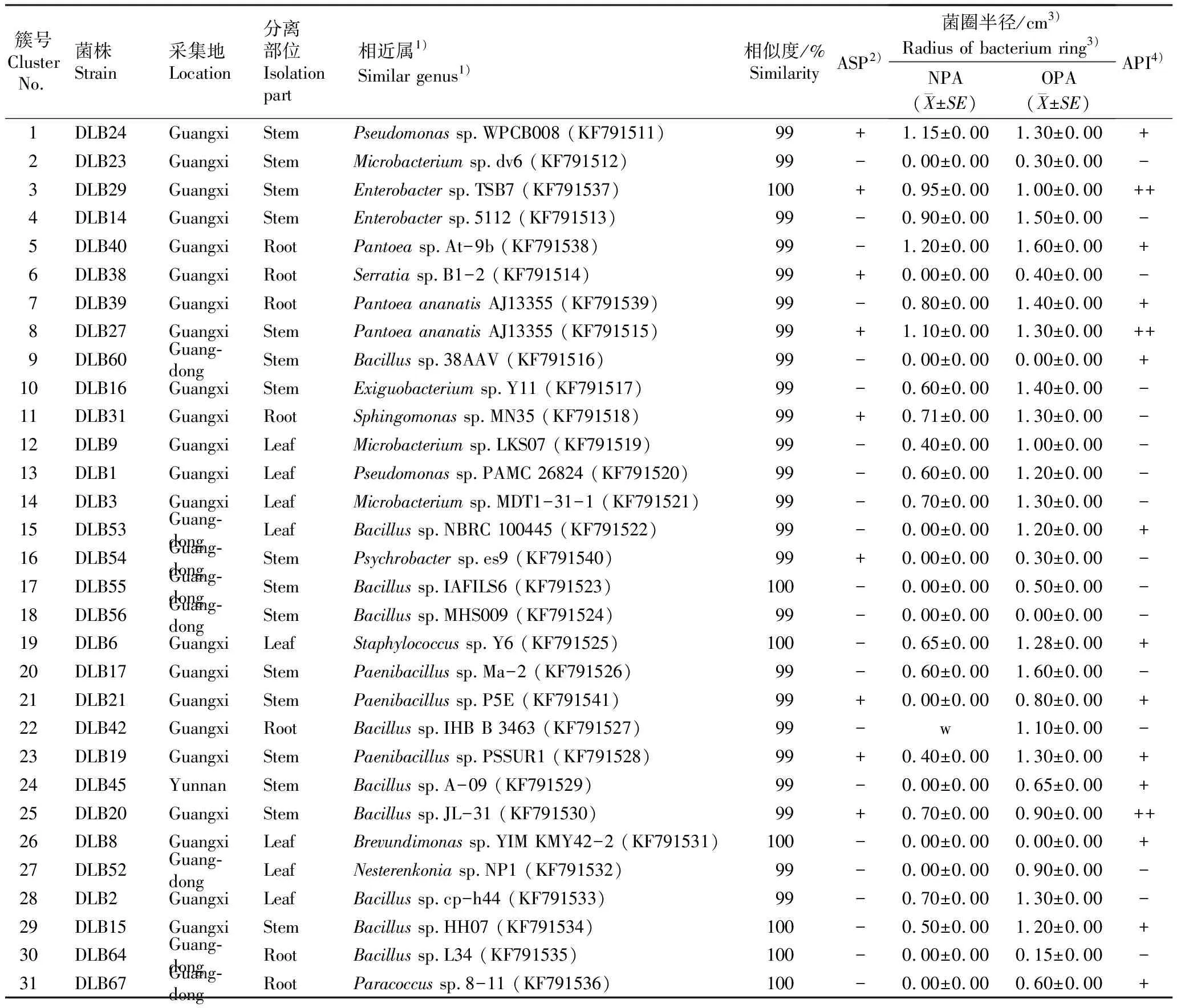
表1 美花石斛内生细菌31个ARDRA簇代表菌株的特征信息
3 讨论和结论
自20世纪80年代末以来,兰科植物的内生细菌日益成为研究热点。兰科植物内生细菌种类非常丰富,在根、茎和叶中均有分布[19],其中根和茎是常见的分离部位。例如,章华伟等[20]从铁皮石斛中分离出23株内生细菌,其中茎中分布较多;Tsavkelova 等[21]的研究结果显示:从杓唇石斛分离内生细菌,根部是常见的分离部位。本实验结果显示:美花石斛茎中所含的内生细菌最多,其次是根,也说明兰科植物的根和茎是常见的分离部位。Chen等[22]的研究结果表明:美花石斛内生真菌随产地差异表现出一定的特异性,本实验结果也显示美花石斛内生细菌与其内生真菌同样具有地区特异性。

1-3. 实验组Experimental group: 1. 株高3~4 cm试管苗 Plantlets with height of 3-4 cm; 2. 株高2~3 cm试管苗 Plantlets with height of 2-3 cm; 3. 株高1~2 cm试管苗 Plantlets with height of 1-2 cm. C1-C3. 对照组Control group: C1. 株高3~4 cm试管苗 Plantlets with height of 3-4 cm; C2. 株高2~3 cm试管苗 Plantlets with height of 2-3 cm; C3. 株高1~2 cm试管苗 Plantlets with height of 1-2 cm.
兰科植物内生细菌优势属是指宿主组织内出现频率较高的属。Wilkinson等[23-25]认为:假单胞菌属是地生兰的优势属,其次是芽孢杆菌属、库特氏菌属(Kurthia)和节杆菌属(Arthrobacter)。在有关的研究中芽孢杆菌也被证实为杓唇石斛[26]和流苏石斛(DendrobiumfimbriatumHook.)[27]内生细菌的优势属。本实验结果显示:美花石斛内生细菌优势属包括芽孢杆菌属、微杆菌属和肠杆菌属,其中芽孢杆菌属在来源于3个产地的植株内均为优势属,肠杆菌属仅存在于来源于广西的美花石斛植株中,且来源于广西的植株中优势属的种类和数量都比来源于云南和广东的植株丰富,与来源于广西的美花石斛样品新鲜程度较佳有关。这一研究结果也证实了Wilkinson 等[24]关于“兰科植物内生细菌优势属会随地区、季节,尤其是基于菌根真菌侵染的组织形态学的不同而发生变化,且不同地区表现出差异性”的结论。
磷和钾都是植物生长必不可少的营养元素,利用解磷和解钾的内生细菌转化环境中的磷和钾是改善植物生长的首选方法之一[28]。生长素IAA可以通过增加根的生长促进植物生长和分化,还可促进根毛增殖和延长,有利于根从土壤中吸收更多的营养物质[29]。通常,促生实验依据内生细菌菌株解磷、解钾、产生长素的能力来衡量其促生潜力,而本实验结果证实具有促生潜力的美花石斛内生细菌菌株可以促进其试管苗的生长。
细菌的浓度是影响促生效果的关键因子,低浓度(1×105CFU·mL-1)具有促生效果,而高浓度则可能对植物有不利影响[30],这可能与“细菌浓度过高会破坏植物或部分组织,从而引起植物生长不良甚至死亡”有关。基于以上原因,作者从能解磷、解钾又能产IAA的8个美花石斛内生细菌菌株中选择用于促生实验的菌株,考虑到芽孢杆菌属是美花石斛内生细菌中分布最广泛的优势属,所以将芽孢杆菌DLB20菌株选为测试菌株。实验结果表明:1×106CFU·mL-1DLB20可以促进株高3~4 cm的美花石斛试管苗生长及生根,但导致株高1~2 cm试管苗死亡,表明植物内生细菌的促生效果与细菌的接种浓度和植株长势有关。Aspray等[31]认为:细菌仅在一定浓度范围内具有促生作用,不同细菌的促生浓度范围存在差异。因此,确定内生细菌的适宜接种浓度对有效提高其促生效果有重要作用[32]。此外,Frey-Klett等[30]认为:兰科植物在不同的生长阶段可能与不同的菌株共生。因此,从成年植株根内分离的菌株对兰科植物不同生长阶段植株的促生作用有差异。
由于内生细菌的数量及种类与植物的产地密切相关,因而,建议扩大采样数量和采样地点对美花石斛内生细菌进行更为广泛的分离和筛选。有关美花石斛内生细菌种类还需要采用分子生物学手段和生理生化实验进一步鉴定。
参考文献:
[1] PETRINI O. Fungal endophytes of tree leaves[M]∥ANDREWS J H, HIRANO S S. Microbial Ecology of Leaves. New York: Springer-Verlag, 1991: 179-197.
[2] LODEWYCKX C, VANGRONSVELD J, PORTEOUS F, et al. En-dophytic bacteria and their potential applications[J]. Critical Reviews in Plant Sciences, 2002, 21(6): 583-606.
[3] 胡 萌. 植物内生细菌研究进展[J]. 山东农业大学学报: 自然科学版, 2008, 39(1): 148-151.
[4] LAVARACK P S, HARRIS W, STOCKER G.Dendrobiumand Its Relatives[M]. Portland: Timber Press, 2000.
[5] ZHU G H, JI Z H, WOOD J J, et al.Dendrobium[M]∥WU Z Y, RAVEN P H, HONG D Y. Flora of China: Vol.25. Beijing: Science Press, 2009: 367-397.
[6] 俞 婕, 赵凯鹏, 董 飞, 等. 野生铁皮石斛内生菌的分离及促生作用研究[J]. 现代农业科技, 2010(9): 96-97.
[7] TSAVKELOVA E A, LOBAKOVA E S, KOLOMEITSEVA G L, et al. Associative cyanobacteria isolated from the roots of epiphytic orchids[J]. Microbiology, 2003, 72(1): 92-97.
[8] 张光浓, 毕志明, 王峥涛, 等. 石斛属植物化学成分研究进展[J]. 中草药, 2003, 34(6): 附5-附8.
[9] 朱国胜, 刘作易, 黄永会, 等. 美花石斛组培苗促生内生真菌分离及筛选[J]. 种子, 2007, 26(12): 17-20.
[10] FULTHORPE R R, RHODES A N, TIEDJE J M. High levels of endemicity of 3-chlorobenzoate-degrating soil bacteria[J]. Applied and Environmental Microbiology, 1998, 64(5): 1620-1627.
[11] CHO J C, TIEDJE J M. Biogeography and degree of endemicity of fluorescentPseudomonasstrains in soil[J]. Applied and Environ-mental Microbiology, 2000, 66(12): 5448-5456.
[12] 沈 萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 214-215.
[13] ZHENG Y, XUE Q Y, XU L L, et al. A screening strategy of fungal biocontrol agents towardsVerticilliumwilt of cotton[J]. Biological Control, 2011, 56(3): 209-216.
[14] 杨 柳, 唐旺全, 蒋 艳, 等. 解钾芽孢杆菌的分离·鉴定及其代谢产物分析[J]. 安徽农业科学, 2011, 39(28): 17265-17267.
[15] GLICKMANN E, DESSAUX Y. A critical examination of the speci-ficity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Micro-biology, 1995, 61(2): 793-796.
[16] DOYLE J J, DOYLE J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissues[J]. Phytochemical Bulletin, 1987, 19: 11-15.
[17] CHELIUS M K, TRIPLETT E W. The diversity of archaea and bacteria in association with the roots ofZeamaysL.[J]. Microbial Ecology, 2001, 41(3): 252-263.
[18] 张晓霞, 马晓彤, 曹卫东, 等. 紫云英根瘤菌的系统发育多样性[J]. 应用与环境生物学报, 2010, 16(3): 380-384.
[19] 张 萍, 宋希强. 兰科植物内生细菌物种多样性及其促生机理研究进展[J]. 热带亚热带植物学报, 2012, 20(1): 92-98.
[20] 章华伟, 钟超群. 铁皮石斛内生细菌的分离和初步鉴定[J]. 湖南农业科学, 2013, 52(8): 1811-1813.
[21] TSAVKELOVA E A, CHERDYNTSEVA T A, BOTINA S G, et al. Bacteria associated with orchid roots and microbial production of auxin[J]. Microbiological Research, 2007, 162(1): 69-76.
[22] CHEN X M, DONG H L, HU K X, et al. Diversity and anti-microbial and plant-growth-promoting activities of endophytic fungi inDendrobiumloddigesiiRolfe[J]. Journal of Plant Growth Regulation, 2010, 29(3): 328-337.
[23] WILKINSON K G, DIXON K W, SIVASITHAMPARAM K. Inter-action of soil bacteria, mycorrhizal fungi and orchid seed in relation to germination of Australian orchids[J]. New Phytologist, 1989, 112(3): 429-435.
[24] WILKINSON K G, DIXON K W, SIVASITHAMPARAM K, et al. Effect of IAA on symbiotic germination of an Australian orchid and its production by orchid-associated bacteria[J]. Plant and Soil, 1994, 159(2): 291-295.
[25] WILKINSON K G, DIXON K W, BRADLEY J K, et al. Identi-fication and characterization of bacteria associated with western Australian orchids[J]. Soil Biology and Biochemistry, 1994, 26(1): 137-142.
[26] TSAVKELOVA E A, CHERDYNTSEVA T A, NETRUSOV A I. Bacteria associated with the roots of epiphytic orchids[J]. Microbiology, 2004, 73(6): 710-715.
[27] TSAVKELOVA E A, CHERDYNTSEVA T A, KLIMOVA S Y, et al. Orchid-associated bacteria produce indole-3-acetic acid, promote seed germination, and increase their microbial yield in response to exogenous auxin[J]. Archives of Microbiology, 2007, 188(6): 655-664.
[28] ADESEMOYE A O, KLOEPPER J W. Plant-microbes interactions in enhanced fertilizer-use efficiency[J]. Applied Microbiology Biotechnology, 2009, 85(1): 1-12.

[30] FREY-KLETT P, CHURIN J L, PIERRAT J C, et al. Dose effect in the dual inoculation of an ectomycorrhizal fungus and a mycorrhiza helper bacterium in two forest nurseries[J]. Soil Biology and Biochemistry, 1999, 31(11): 1555-1562.
[31] ASPRAY T J, JONES E E, WHIPPS J M, et al. Importance of mycorrhization helper bacteria cell density and metabolite localization for thePinussylvestris-Lactariusrufussymbiosis[J]. FEMS Microbiology Ecology, 2006, 56(1): 25-33.
[32] LIU P, NESTER E W. Indoleacetic acid, a product of transferred DNA, inhibitsvirgene expression and growth ofAgrobacteriumtumefaciensC58[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(12): 4658-4662.
