缓激肽在过敏性疾病发病机制中的作用
2014-04-09戴红良张慧云何韶衡
戴红良,张慧云,2,何韶衡#
(1辽宁医学院变态反应与临床免疫研究中心,辽宁锦州 121001;2辽宁医学院病理生理学教研室,辽宁锦州 121001)
Ⅰ型超敏反应又称为过敏反应或速发型超敏反应,是临床上常见的一种超敏反应类型。Ⅰ型超敏反应基本过程为:过敏原进入机体→诱导B细胞产生IgE抗体→IgE与肥大细胞或嗜碱粒细胞表面FcεRI结合→机体致敏;再次接触相同过敏原→过敏原与致敏肥大细胞或嗜碱粒细胞表面的IgE结合→FcεRI发生桥联→介导肥大细胞或嗜碱粒细胞脱颗粒,释放生物活性物质→引起过敏发应[1]。其中,肥大细胞和(或)嗜碱粒细胞脱颗粒释放的生物活性物质包括组胺、蛋白水解酶、前列腺素及白三烯等。这些生物活性介质随血流散布全身,可引起皮肤黏膜、呼吸道、消化道局部,甚至全身的过敏症状[1]。
除了上述肥大细胞和(或)嗜碱粒细胞介质外,激肽释放酶-激肽系统(kallikrein-kinin system, KKS)也参与过敏性疾病的发生与发展过程。缓激肽(bradykinin)是KKS系统的终末效应物质,具有扩张血管、增加血管通透性[2]、诱导非血管平滑肌收缩、致痛等多种生物活性[3]。近年来,围绕缓激肽在过敏性哮喘、过敏性鼻炎等过敏性疾病中的作用及其作用机制研究取得了一些新的进展(图1)。
激肽释放酶-激肽系统
KKS系统由血浆/组织激肽释放酶、激肽原及激肽组成。激肽释放酶是一组表达于腺体细胞、中性粒细胞及体液中的丝氨酸蛋白酶,分为组织型及血浆型。在组织损伤、缺血、应激等刺激下,激肽释放酶发生活化。活化的激肽释放酶分别催化组织中的低分子量激肽原(low molecular weight kininogen, LMWK)及血浆中的高分子量激肽原(high molecular weight kininogen,HMWK),生成缓激肽和赖氨酰缓激肽。其中,赖氨酰缓激肽又可在氨基肽酶的催化下转变为缓激肽。有研究认为,肥大细胞弹性蛋白酶及类胰蛋白酶也参与水解激肽原生成缓激肽,两者配合诱导缓激肽生成的速率与激肽释放酶相似[4]。缓激肽是一种血管活性九肽,其血浆半衰期很短,目前主要利用酶联免疫吸附测定或高效液相色谱法测定其代谢产物(半衰期为86~101 min)的含量以间接反映体内缓激肽的水平。
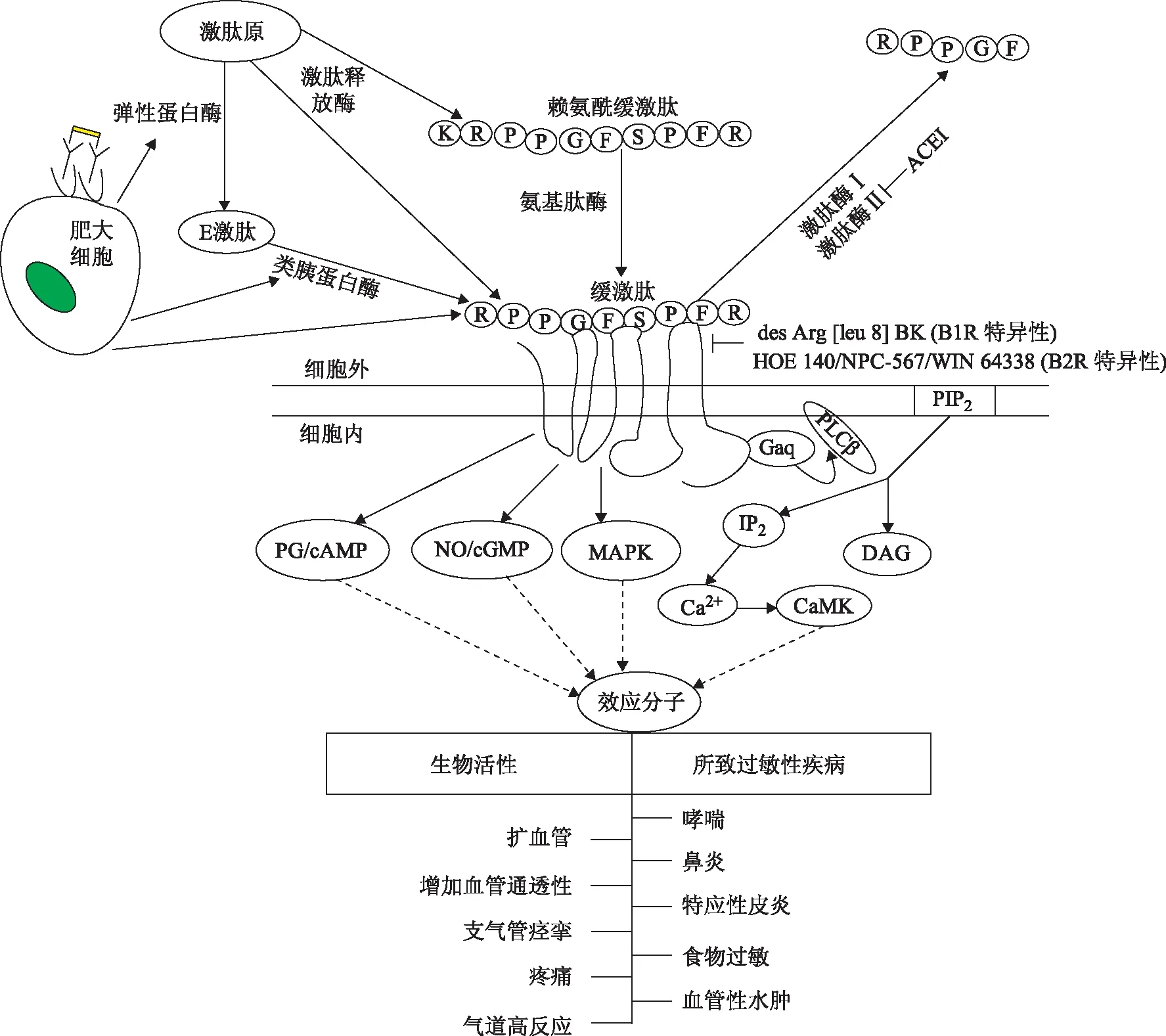
图1缓激肽在过敏性疾病发病机制中的作用
Fig1Role of bradykinin in the pathogenesis of allergic diseases
ACEI:血管紧张素转化酶抑制剂;PG:前列腺素;cAMP:环腺苷酸;NO:一氧化氮;cGMP:环鸟苷酸;MAPK:丝裂原活化蛋白激酶;PIP2:磷脂酰肌醇4,5-二磷酸;PLC β:磷脂酶C β;IP3:三磷酸肌醇;DAG:二酰甘油;CaMK:钙调蛋白依赖性蛋白激酶
此外,体内还有两种可降解缓激肽的酶——激肽酶Ⅰ和Ⅱ,激肽酶Ⅱ即为血管紧张素转化酶。血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)类药物的作用部分即是通过抑制缓激肽降解,从而增加其局部缓激肽浓度而实现的。
缓激肽受体及受体后信号转导
缓激肽通过与靶细胞表面的缓激肽受体结合发挥其生物学作用。缓激肽受体为G蛋白耦联受体(G protein coupled receptor, GPCR),主要包括B1和B2两个亚型。B2受体在神经系统、支气管平滑肌、鼻道、血管内皮细胞等组织中组成性表达,已知的多数缓激肽功能是由B2受体介导的,如哮喘患者气道平滑肌上的B2受体上调[5]。B1受体为诱导性表达,组织损伤及炎性反应可诱导B1受体表达[6]。炎性因子白细胞介素-1β和肿瘤坏死因子-α可诱导成骨细胞及齿龈成纤维细胞B1、B2受体表达上调[7]。
缓激肽B1及B2受体均属七次跨膜GPCR,受体激活后可进一步激活特异性磷脂酶C(phospholipase C,PLC)产生三磷酸肌醇(inositol triphosphate, IP3)和二酰甘油(diacylglycerol, DAG),进而促进Ca2+通道开放,增加胞内Ca2+浓度并引起下游靶蛋白的激活[5]。此外,缓激肽还可参与RasRafMEKMAPK[8]、NOcGMP[9]及前列腺素cAMP[10]等信号通路的活化。通过上述信号转导,缓激肽广泛地发挥扩张血管、增加血管通透性、诱导支气管痉挛、促支气管收缩、促年液分泌及致痛等与过敏反应相关的各种生物活性[11]。
缓激肽与过敏性疾病
过敏性哮喘
环境中的刺激性气体、烟雾、氧化剂、有机抗原、灰尘等物质诱发的支气管收缩、血管收缩、血管通透性增加、炎性反应等肺损伤的病理生理过程是由包括缓激肽在内的多种体液物质介导的。Jang等[12]研究发现,缓激肽受体抑制剂黄芩新素可作用于TGF-β1Samd通路,从而降低卵清蛋白诱导的气道高反应、缓解气道嗜酸粒细胞增多、抑制皮下胶原沉积等,表明缓激肽参与诱发过敏性哮喘的发生。Ellis等[13]研究发现,选择性B2受体拮抗剂HOE140可完全解除卵清蛋白致敏条件下缓激肽对支气管的收缩作用,而选择性B1受体激动剂Lys-[desArg9]-缓激肽并不具有支气管的收缩活性;由此提示,在卵清蛋白致敏条件下,缓激肽通过B2受体发挥支气管收缩活性。但是,Zhang等[14]发现,某些环境风险因素可通过MAPKNF-κB同时上调激肽B1、B2受体表达,二种共同介导了缓激肽诱导的过敏性哮喘。上述研究结果表明,缓激肽发挥作用的方式与环境刺激的种类密切相关。
缓激肽诱导支气管收缩的机制是通过激活气道平滑肌细胞内的GPCR-Gaq-PLCβ-Ca2+信号通路。G蛋白信号调节蛋白5(regulator of G-protein signaling 5,GRS 5)是该通路的负性调节蛋白。研究显示,GRS 5在哮喘患者中的表达显著高于正常人[5],这可能是人体限制哮喘的一个重要负反馈机制。除了直接诱导支气管收缩外,缓激肽还可诱导成纤维细胞分化成为肌成纤维细胞,导致细胞外基质重构[15]。重构的细胞外基质可以显著诱导基质金属蛋白酶的活性[16],进一步增强缓激肽对支气管的收缩作用,使哮喘进一步恶化。
过敏性鼻炎
过敏性鼻炎与肥大细胞激活及炎性因子释放相关。Shirasaki等[17]研究证明,鼻黏膜上皮细胞、黏膜下腺体、成纤维细胞、血管平滑肌细胞、血管内皮细胞、巨噬细胞等均表达B1和B2受体。B2受体在鼻黏膜神经上也有表达。缓激肽所致过敏性鼻炎症状强度相当于组胺的7倍以上。应用B2受体特异性激动剂刺激鼻腔可引起鼻塞、流涕、血浆蛋白渗出等症状,但B1受体特异性激动剂则不能引起这些症状[11]。外源性缓激肽所引起的过敏性鼻炎鼻腔症状可被B2受体拮抗剂所阻断[17]。B2受体拮抗剂还可抑制过敏性鼻炎患者的炎性反应[18]。Pinargot等[19]报道,患者应用ACEI类抗高血压药物后出现鼻炎等呼吸道症状,停用该药或改用血管紧张素Ⅱ受体拮抗剂后症状消失。这些证据说明,缓激肽在过敏性鼻炎的发病中起到了重要的作用,抗缓激肽治疗有望成为过敏性鼻炎治疗的新策略。
过敏性皮炎
近年研究发现,低剂量化学毒物局部暴露诱导皮肤过敏是KKS系统活化的结果[20],血管紧张素转化酶可缓解接触性皮炎的过敏反应[21],提示缓激肽在接触性皮炎的发病过程中起作用。机制研究显示,B2受体拮抗剂可抑制接触性皮炎反应,提示缓激肽通过B2受体诱导接触性皮炎发生。进一步研究发现,B1及B2受体均介导了辣椒素诱导的皮炎[22]。在特应性皮炎中,缓激肽还是一种强烈的非组胺依赖性致痒物质[23]。
食物过敏
有报道发现,花生及树坚果(tree nuts)过敏患者血清中血管紧张素转化酶若小于37.0 mmolL,则该患者发生致命性咽部水肿的概率是其他人的9.6(1.6~57)倍,提示此类过敏至少部分可能是由缓激肽介导的[24]。
缓激肽与血管性水肿
虽然,血管性水肿不是传统意义上的过敏性疾病,但此类疾病患者往往到过敏科门诊就医,所以本文亦对缓激肽与血管性水肿的关系进行了初步综述。KKS系统与血管神经性水肿直接相关。如临床常用的ACEI类抗高血压药物主要不良反应之一是血管性水肿[25],其作用机制是血管紧张素转化酶受到抑制后不能有效降解缓激肽,导致后者在体内蓄积,进而诱发血管通透性增加[26]。此外,还有一种遗传性血管神经性水肿(hereditary angioedema, HAE),其发病机制主要是由于患者体内C1酯酶抑制剂遗传性缺陷,导致KKS系统过度活化,过度生成缓激肽[27]。Oschatz等[28]发现,肥大细胞激活后可以通过释放肝素途径激活蛋白酶因子XII,继而增加缓激肽的生成。缓激肽再通过激肽B2受体诱导血管通透性增加及皮肤水肿。
最近的研究发现,B2受体抑制剂对减少HAE发作有益,B2受体的拮抗剂已推荐作为治疗血管性水肿发作的药物之一[29]。然而,Bossi等[30]认为,B1受体通过与补体系统的相互作用也参与了血管神经性水肿的发作。Kassuya等[31]发现,缓激肽诱导的大鼠爪水肿可被内皮素-1受体ET(A)的阻断剂BQ-123所抑制,抑制率达74%~4%,提示缓激肽诱发水肿很可能也与ET(A)的激活有关。
以缓激肽为靶点的抗过敏药物研发
目前,抗过敏药物的研发仍然是以糖皮质激素类和抗组胺药物为主,抗缓激肽药物屈指可数,且大多处于临床前研究阶段。2009年,美国食品药品管理局(FDA)批准皮下注射剂Kalbitor用于治疗遗传性血管水肿。Kalbitor的主要成分艾卡拉肽是人血浆激肽释放酶抑制剂,可降低缓激肽生成。随机临床试验证实,Kalbitor对于遗传性血管水肿所有类型的急性发作均有效[32]。最近,FDA已将该药的适用人群由16岁以上人群扩大至12岁儿童。
2011年,皮下注射剂Firazyr也获FDA的批准用于治疗遗传性血管水肿,其主要成分艾替班特属于B2受体拮抗剂。最近研究显示,Ⅰ型遗传性血管水肿患者的症状可在应用艾替班特后30 min得到明显缓解[27]。
Kenniston等[33]还发现了一种完全人源的IgG1型单克隆抗体DX-2930,其可特异性拮抗血浆激肽释放酶。该研究发现,DX-2930以剂量和时间依赖性地抑制HMWK的蛋白水解,并减弱卡拉胶介导的大鼠爪水肿,有望用于遗传性血管性水肿的治疗。
动物实验还显示,口服B2受体拮抗剂FK3657对哮喘及过敏性鼻炎具有明显的治疗作用[34],B2受体拮抗剂MEN16132对于内源性缓激肽诱发的豚鼠气道高反应有明显的抑制作用,B2受体拮抗剂有望用于哮喘及过敏性鼻炎的治疗[35]。
结 语
缓激肽是早已为人们所认识的生物活性介质。缓激肽在过敏性哮喘、鼻炎及皮炎等疾病中的病理生理作用得到广泛证实。近年来,随着对其机制的深入探讨,以缓激肽作为靶点的抗过敏药物的研发显示积极发展前景,有望为过敏性疾病的治疗提供新的手段。
[1]He S, Zhang H, Zeng X, et al. Self-amplification mechanisms of mast cell activation:a new look in allergy[J].Curr Mol Med, 2012, 12:1329-1339.
[2]He S, Walls AF. Human mast cell tryptase:a stimulus of microvascular leakage and mast cell activation[J].Eur J Pharmacol, 1997, 328:89-97.
[3]Blaes N, Girolami JP. Targeting the “Janus face” of the B2-bradykinin receptor[J].Expert Opin Ther Targets, 2013, 17:1145-1166.
[4]Coffman LG, Brown JC, Johnson DA, et al. Cleavage of high-molecular-weight kininogen by elastase and tryptase is inhibited by ferritin[J].Am J Physiol Lung Cell Mol Physiol, 2008, 294:505-515.
[5]Yang Z, Balenga N, Cooper PR, et al. Regulator of G-protein signaling-5 inhibits bronchial smooth muscle contraction in severe asthma[J].Am J Respir Cell Mol Biol, 2012, 46:823-832.
[6]Chen JJ, Johnson EJ. Targeting the bradykinin B1 receptor to reduce pain[J].Expert Opin Ther Targets, 2007, 11:21-35.
[7]Souza PP, Brechter AB, Reis RI, et al. IL- 4 and IL-13 inhibit IL-1beta and TNF-alpha induced kinin B1 and B2 receptors through a STAT6-dependent mechanism[J].Br J Pharmacol, 2013, 169:400- 412.
[8]Golias C, Charalabopoulos A, Stagikas D, et al. The kinin system--bradykinin:biological effects and clinical implications. Multiple role of the kinin system--bradykinin[J].Hippokratia, 2007, 11:124-128.
[9]Kanoo S, Alex AB, Tiwari AK, et al. B(2) kinin receptors mediate the Indian red scorpion venom-induced augmentation of visceral reflexes via the nitric oxide cyclic guanosine monophosphate pathway[J].Acta Physiol (Oxf), 2009, 196:365-373.
[10] Webb JG, Tan Y, Jaffa MA, et al. Evidence for prostacyclin and cAMP upregulation by bradykinin and insulin-like growth factor 1 in vascular smooth muscle cells[J].J Recept Signal Transduct Res, 2010, 30:61-71.
[11] Maurer M, Bader M, Bas M, et al. New topics in bradykinin research[J].Allergy, 2011, 66:1397-1406.
[12] Jang HY, Ahn KS, Park MJ, et al. Skullcapflavone II inhibits ovalbumin-induced airway inflammation in a mouse model of asthma[J].Int Immunopharmacol, 2012, 12:666-674.
[13] Ellis KM, Cannet C, Mazzoni L, et al. Airway hyperresponsiveness to bradykinin induced by allergen challenge in actively sensitised Brown Norway rats[J].Naunyn Schmiedebergs Arch Pharmacol, 2004, 369:166-178.
[14] Zhang Y, Cardell LO, Edvinsson L, et al. MAPKNF-kappaB-dependent upregulation of kinin receptors mediates airway hyperreactivity:a new perspective for the treatment[J].Pharmacol Res, 2013, 71:9-18.
[15] Sabatini F, Petecchia L, Usai C, et al. Pharmacological modulation of the bradykinin-induced differentiation of human lung fibroblasts:effects of budesonide and formoterol[J].J Asthma, 2012, 49:1004-1011.
[16] Rogers NK, Clements D, Dongre A, et al. Extra-cellular matrix proteins induce matrix metalloproteinase-1 (MMP-1) activity and increase airway smooth muscle contraction in asthma[J].PLoS One, 2014, 9:e90565.
[17] Shirasaki H, Kanaizumi E, Himi T. Immunohistochemical localization of the bradykinin B1 and B2 receptors in human nasal mucosa[J].Mediators Inflamm, 2009, 2009:102406.
[18] Dear JW, Wirth K, Scadding GK, et al. Characterization of the bradykinin receptor in the human nasal airway using the binding of[125I]-Hoe 140[J].Br J Pharmacol, 1996, 119:1054-1062.
[19] Pinargot P, Guillen D, Guarderas JC. ACE inhibitors:upper respiratory symptoms[J].BMJ Case Rep, 2014, 2014.
[20] Nakano Y. Effect of chronic topical exposure to low-dose noxious chemicals and stress on skin sensitivity in mice[J].J Occup Health, 2007, 49:431- 442.
[21] Scholzen TE, Stander S, Riemann H, et al. Modulation of cutaneous inflammation by angiotensin-converting enzyme[J].J Immunol, 2003, 170:3866-3873.
[22] Pietrovski EF, Otuki MF, Regoli D, et al. The non-peptide kinin receptor antagonists FR 173657 and SSR 240612:preclinical evidence for the treatment of skin inflammation[J].Regul Pept, 2009, 152:67-72.
[23] Fu K, Qu L, Shimada SG, et al. Enhanced scratching elicited by a pruritogen and an algogen in a mouse model of contact hypersensitivity[J].Neurosci Lett, 2014.
[24] Summers CW, Pumphrey RS, Woods CN, et al. Factors predicting anaphylaxis to peanuts and tree nuts in patients referred to a specialist center[J].J Allergy Clin Immunol, 2008, 121:632-638 e632.
[25] Bezalel S, Mahlab-Guri K, Asher I, et al. Angiotensin Converting Enzyme Inhibitor Induced Angioedema[J].Am J Med, 2014.
[26] Stauber T, Confino-Cohen R, Goldberg A. Life-threatening angioedema induced by angiotensin-converting enzyme inhibitors:characteristics and risk factors[J].Am J Rhinol Allergy, 2014, 28:54-58.
[27] Campos RA, Valle SO, França AT, et al. Icatibant, an inhibitor of bradykinin receptor 2, for hereditary angioedema attacks:prospective experimental single-cohort study[J].Sao Paulo Med J, 2014, 132:261-265.
[28] Oschatz C, Maas C, Lecher B, et al. Mast cells increase vascular permeability by heparin-initiated bradykinin formation in vivo[J].Immunity, 2011, 34:258-268.
[29] Bork K. An evidence based therapeutic approach to hereditary and acquired angioedema[J].Curr Opin Allergy Clin Immunol, 2014, 14:354-362.
[30] Bossi F, Tedesco F. Role of the B1 bradykinin receptor and gC1qRp33 in angioedema[J].Immunol Allergy Clin North Am, 2013, 33:535-544.
[31] Kassuya CA, Rogerio AP, Calixto JB. The role of ET(A) and ET(B) receptor antagonists in acute and allergic inflammation in mice[J].Peptides, 2008, 29:1329-1337.
[32] Stolz LE, Sheffer AL. Prospective, double-blind, placebo-controlled trials of ecallantide for acute attacks of hereditary angioedema[J].Expert Rev Clin Immunol, 2012, 8:25-32.
[33] Kenniston JA, Faucette RR, Martik D, et al. Inhibition of Plasma Kallikrein by a Highly Specific, Active Site Blocking Antibody[J].J Biol Chem, 2014.
[34] Hirayama Y, Miyayasu K, Yamagami K, et al. Effect of FK3657, a non-peptide bradykinin B2 receptor antagonist, on allergic airway disease models[J].Eur J Pharmacol, 2003, 467:197-203.
[35] Valenti C, Cialdai C, Giuliani S, et al. MEN16132, a kinin B2 receptor antagonist, prevents the endogenous bradykinin effects in guinea-pig airways[J].Eur J Pharmacol, 2008, 579:350-356.
