胶原蛋白/聚乙烯醇混合液的流变特性及复合膜性能的研究
2014-04-02,,
, ,
(1.中原工学院,郑州 450007;2.郑州大学 材料科学与工程学院,郑州 450052)
胶原蛋白具有优良的生物相容性和低抗原性,其纤维状结构有利于组织培养中的细胞黏附、增殖和分化等功能,在生物医学领域有着广泛的应用价值[1-4]。胶原虽然以其优良的性能受到生物医学界的欢迎,但也存在一些不足之处,如可纺性较差、力学性能差、在体内降解吸收过快、不能与组织细胞生长繁殖的速度相匹配等[5]。为了改善胶原材料的性能,需要将胶原与其他合成材料、天然生物材料复合来制备胶原基复合材料[6-7]。聚乙烯醇( PVA) 是一种无毒性、具有生物可降解性和良好生物相容性的高分子材料,其力学性能优良、化学性质稳定、易于成型,可作为医药、化妆品行业中的功能材料[8]。因此,以聚乙烯醇和胶原为原料制备复合材料,成为一种简单有效的途径。溶液流变性能与其纺丝性能和成膜流动性能有一定的关系,所以有必要研究混合液的流变性能。本文利用幂律函数模型讨论了混合比对溶液流变性能的影响,并对复合膜的性能进行了分析,为胶原蛋白/聚乙烯醇复合膜的制备提供参考数据。
1 实 验
1.1 实验材料
聚乙烯醇(简称PVA)的聚合度为1 750±50,天津市天大化工实验厂生产。采用胃蛋白酶法从猪皮中提取胶原蛋白,经过纤维素半透膜透析,冷冻干燥成胶原海绵状备用。
1.2 COL/PVA混合溶液的配制及复合膜的制备
胶原蛋白乙酸溶液的制备:将冷冻干燥后的胶原海绵加入到0.5 mol/L的乙酸溶液中,室温下磁力搅拌溶解,配成10 g/L的胶原蛋白乙酸水溶液。
PVA溶液的制备:称取一定量的粉末状PVA-1 750,放入三口瓶中,并加入适量的去离子水,在90 ℃水浴条件下加热,并电动搅拌,充分溶解2 h,配成8 wt%的PVA水溶液。
把上述两种溶液以不同的质量比混合,室温搅拌2 h,制备COL/PVA质量比分别为纯COL、8/2、2/8、纯PVA的4种溶液,并用离心机对溶液进行离心脱泡,然后进行流变性能研究。
COL/PVA复合膜是在PVC板上通过流延法自然干燥而成。
1.3 COL/PVA共混液的流变性能测试
利用AR-1500(TA, 美国)流变仪对不同质量配比的COL/PVA共混液进行稳态流变性能测定,测试温度为25 ℃,剪切速率为10~500 s-1,选用平板直径为40 mm,间隙设定为1 mm。
1.4 COL/PVA复合膜的红外表征
利用FTIR(NICOLET,美国)对不同质量配比的COL/PVA复合膜以0.48 cm-1的扫描速率在 650~4 000 cm-1范围内扫描。
1.5 COL/PVA复合膜的热重分析
利用 NETZSCH TG 209 F1 对不同质量配比的COL/PVA复合膜的热稳定性进行测定,加热温度范围为25~600 ℃,加热速率为 20 K/min,氮气为保护气和吹扫气。
2 结果讨论
2.1 COL/PVA混合液的流变性能
溶液剪切速率与表观黏度的关系曲线即流动曲线,是对纺丝和成膜过程中溶液流动状况的反映。同时,流动曲线也是共混溶液分子结构(如相对分子量、相对分子量分布以及链结构化程度)的函数[5]。COL/PVA混合液的流动曲线如图1所示。
设置7个饲料蛋白梯度,每梯度设3个平行组,每组40尾大刺鳅幼鱼。试验用水为经充分曝气24 h以上的井水,利用电加热棒维持水温为27~28℃,溶解氧≥6.0 mg/l,氨氮<0.2 mg/l,亚硝酸盐<0.02 mg/l,pH值保持7.3±0.3。每日7:00和16:00投喂试验饲料,日投饵量为鱼体总重的2%~2.5%,摄食结束2 h后虹吸排污,日换水量为70%。每日记录饲料摄食量和死亡鱼尾数,每隔10 d每组抽样6尾大刺鳅称重,调整饲料投喂量,试验持续60 d。
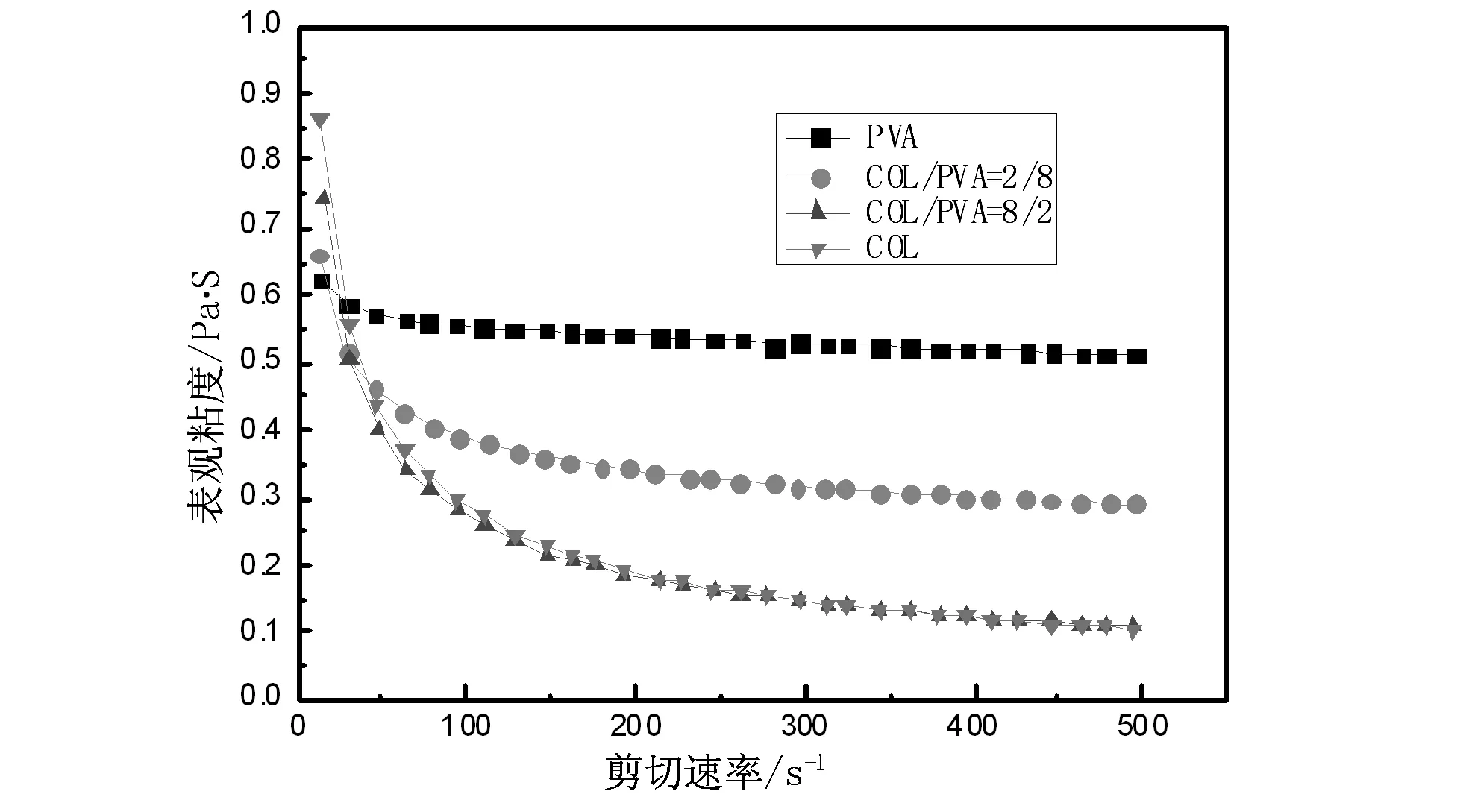
图1 COL/PVA混合液的表观黏度与剪切速率的关系图
从图1可以看出:随着剪切速率的增加,共混溶液的表观黏度逐渐下降,即出现“剪切变稀”现象,且胶原含量越高,“剪切变稀”现象越明显,这与文献[9]、[10]研究结果相吻合。这是因为胶原蛋白是由多种氨基酸组合而成的三股螺旋结构,随着胶原蛋白含量增加,共混溶液更易发生分子间的缠结,在三维空间中通过H键形成网络结构,随着剪切速率的提高,共混溶液中的分子发生取向、伸展,使影响溶液流动的大分子缠结点被拆除,致使缠结点浓度减少,表观黏度下降[5]。
利用幂律函数[11]模型方程
η=Kγn-1
(1)
来研究COL/PVA混合液的流变特点。其中:η为表观黏度;γ是剪切速率;K为稠度系数;n为非牛顿指数,n=1时为牛顿型流体,n<1时为假塑性非牛顿流体,n>1时为膨胀性非牛顿流体。
对方程(1)两边取对数,即转变为方程
lgη=lgK+(n-1)lgγ
(2)

表1 不同胶原含量下非牛顿指数及相关参数
通过表1可以看出,拟合方差R2都大于0.99,说明幂律函数模型比较适合该混合体系。COL/PVA混合液的非牛顿指数n值随着胶原含量的增加而降低,说明胶原含量越大,COL/PVA混合液越偏离牛顿型流体。COL/PVA混合液的稠度系数K值随着胶原含量的增加而升高,说明胶原含量越大,混合液中大分子间的缠结点越多,表现为稠度越大。可见胶原含量对COL/PVA共混溶液的流变性能影响较显著。
2.2 COL/PVA复合膜的红外表征
通过红外表征,研究了COL/PVA复合膜的化学性能。COL/PVA复合膜的红外图谱如图2所示。
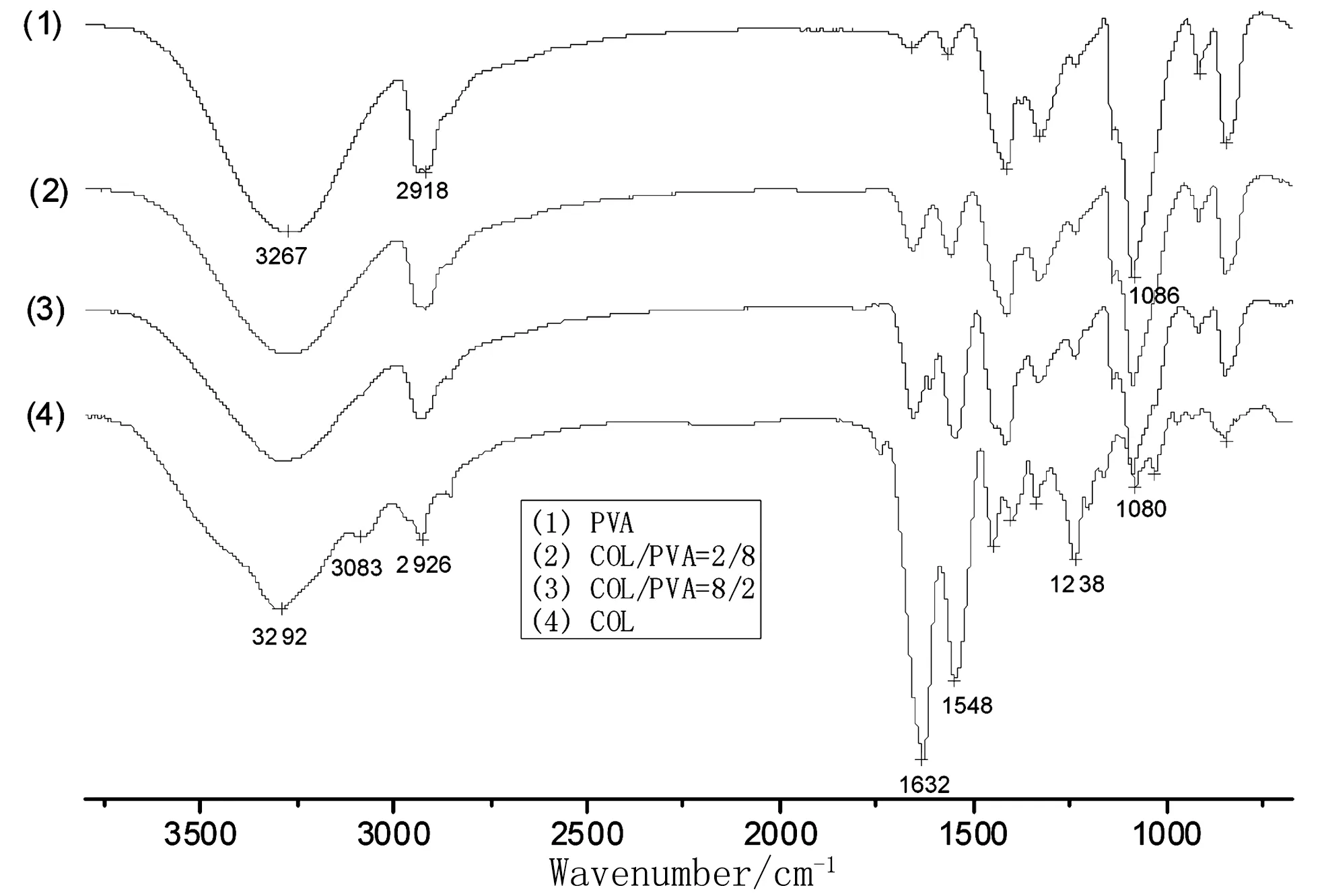
图2 COL/PVA复合膜的红外图谱
从图2可以看出纯胶原海绵的特征吸收峰为:3 292 cm-1(酰胺A带, N-H 伸缩振动 和O-H伸缩振动)、3 083 cm-1(酰胺 B带, C-H伸缩振动)、1 632 cm-1(酰胺Ⅰ, C-O伸缩振动)、1 548 cm-1(酰胺Ⅱ, N-H 弯曲振动和 C-N伸缩振动) 和1 238 cm-1(酰胺Ⅲ, C-N伸缩振动和 N-H 弯曲振动)。纯PVA的特征吸收峰为:3 267 cm-1(O-H伸缩振动)、2 918 cm-1(C-H伸缩振动)、1 086 cm-1(C-O-H伸缩振动)。
COL/PVA复合膜的红外吸收特征表现为:随着胶原含量的增加,PVA的特征峰1 086 cm-1逐渐减弱,当胶原与PVA混合后,3 083 cm-1(酰胺B带)消失,而酰胺Ⅰ和酰胺Ⅱ带峰逐渐增强,且向高波数移动,这可能是由于胶原与PVA间存在较强的氢键所致[12]。
2.3 COL/PVA复合膜的热稳定性
利用热重分析法可以研究COL/PVA复合膜的热稳定性能。COL/PVA复合膜的TG和DTG图如图3所示。
从图3可以看出纯胶原存在2个失重阶段:第一个失重主要是由胶原海绵中的水分蒸发所致;第二个失重是由胶原大分子链的热分解所致。而纯PVA膜存在3个失重阶段:第一个失重阶段主要是由PVA膜中的水分的蒸发所致;第二个失重阶段是由PVA大分子主链的热分解所致;第三个失重阶段是由PVA大分子侧链的热分解所致[13]。COL/PVA复合膜在25~600 ℃之间也存在3个失重阶段:第一个失重阶段主要是由复合膜中水分的蒸发所致;第二个失重阶段主要是由大分子主链的热分解所致;第三个失重阶段主要是由大分子侧链的热分解所致。利用热重分析仪自带热重参数分析软件得到COL/PVA复合膜的非等温热降解参数列于表2中。
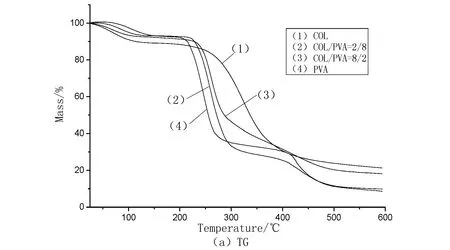
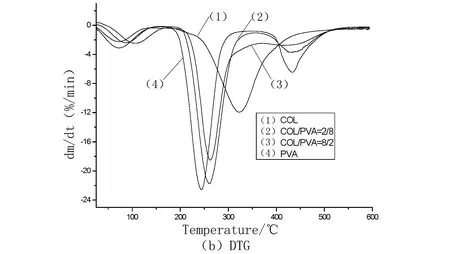
图3 COL/PVA复合膜的TG和DTG图
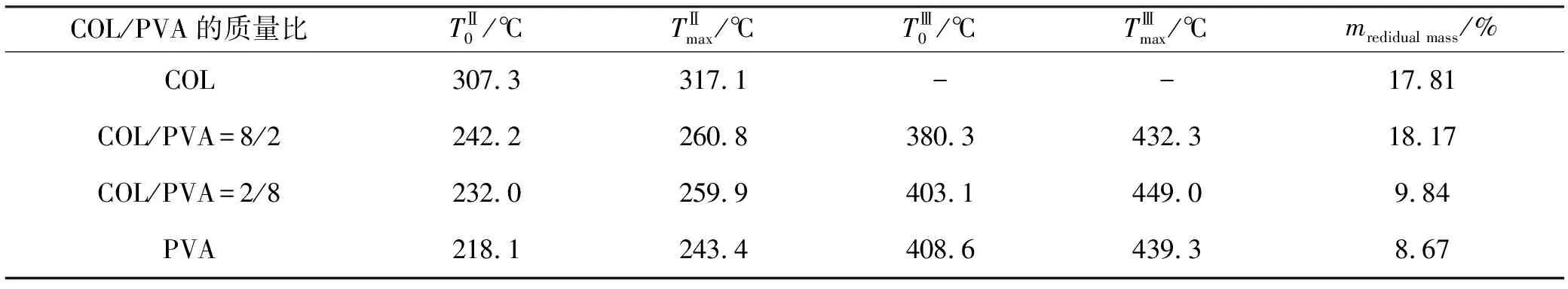
表2 COL/PVA复合膜的非等温热降解参数
从表2中可以看出COL/PVA复合膜第二个失重阶段的起始热分解温度和最大热分解温度随着胶原含量的增加而增加,说明胶原热稳定性比纯PVA的高,且胶原与PVA之间存在较多的分子间作用力,这与流变特性和红外图谱分析相一致。COL/PVA复合膜第三个失重阶段的起始热分解温度,随着胶原含量的增加而稍有降低,而最大热分解温度则先升高后降低。从热分解残余量可以看出,随着胶原含量的增加,残余质量越大。
3 结 语
(1) 通过流变性能的研究,可以看出COL/PVA混合液属于假塑性流体,呈现剪切变稀现象,且胶原蛋白含量对COL/PVA混合液的流变性能影响显著,COL/PVA混合液的非牛顿指数n值随着胶原含量的增加而降低。
(2) 红外图谱显示COL/PVA复合膜没有发生明显的化学键结合,随着胶原含量的增加,胶原的特征峰逐渐增强,且胶原与PVA之间存在较强的氢键结合。
(3) 随着胶原含量的增加,COL/PVA复合膜的热重分析残余质量越大,可见胶原的存在使复合膜的热稳定性增加。
参考文献:
[1] Wolfgang Friess.Collagen-biomaterial for Drug Delivery[J].European Journal of Pharmaceutics and Biopharmaceutics, 1998,45: 113-136.
[2] O’Cearbhaill E D, Barron V, Mchugh P E.Characterisation of a Collagen Membrane for Its Potential Use in Cardiovascular Tissue Engineering Applications[J].Journal of Materials Science: Materials in Medicine, 2006,17: 195-201.
[3] Ashrafsh A, Henning S, Goerg H M.Polyvinyl Alcohol-collagen-hydroxyapatite Biocomposite Nanofibrous Scaffold: Mimicking the Key Features of Natural bone at the Nanoscale Level[J].Polymer, 2010, 51(4): 868-876.
[4] Purna Sai K, Mary Babu.Collagen based Dressings-a Review[J].Burns, 2000,26: 54-62.
[5] 曲健健, 但卫华, 曾睿.胶原-聚乙烯醇共混溶液的可纺性研究[J].皮革科学与工程, 2006, 16(2): 14-17.
[6] Sionkowska A, Skopinska-Wisniewska J, Wisniewski M.Collagen-synthetic Polymer Interactions in Solution and in Thin Films[J].Journal of Molecular Liquids, 2009, 145(3): 135-138.
[7] 叶勇, 王坤余, 廖隆理.胶原蛋白-壳聚糖-聚乙烯醇共混膜的特性研究[J].中国皮革, 2003, 32(23): 1-4.
[8] DeMerlis C C, Schoneker D R.Review of the Oral Toxicity of Polyvinyl Alcohol (PVA) [J].Food and Chemical Toxicology, 2003,41: 319-326.
[9] 来国莉, 李洋, 杜宗良.PVA-胶原共混溶液的流变性能[J].四川大学学报(工程科学版), 2008,40(4): 83-88.
[10] Lai G, Du Z, Li G.The Rheological Behavior of Collagen Dispersion-poly(vinyl alcohol) Blends[J].Korea-Australia Rheology Journal, 2007,19: 81-88.
[11] 顾国芳, 浦鸿汀.聚合物流变学基础[M].上海: 同济大学出版社, 2001:128-130.
[12] GAO Xi-ping, TANG Ke-yong, LIU Jie.Compatibility of Biodegradable Composites with Gelatin and Poly(Vinyl Alcohol)[C]//ICAMS 2012-4th International Conference on Advanced Materials and Systems, 2012: 261-266.
[13] Song S I, Kim B C.Characteristic Rheological Features of PVA Solutions in Water-containing Solvents with Different Hydration States[J].Polymer, 2004, 45(7): 2381-2386.
[14] Lin H, Dan W, Dan N.The Water State in Crosslinked Poly(vinyl alcohol)-collagen Hydrogel and Its Swelling Behavior[J].Journal of Applied Polymer Science, 2012, 123(5): 2753-2761.
