骨唇黄河鱼耳石早期形态发育和轮纹特征研究
2014-03-29严太明胡佳祥赵柳兰
严太明 胡佳祥 杨 婷 赵柳兰 何 智
(四川农业大学动物科技学院, 雅安 625014)
YAN Tai-Ming, HU Jia-Xiang, YANG Ting, ZHAO Liu-Lan and HE Zhi
(College of Animal Science and Technology, Sichuan Agricultural University, Ya’an 625014, China)
骨唇黄河鱼耳石早期形态发育和轮纹特征研究
严太明 胡佳祥 杨 婷 赵柳兰 何 智
(四川农业大学动物科技学院, 雅安 625014)
研究了骨唇黄河鱼仔稚鱼耳石在实验室养殖条件下的发育过程和生长特点, 确证了轮纹沉积规律。结果表明, 在14.0—17.8℃孵化条件下, 微耳石和矢耳石在受精后96h 30min出现, 星耳石在出膜后第16天出现。仔稚鱼生长过程中矢耳石形状变化较大, 由出膜时的圆形发育到稳定时的箭矢状。微耳石由近圆形发育成贻贝形, 其中心核位置随发育明显偏移。星耳石形状不规则, 从出现时的心形发育成为星芒状。微耳石和矢耳石在前后轴方向上后区的生长快于前区(P<0.05); 在背腹轴方向上, 微耳石腹区的生长快于背区(P<0.05),矢耳石背区的生长快于腹区(P<0.05), 两对耳石的前后区半径之和与全长均呈线性相关。微耳石和矢耳石的第1个轮纹均在出膜后第2天形成, 新增的轮纹数(微耳石IL, 矢耳石IS)与出膜后的天数(D)表现出显著的线性相关, 方程分别为: IL=0.9911D-1.0008(R2=0.9971, n=220, P<0.001)和IS=0.9925D-0.10873(R2=0.9919, n=161, P<0.001), 方程的斜率与1均无显著差异(P>0.05), 表明两对耳石轮纹沉积均呈日周期性, 生长轮为日轮。研究结果丰富了骨唇黄河鱼的发育生物学资料, 可为研究其自然种群早期生活史提供参考。
耳石; 形态发育; 日轮; 生长; 骨唇黄河鱼
鱼类耳石是头部半规管中的微小钙化组织,有探测声音和感知平衡的功能[1,2]。在早期发育阶段, 耳石的生长与发育除受环境因子的影响之外[3],更主要的是由遗传因素决定, 从而表现出高度的物种特异性[4,5]。因此, 可以利用耳石形态差异来进行鱼类分类学研究[6]。然而, 耳石早期形态变化过程的研究还相对较少且详略不一。
多数硬骨鱼类微耳石和矢耳石的轮纹具有日周期性[7—9], 且能记录早期发育阶段所经历的孵化、营养转换、卵胎生鱼类产出、变态、定居以及环境因子变化等事件[10,11]。近年来, 耳石微结构分析已成功应用于鱼类早期生活史研究以及产卵场位置和产卵期的推算[12—14]。但是, 在应用之前均应通过养殖试验对耳石日轮沉积规律和轮纹特征进行评估和验证。
骨唇黄河鱼(Chuanchia labiosa Herzenstein)是鲤形目(Cypriniformes)裂腹鱼亚科(Schizothoracinae)中的单属单种, 仅分布在我国四川、甘肃和青海省境内黄河上游干流及其支流海拔3000—4300 m的高原宽谷河段和湖泊中, 野生资源已极度匮乏, 被列为易危物种[15], 对它的研究仅见于分类学方面的报道[15,16]。本实验观察了骨唇黄河鱼耳石早期形态发育过程与生长特点, 并确证了微耳石和矢耳石轮纹形成的规律, 以期为研究其在野外状况下的早期生活史特点和资源变动规律提供参考。
1 材料与方法
1.1 实验鱼来源与管理
2011年4月5日, 在雅安市芦山县宝剑渔业有限公司养殖场通过人工授精方法获得骨唇黄河鱼受精卵, 带回四川农业大学实验室进行常温(14.0—17.8 )℃静水孵化, 用充氧泵充氧。选择在1h内先后出膜的仔鱼放于白塑料盆(36 cm×28 cm× 12 cm)中作为本实验材料。每天9:00和21:00将鱼分别置于20℃和12℃的生化培养箱培育。以卤虫无节幼体作为开口饵料, 随后投喂足量剁碎并消毒的水蚯蚓, 每日投喂两次。
1.2 耳石摘取与处理
从出膜至第 26天每天取仔鱼 8—10尾, 第 27至第62天每隔3天取样一次, 每次取样5尾。实验鱼用盐酸利多卡因(浓度为 30 mL/L)麻醉后放置在Leica DC500照相系统下拍照, 并用系统自带软件测量鱼体全长(精确度0.1 mm)。照相后的仔稚鱼在显微镜下挑出 3对耳石, 无水乙醇清洗后用中性树胶固定于载玻片上备用。耳石打磨参照Song, et al.[8]的方法进行。因星耳石的轮纹不清晰和无规律性,本实验未作轮纹数分析。
1.3 轮纹计数和照相
耳石用二甲苯透明后置于光学显微镜下计数轮纹, 方法参照 Song, et al.[8]的报道进行。用朱旗等[17]设计的计算机图像分析系统测量微耳石和矢耳石半径以及轮纹间距。选取典型样本在Nikon显微成像系统下照相。
1.4 数据及图片处理
用Excel 2007拟合出全长、耳石半径、耳石轮纹数与日龄以及耳石半径与体长的关系, 用SPSS Statistics 17.0对上述关系式进行差异显著性检验和方差分析。用Adobe photoshop CS2处理耳石图片。
2 结果

图1 骨唇黄河鱼耳石形态发育Fig. 1 Otoliths development in C. Labiosa
2.1 耳石形态发育
骨唇黄河鱼受精卵淡黄色, 弱黏性,吸水后卵径平均为(3.30±0.12) mm(n=15)。受精后72h听囊出现, 呈椭圆形。至96h 30min时微耳石和矢耳石出现。孵化历时 139h开始出膜, 初孵仔鱼全长8.5—9.0 mm [平均(8.81±0.24) mm, n=10], 眼灰黑色,鳃弓 3对, 身体透明无色素, 胸鳍原基扇形, 肌节54—56对。星耳石在出膜后第16天出现, 3对耳石形态随发育逐渐变化直至稳定(图1)。
微耳石 微耳石由近圆形发育成贻贝形, 整体形态变化不大, 但中心核相对位置随发育偏移明显(图 1)。微耳石在出膜 7d前近似圆形, 中心核居中。第13天时后端基叶生长较后端快, 轮间距较后端宽, 向腹部方向生长快于向背部, 中心核相对位置开始向前端背侧方向移动。第 16天耳石椭圆形,背侧平缓, 中心核相对位置向前端背侧移动明显,位于前端和背部方向约1/3处。第29天耳石整体轮廓呈扇形, 后端基叶进一步生长, 腹侧突起尖圆弧状, 背侧微内凹。第42天时耳石基叶凸起, 腹部外缘尖圆, 背侧中部明显内凹。第52天后外形呈贻贝形, 后端基叶末端略尖, 邻近基叶的背部微内凹,边缘光滑, 中心核相对位置向前移至近前端约 3/10处和背侧约1/4处。
矢耳石 矢耳石由圆形发育成箭矢状, 形态变化显著(图 1)。出膜后前 13天耳石近圆形, 中心核居中。第16天呈椭圆形, 后端基叶快速生长使中心核相对位置向前侧微偏移。第22天外部形态明显变化, 后端基叶突出成锲形状晶状突, 中心核相对位置向前端偏移, 仍处于背腹中部。第29天呈梭形,背腹部基本对称, 外缘略圆凸, 后端基叶变薄成略尖的晶状突, 前端呈薄的桡片状。第42天耳石明显向背侧方向弯曲, 后端基叶向后快速延伸变得细长且背侧平直, 腹侧翼叶变宽并出现隆起的嵴。第 52天耳石整体较之前平直, 后端翼叶生长使基叶变宽,末端尖锐, 前端腹侧翼叶开始出现缺刻。第 62天及以后, 耳石呈箭矢状, 前后端腹侧翼叶缺刻加深, 后端基叶背侧平直, 与小凸起的翼叶之间形成内凹。
星耳石 星耳石形状总体不规则(图1)。出膜后第16天星耳石开始出现, 心形, 中心核有明显的小黑色素团。至第29天耳石变成不规则四边形, 中心核相对位置明显偏移。至42d时外形近似半圆形,外缘开始出现微凸的嵴。52d以后近似扇形, 外缘有凸起的嵴3—4个, 随发育缺刻凹入更深成星芒状。
2.2 耳石微结构
微耳石和矢耳石的中心核及原基 统计表明,每对耳石左侧和右侧的中心核和原基数无显著差异(P>0.05), 左右耳石混合后各组合类型所占比例见表 1。多数耳石上具有一个近圆形的生长中心即中心核, 其内深黑色的圆点为耳石原基(图2)。在微耳石、矢耳石和星耳石上具有1个中心核和1个原基的比例分别为71.07%、67.18%和74.19%, 具1个中心核和 2个原基的比例分别为 18.95%、15.64%和18.28%, 在微耳石和矢耳石中有1个中心核和3个原基的分别占 6.48%和 11.03%, 星耳石中则仅有1.08%, 其他类型出现几率则较低。

表1 具有不同中心核和原基数的耳石在3种耳石中的比例Tab.1 The proportions of otoliths with different numbers of nucleus and primordium among sagitta, lapillus and asteriscus

图2 中心核或原基数目不同的骨唇黄河鱼耳石Fig. 2 Otoliths with different numbers of nuclei or primordia in C. labiosa

图3 骨唇黄河鱼仔稚鱼耳石轮纹Fig. 3 Increments of otolith of larvae and juvenile in C. labiosa
微耳石中心核面积(162.8±36.51) µm2, 长直径变幅为11.43—16.65 µm, 平均(13.89±1.46) µm (n=32),短直径变幅为7.01—13.89 µm, 平均(10.93±1.83) µm (n=32)。矢耳石中心核面积(230.17±40.16) µm2, 长直径12.38—20.54 µm, 平均(17.50±2.25) µm(n=33),短直径10.25—17.33 µm, 平均(13.83±1.88) µm(n=33)。
耳石轮纹特征 初孵仔鱼微耳石和矢耳石上均未观察到轮纹, 岀膜后第 2天出现第一个轮纹。29日龄仔鱼微耳石出现28轮纹(图3a), 21日龄仔鱼矢耳石出现20轮纹(图3b)。统计结果发现, 微耳石(Increment number of lapillus, IL)和矢耳石(Increment number of sagitta, IS)的轮纹数与出膜后的天数(Days post hatching, D)呈线性相关(图4), 回归方程分别为: IL=0.9911D-1.0008(R2=0.9971, n=220, P<0.001)(图4a)和IS=0.9925D-0.10873(R2=0.9919, n=161, P<0.001) (图 4b)。经检验, 关系式中的斜率与 1均无显著差异(P>0.05), 表明两对耳石的轮纹沉积呈日周期性,生长轮为日轮。
轮间距 对30日龄仔鱼微耳石(n=22)和矢耳石(n=20)的轮纹间距进行了测量, 确证了轮纹间距与轮纹增量间(距耳石生长中心的轮纹数)的关系。结果表明, 随着轮纹沉积, 轮纹间距有增大的趋势,但在第 6轮附近轮纹间距相对较宽, 其中微耳石最大平均宽度为(2.25±0.11) μm(图 5a), 矢耳石为(3.12±0.25) μm(图5b)。
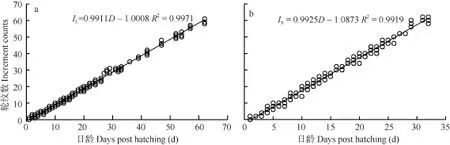
图4 骨唇黄河鱼微耳石(a)和矢耳石(b)轮纹数与日龄的关系Fig. 4 Relationship between increment counts and days post hatching of lapillus (a) or sagitta (b) in C. labiosa
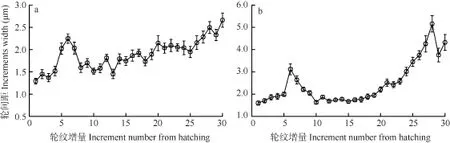
图5 骨唇黄河鱼微耳石(a)和矢耳石(b)轮纹间距与轮纹增量间的关系Fig. 5 Relationship between increment width and increment number of lapillus (a) and sagittal (b) in C. labiosa. Bars indicate standard deviation
2.3 耳石的生长特征
耳石的生长 以耳石核为中心分别测量了微耳石和矢耳石前区(Otolith radius of anterior in lapillus, OAL, Otolith radius of anterior in sagitta, OAS)、后区(OPL, OPS)、背区(ODL, ODS)和腹区(OVL, OVS)的半径。结果表明, 微耳石和矢耳石前区半径(OAL, OAS)和后区半径(OPL, OPS)与出膜时间(D)呈指数相关(图6a、c), 而背区半径(ODL, ODS)和腹区半径(OVL, OVS)与出膜时间(D)呈幂函数相关(图6b、d)。研究也发现, 两对耳石前后轴方向后区的生长快于前区(P<0.05); 在背腹轴方向上微耳石腹区的生长快于背区(P<0.05), 矢耳石背区的生长快于腹区(P<0.05)。
耳石长度与全长的关系 微耳石(Otolith length of lapillus, OLL)和矢耳石(Otolith length of sagitta, OLS)长度(前区和后区半径之和)与全长(Total length, TL)均呈线性相关(如图 7), 回归方程分别为: OLL=118.29TL+6.9919(R²=0.9683, n=212, P<0.001) (图 7a)和 OLS=71.656TL+8.3292(R²=0.9654, n=212, P<0.001)(图7b)。
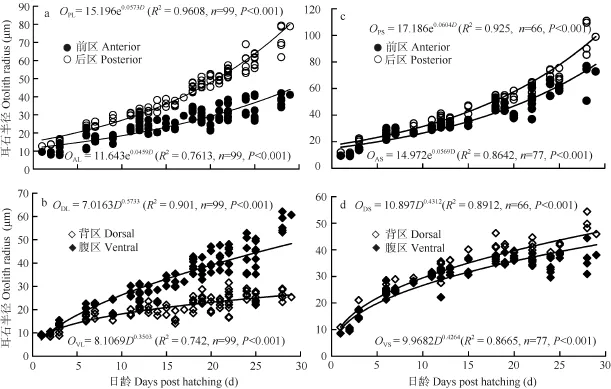
图6 骨唇黄河鱼耳石微耳石(a, b)和矢耳石(c, d)半径与出膜时间的关系Fig. 6 Relationship between otolith radius of different area in lapillus (a, b) or sagitta (c, d) and days post hatching in C. labiosas
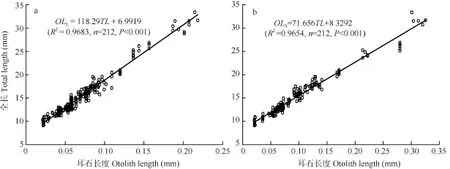
图7 骨唇黄河鱼微耳石(a)和矢耳石(b)长度(前区和后区半径之和)与全长的关系Fig. 7 Relationship between length (the sum length of radius anterior and posterior in otolith ) of lapillus (a) or sagitta (b) and total length in C. labiosa
3 讨论
3.1 耳石的形态发育
本研究中骨唇黄河鱼的微耳石由近圆形发育成贻贝形, 整体形态变化不大。而叉尾斗鱼(Macropodus opercularis)的微耳石刚出现时为不规则的小型结晶体, 然后逐渐沉积为圆盘状, 孵出后7d转变为近椭圆形, 孵出后19d转变为中部圆凸两端较尖的菱形[18]。出膜前唐鱼(Tanichthys albonubes)的微耳石形状不规则, 含有一些结晶状物质, 孵出时仔鱼的微耳石通常为圆盘状, 第 16天后转变为近似椭圆形,30d后转变为梨形[19]。鲢(Hypophthalmichthys molitrix)、草鱼(Ctenopharynodon idellus)和鳙(Aristichthys nobilis)的微耳石形态相对稳定, 经历圆形、豆形、长豆形到腰部形成一缢部的锲形[20]。这些结果表明,鱼类微耳石早期形态相对稳定, 其发育受生理活动和环境变化等的影响不大。
研究也表明, 骨唇黄河鱼的矢耳石由初孵仔鱼的圆形或近圆形, 经过椭圆形、菱形, 最后渐变为前端长尖后端圆钝的长箭矢形, 形态变化明显。唐鱼仔鱼矢耳石发育经历了前端较尖、后端圆钝、中间呈卡腰状的发育阶段[19], 鸭绿江香鱼(Flecoglossus altivelis)矢耳石则经历了圆锥形的发育过程[21]。鳙的矢耳石由前端伸长变尖, 后端圆钝的菱形, 最后形成中部两侧有薄片状突出的箭矢形; 鲢经历了一端长尖, 另一端长圆, 中部两侧有薄片状突出的长菱形状的发育过程[22]。胭脂鱼(Myxocyprinus asiaticus)矢耳石的中间发育过程包括纺锤形, 后端梨形, 前端钝圆等几个阶段[8]。这些研究结果表明, 淡水鲤形目鱼类的矢耳石形态发育过程大致相似, 但也表现出一定的种类特异性。
3.2 耳石轮纹出现及日增量
鱼类耳石上第一日轮的形成时间存在种间差异,与环境条件有一定的关系。如蓝罗非鱼(Oreochromis aureus)[23]和白鲑(Coregonidae coregonus)[24]矢耳石第一日轮在孵化前形成, 但大多数鱼类在孵化后出现。黑鲷(Acanthopagrus schlegeli)[25]、狭鳕(Theragra chalcogramma)[26]以及黑鲈(Micropterus salmoides)[27]孵化时形成, 南方鲇(Silurus meridionalis)[28]和白仔鳗(Temmincket Schlegel)[29]于孵化后24h内出现, 尼罗罗非鱼(Oreochromis niloticus)[30]、草鱼和大银鱼(Protosalanx hyalocranius)[31]在出膜后第2天可见第一日轮, 梭鱼(Chelon haematocheilus)却在第3天出现[32]。此外, 耳石第一条日轮的形成受摄食等因素的影响[33,34], 如遮目鱼(Chanos chanos)[35]第一日轮形成与内源性营养转换有关, 竹荚鱼(Trachurus japonicus)则与开口摄食有关[36]。由此可见, 耳石第一日轮出现与鱼类早期发育阶段的一些重要事件相关联。本实验中骨唇黄河鱼仔鱼微耳石和矢耳石在刚孵化出膜时均未出现轮纹, 第 2天才出现第一个轮纹。通过对耳石轮纹数的统计发现, 微耳石和矢耳石的轮纹数与日龄呈线性相关, 其斜率与 1均无显著差异(P>0.05), 表明其耳石轮纹沉积呈日周期性, 生长轮为日轮。这与胭脂鱼[8]、唐鱼[19]和南方鲇[28]等鱼类的观察结果一致。
3.3 耳石生长特征
耳石的形态发育和轮纹特征可以和个体发育过程以及栖息环境变化等事件相对应[14]。因此, 在建立鱼类早期生长发育过程与耳石形态和微结构关系基础上, 可以通过耳石形态结构分析研究个体的早期生长发育特点、环境状况以及种群补充等关键问题[36,37]。本实验表明, 30日龄前骨唇黄河鱼微耳石和矢耳石在前后轴和背腹轴方向的生长速度存在明显差异, 其中前后区呈指数增长, 背腹区为幂函数生长。总体来看, 耳石前后区半径之和与全长均呈显著的线性相关, 说明微耳石和矢耳石形态变化与仔稚鱼的生长发育状况关系密切。
本研究发现, 与安邦雀鲷(Pomacentrus amboinensis)[38]和绿刺尾鲷(Acanthurus triostegus)[39]等轮纹宽度呈现了由窄到宽的规律不同, 骨唇黄河鱼微耳石和矢耳石的轮纹宽度在出膜后 6d左右突然增大, 这刚好与仔鱼营养转换的时间点相吻合, 由此推断二者之间可能存在一定的关联[19,40]。这表明耳石的轮纹间距等微结构特点能反映鱼类早期生活史中的一些发育事件。
[1] Degens E T, Deuser W G, Haedrich R L. Molecular structure and composition of fish otoliths [J]. Marine Biology, 1969, 2(2): 105—113
[2] Popper A N, Fay R R, Platt C. Sound detection mechanisms and capabilities of teleost fishes [A]. In: Collin S P, Marshall N J (Eds.), Sensory Processing in Aquatic Environments [C]. New York. Springer-Verlag. 2003, 3—38
[3] Capoccioni F, Costa C, Aguzzi J, et al. Ontogenetic and environmental effects on otolith shape variability in three Mediterranean European eel (Anguilla anguilla, L.) local stocks [J]. Journal of Experimental Marine Biology and Ecology, 2010, 397(1): 1—7
[4] Vignon M, Morat F. Environmental and genetic determinant of otolith shape revealed by a non-indigenous tropical fish [J]. Marine Ecology Progress Series, 2010, 411: 231—241
[5] Parmentier E, Vandewalle P, Lagardère F. Morpho-anatomy of the otic region in carapid fishes: eco-morphological study of their otoliths [J]. Journal of Fish Biology, 2001, 58(4): 1046—1061
[6] Lord C, Morat F, Lecomte-Finiger R, et al. Otolith shape analysis for three Sicyopterus (Teleostei: Gobioidei: Sicydiinae)species from New Caledonia and Vanuatu [J]. Environmental Biology of Fishes, 2012, 93(2): 209—222
[7] Pannella G. Fish otoliths: daily growth layers and periodical patterns [J]. Science, 1971, 173(4002): 1124—1127
[8] Song Z B, Fu Z D, Li J, et al. Validation of daily otolith increments in larval and juvenile Chinese sucker, Myxocyprinus asiaticus [J]. Environmental Biology of Fishes, 2008, 82(2): 165—171
[9] Yamada H, Chimura M, Asami K, et al. Otolith development and daily increment formation in laboratory-reared larval and juvenile black-spot tuskfish Choerodon schoenleinii [J]. Fisheries Science, 2009, 75(5): 1141—1146
[10] Joh M, Matsuda T, Satoh N, et al. Otolith microstructure of brown sole Pseudopleuronectes herzensteini: validation of daily ring formation and the occurrence of microstructure denoting metamorphosis [J]. Fisheries Science, 2011, 77(5): 773—783
[11] Vignon M. Ontogenetic trajectories of otolith shape during shift in habitat use: Interaction between otolith growth and environment [J]. Journal of Experimental Marine Biology and Ecology, 2012, 420—421: 26—32
[12] Correia A T, Able K, W Antunes C, et al. Early life history of the American conger eel (Conger oceanicus) as revealed by otolith microstructure and microchemistry of metamorphosing leptocephali [J]. Marine Biology, 2004, 145(3): 477—488
[13] La Mesa M. The utility of otolith microstructure in determining the timing and position of the first annulus in juvenile Antarctic toothfish (Dissostichus mawsoni) from the South Shetland Islands [J]. Polar Biology, 2007, 30(10): 1219—1226
[14] Campana S E. Otolith science entering the 21st century [J]. Marine and Freshwater Research, 2005, 56(5): 485—495
[15] Yue P Q, Shan X H, Lin R D, et al. Fauna Sinica: Osteichthyes Cypriniformes Ш [M]. Beijing: Science Press. 2000, 385—386 [乐佩琪, 单乡红, 林人端, 等. 中国动物志硬骨鱼纲鲤形目(下卷). 北京: 科学出版社. 2000, 385—386]
[16] Ding R H. The Fishes of Sichuan, China [M]. Chengdu: Sichuan Publishing House of Science & Technology. 1994, 370—371 [丁瑞华. 四川鱼类志. 成都: 四川科学技术出版社. 1994, 370—371]
[17] Zhu Q, Xia L Q, Chang J B. Computer identification on otolith microstructure of fish [J]. Acta Hydrobiologica Sinica, 2002, 26(6): 600—604 [朱旗, 夏立启, 常剑波. 鱼类耳石微结构的计算机自动识别. 水生生物学报, 2002, 26(6): 600—604]
[18] Zhao T, Chen G Z, Lin X T. Otolith ontogeny and increment formation of larval Macropodus opercularis [J]. Journal of Fishery Sciences of China, 2010. 17(6): 1364—1370 [赵天,陈国柱, 林小涛. 叉尾斗鱼仔鱼耳石形态发育与日轮形成特征. 中国水产科学, 2010, 17(6): 1364—1370]
[19] Shi F, Sun J, Lin X T, et al. Otolith ontogeny and increment formation in larval Tanichthys albonubes [J]. Chinese Journal of Zoology, 2006, 41(4): 10—16 [史方, 孙军, 林小涛, 等. 唐鱼仔鱼耳石的形态发育及日轮. 动物学杂志, 2006, 41(4): 10—16]
[20] Zeng X B. Studies on otolith mophology in larval-young silver carp, big head, and grass carp with the application in species discrimination [D]. Thesis for Master of Science, Huazhong Agricultural University, Wuhan. 2001 [曾祥波.鲢、鳙和草鱼仔幼鱼耳石形态及种类鉴别中的应用. 硕士学位论文, 华中农业大学, 武汉. 2001]
[21] Xie Y H, Li B, Fu L J, et al. On daily-growth increment of otolith and growth of ayu fish from Yalüjiang River [J]. Acta Zoologica Sinica, 1995, 41(2): 125—133 [解玉浩, 李勃, 富丽静, 等. 鸭绿江香鱼耳石日轮与生长的研究. 动物学报, 1995, 41(2): 125—133]
[22] Xie Y H, Li B, Fu L J, et al. Daily growth increment in otolith and growth for fry-young fish of bighead (Aristichthys nobilis) [J]. Journal of Fishery Sciences of China, 1995, 2(2): 34—42 [解玉浩, 李勃, 富丽静, 等. 鳙仔-幼鱼耳石日轮与生长的研究. 中国水产科学, 1995, 2(2): 34—42]
[23] Karakiri M, Hammer C. Preliminary notes on the formation of daily increments in otoliths of Oreochromis aureus [J]. Journal of Applied Ichthyology, 1989, 5(2): 53—60
[24] Eckmann R, Rey P. Daily increments on the otoliths of larval and juvenile Coregonus spp., and their modification by environmental factors [J]. Hydrobiology, 1987, 148(2): 137—143
[25] Huang W B, Chiu T S. Daily increments in otoliths and growth equation of black porgy, Acanthopagrus schlegeli, larvae [J]. Acta Zoologica Taiwanica, 1997, 8(2): 121—131
[26] Nishimura A, Yamada J. Age and growth of larval and juvenile walleye pollock, Theragra chalcogramma (Pallas), as determined by otolith daily growth increments [J]. Journal of Experimental Marine Biology and Ecology, 1984, 82(2—3): 191—205
[27] Miller S J, Storck T. Daily growth rings in otoliths of young-of-the-year largemouth bass [J]. Transactions of the American Fisheries Society, 1982, 111(4): 527—530
[28] Yang F, Peng W H. A study of the daily growth increment of otoliths in the larvae and juvenile of Silurus slidatovi meridionalls Chen [J]. Journal of southwest Agricultural University, 2001, 23(4): 340—342 [杨帆, 彭文辉. 南方鲇仔幼鱼耳石日轮的研究. 西南农业大学学报, 2001, 23(4): 340—342]
[29] Li C H, Sha X S. Periodicity of increment formation in the otoliths of laboratory-reared Anguilla Japonica larvae [J]. Oceanologia et Limnologia Sinica, 1995, 26(4): 408—413 [李城华, 沙学绅. 日本鳗鲡早期阶段耳石日生长轮形成的周期. 海洋与湖沼, 1995, 26(4): 408—413]
[30] Zhang Z, Runham N W. Otolith microstructure pattern in Oreochromis niloticus (L.) [J]. Journal of Fish Biology, 1992, 40(3): 325—332
[31] Fu L J, Xie Y H, Li B, et al. Studies on daily-growth increment of otolith and growth of Lare Icefish [J]. Journalof Fishery Sciences of China, 1997, 4(2): 21—27 [富丽静,解玉浩, 李勃, 等. 大银鱼耳石日轮与生长的研究. 中国水产科学, 1997, 4(2): 21—27]
[32] Li C H, Sha X H, You F, et al. Daily growth increments in otoliths of Mullet larvae Mugil so-iuy basilewsky and determination from field-collected ones [J]. Oceanologia et Limnologia Sinica, 1993, 24(4):345—349 [李城华, 沙学绅,尤锋, 等. 梭鱼仔耳石日轮形成及自然种群日龄的鉴定.海洋与湖沼, 1993, 24(4): 345—349]
[33] Morley S A, Belchier M, Dickson J, et al. Daily otolith increment validation in larval mackerel icefish, Champsocephalus gunnari [J]. Fisheries Research, 2005, 75(1—3): 200—203
[34] Høie H, Folkvord A, Johannessen A. Maternal, paternal and temperature effects on otolith size of young herring (Clupea harengus L.) larvae [J]. Journal of Experimental Marine Biology and Ecology, 1999, 234(2): 167—184
[35] Tzeng W N, Yu S Y. Daily growth increments in otoliths of milkfish, Chanos chanos (Forsskål), larvae [J]. Journal of Fish Biology, 1988, 32(4): 495—504
[36] Xie S G, Watanabe Y. Transport-determined early growth and development of jack mackerel Trachurus japonicus juveniles immigrating into Sagami Bay, Japan [J]. Marine & Freshwater Research, 2007, 58(11): 1048—1055
[37] Ma Q Y, Xue Y, Xu B D, et al. Relationships between otolith size and fish size for twelve prey fish species from Jiaozhou Bay [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 481—487 [麻秋云, 薛莹, 徐宾铎, 等. 胶州湾12种饵料鱼类耳石大小与体长的关系. 水生生物学报, 2013, 37(3): 481—487]
[38] Wilson D T, McCormick M I. Microstructure of settlementmarks in the otoliths of tropical reef fishes [J]. Marine Biology, 1999, 134(1): 29—41
[39] McCormick M I. Delayed metamorphosis of a tropical reef fish (Acanthurus triostegus): a field experiment [J]. Marine Ecology Progress Series, 1999, 176: 25—38
[40] Song Z B, Chang J B, Cao W X. Natural checks and clarity of increments in larval grass carp (Ctenop haryngodon idellus) otoliths [J]. Acta Zoologica Sinica, 2003, 49(4): 508—513 [宋昭彬, 常剑波, 曹文宣. 草鱼仔鱼耳石的自然标记和生长轮的清晰度. 动物学报, 2003, 49(4): 508—513]
STUDY ON THE OTOLITH DEVELOPMENT AND THE FORMATION OF INCREMENTS IN LARVAE AND JUVENILE OF CHUANCHIA LABIOSA
Daily observations were made on the morphological development and the growth in increments of the otolith in larvae and juvenile of Chuanchia labiosa in rearing conditions. The sagitta and the lapillus appeared at 96h and 30min after the fertilization, and the asteriscus first appeared at 16 days post hatching. The shape of the sagitta was rounded at hatching and gradually changed into long elliptical with a long pointy posterior in the end. The lapillus was also rounded at hatching, and changed into a mussel shape at the end of the experiment. Compared to the sagitta and the lapillus, the shape of the asteriscus remained mussel-like and was relatively stable during the development. We compared the data of the radius of the dorsal, ventral, anterior and posterior areas in the sagitta and the lapillus. It showed that in the lapillus the growth of the posterior was faster than that of the anterior (P<0.05), and the ventral grew faster than the dorsal (P<0.05); in the contrast the dorsal grew faster than the ventral in the sagitta (P<0.05). The combined length of the radius of the anterior and the posterior of the sagitta was linearly related to the total length of the larvae and the juvenile, and the same was observed in the lapillus. The first increment on the sagitta and the lapillus appeared on the second day post hatching and from then on there was one new increment formed every day. The number of increments on the lapillus (IL) and the sagitta (IS) showed a linear relationship with the number of days post hatching (D), with the equations of IL=0.9911D–1.0008 (R2=0.9971, n=220, P<0.001) and IS=0.9925D–0.10873 (R2=0.9919, n=161, P<0.001), respectively. The slopes of the equations were statistically close to 1.0 (P>0.05). These results suggested that the number of the otolith increments increased by 1 on a daily basis. Our study contributed to the understanding in the development of C. labiosa, as well as in its early life history in the natural environment.
Otoliths; Morphology development; Daily increments; Growth; Chuanchia labiosa
YAN Tai-Ming, HU Jia-Xiang, YANG Ting, ZHAO Liu-Lan and HE Zhi
(College of Animal Science and Technology, Sichuan Agricultural University, Ya’an 625014, China)
Q174
A
1000-3207(2014)04-0764-08
10.7541/2014.107
2013-12-18;
2014-02-19
农业部淡水鱼类种质资源与生物技术重点开放实验室开放课题LFB20070609资助
严太明(1972—), 男, 四川万源人; 理学博士; 主要研究方向为鱼类生态学; E-mail: yantaiming@sina.com
何智, E-mail: hezhisicau@aliyun.com
