植物油脂DNA 提取方法研究进展
2014-03-27朱立娜陈士华吴兴泉
朱立娜,陈士华,吴兴泉
(河南工业大学 生物工程学院,河南 郑州 450001)
0 引言
近年来,食品安全问题引起人们的广泛关注,频频爆发的食品安全事件也使其成为亟需解决的问题.在食用植物油脂领域同样存在安全问题,例如地沟油、掺伪掺劣油、食用调和油标识混乱、转基因油脂标识等.在食用植物油脂生产消费过程中出现的这些安全问题不仅对消费者的身体健康造成威胁,同时也损害了消费者的合法权益,破坏消费者的消费信心,影响了食用油市场的良性发展.
以DNA 为靶标的分子生物学检测技术可应用于食用植物油脂的纯度测定、掺伪检测、转基因检测等,与以脂肪酸、特定代谢物等为靶标的其他检测方法相比,分子生物学检测技术更加稳定、可靠.因为脂肪酸、特定代谢物等会随着油料作物的生长环境、栽培条件等因素的改变而发生变化,其含量并不恒定,以此为靶标会给检测结果带来偏差.而DNA 作为生物遗传物质其含量稳定不会受到外界环境条件的影响,以此为靶标的检测方法更具有稳定性.
DNA 的富集与有效提取是分子生物学检测技术在食用植物油脂检测中应用的前提.由于DNA在食用植物油脂的加工过程中受破坏严重,且含量很低,因此提取难度很大.目前,关于食用油DNA 的提取方法,已有很多报道[1-4],但大多为压榨油脂.与精炼油有所不同,初级压榨油不经过特殊的加工工艺处理,DNA 保存相对完整,残留量相对较多,因此DNA 提取较精炼油更容易.如Pauli等[5]于粗制的大豆油中提取到DNA,Matteo Busconi等[6]从压榨橄榄油中提取到DNA 并利用其对生产品种进行了鉴定,覃文等[7]早在2002 年就从市售的食用油中提取到了DNA 并检测到了植物内源基因.尽管应用于植物油脂DNA 提取的方法已有较多报道,但目前尚未见到对植物油脂DNA 提取方法进行综合评价、全面评述的文章.
将现有的油脂DNA 提取技术进行比较,选择更高效快速的提取技术以及对现有的提取技术进行适当的优化以提高DNA 提取效果已成为当前研究的重点.笔者全面介绍了目前应用于植物油脂DNA 提取的方法,并进行了综合评价,以期为开展深入研究提供参考.
1 植物油脂DNA 提取方法
1.1 十六烷基三乙基溴化铵(CTAB)法
1.1.1 CTAB 法原理
CTAB 法是油脂DNA 提取中应用最为普遍的方法,CTAB 不仅可以裂解细胞,同时又能很好地去除多酚类、糖类等物质.CTAB 是一种阳离子去污剂,能够与核酸形成复合物,该复合物在低盐条件下溶解度降低而沉淀,在高盐条件下解离,从而使DNA 与多糖等物质分开,最后用乙醇沉淀DNA,除去CTAB,获得纯化DNA.
所用缓冲溶液为Tris-HCl(pH 8.0),缓冲溶液可提供一个缓冲环境防止核酸被破坏;EDTA 螯合Mg2+或Mn2+离子,抑制DNase 活性;NaCl 提供一个高盐环境,使DNP 充分溶解于液相中;CTAB 可溶解细胞膜并结合核酸,使核酸便于分离.PVP(聚乙烯吡咯烷酮)能与多酚形成一种不溶的络合物,也能与多糖结合,从而有效地去除多酚、多糖类物质,降低DNA 的污染.
1.1.2 CTAB 法在植物油脂DNA 提取中的应用
CTAB 提取法能够有效地去除多糖及酚类物质,更适用于提取富含酚类及糖类物质的植物材料的DNA.为了缩短提取流程,提高提取质量,更适合于植物油脂中DNA 的提取,研究人员对CTAB 法进行了改良[8].通过向CTAB 提取缓冲液中加入PVP 和巯基乙醇,经酚/三氯甲烷抽提,最后用异丙醇和醋酸铵沉淀油脂中的DNA,取得了不错的效果[9].Innocenzo Muzzalupo 等[4]利用改良CTAB 法从橄榄油中提取出了纯度较高的DNA,其改良方法中添加了蛋白酶K,并且在缓冲液中加入2%的β-巯基乙醇,这样可使蛋白质充分降解,也可去除残留的酚类物质,保护DNA 的完整性,使其能够成功应用到后续的PCR 检测技术当中.Matteo Busconi 等[6]采用提高CTAB 浓度的方法,并使用三氯甲烷/辛醇代替三氯甲烷/异戊醇来抽提,提高了橄榄油中DNA 的提取效率.
1.1.3 CTAB 法的特点
CTAB 法操作相对于其他DNA 手提方法简单,且成本较低,所使用的试剂及仪器很容易操作和获得,实验室普遍适用.但是此方法耗时较长,容易在提取过程中对DNA 造成破坏及损失,而且提取过程中所用试剂部分有毒,例如:三氯甲烷、酚等,因此,在食用油DNA 提取方面,CTAB 法存在一定的缺陷,具有局限性.
1.2 十二烷基磺酸钠(SDS)法
1.2.1 SDS 法原理
SDS 是一种阴离子去污剂,高温条件下可以裂解细胞、使蛋白质变性、染色体离析,同时可与多糖、蛋白质等物质形成复合物,使核酸释放出来.通过降低温度,提高盐浓度,使SDS-蛋白质复合物溶解度减小,以此来实现蛋白质、多糖物质的沉淀,进而用酚/氯仿抽提上清液,乙醇沉淀DNA.
常规SDS 提取液由Tris-HCl、EDTA、NaCl、SDS和巯基乙醇配制而成.最初SDS 法主要应用在植物DNA 的提取上,后来经过改进,现在其应用范围更广,且DNA 的提取质量和效率也在不断提高.
1.2.2 SDS 方法在植物油脂DNA 提取中的应用
依据植物油脂特殊的性质及特点,对SDS 方法进行改良,可以提取到质量较高的DNA.Maja Hellebrand 等[10]应用SDS 法从菜籽油中成功地提取到DNA,他们在预处理过的菜籽油中加入SDS 缓冲液的同时加入蛋白酶K,经酚/氯仿抽提后用乙醇沉淀DNA,取得了良好的效果.姚菲等[11]也运用改良的SDS 法在茶籽油中成功提取到了茶籽DNA,在预热的巯基乙醇和SDS 缓冲液中加入钾盐提高盐浓度,以便使SDS-蛋白质复合物溶解度更小,以此来沉淀蛋白质、多糖等物质,最后用氯仿/异戊醇抽提,乙醇漂洗、TE 溶解富集DNA.
1.2.3 SDS 法的特点
SDS 法操作相对温和简单,也可以提取到较完整的DNA,但所提DNA 杂质较多,质量不高,也有报道称CTAB 法所提DNA 的品质要高于SDS 法[12-14].
1.3 高盐低pH 法
1.3.1 高盐低pH 法原理
高盐低pH 法利用高盐沉淀蛋白质,低pH 介质能够有效防止细胞破碎及沉淀大量材料时的电离化作用及酚化合物的进一步氧化,从而保证所提DNA 的质量.
高盐低pH 法的缓冲液通常由NaAC、EDTA、NaCl、PVP、SDS、β-巯基乙醇组成,pH 值为5.5.其酸性条件可避免多酚类物质电离化及进一步氧化,PVP 可结合酚类物质防止DNA 褐化;高浓度Na+有利于SDS 与蛋白质及多糖形成复合物,然后经离心除去,从而彻底去除蛋白质和多糖.DNA 存于上层水相,最后用异丙醇抽提去除残留酚类、蛋白质物质,乙醇漂洗TE 溶解回收DNA.
1.3.2 改良的高盐低pH 法
高盐低pH 法所提的DNA 相对分子质量较高,不但适用于PCR 反应,且可用于RLFP 分析.姚菲等[11]在2012 年利用高盐低pH 法从茶籽油中成功提取到了茶籽DNA.很多研究针对该方法进行改良,通过改变提取缓冲液中β-硫基乙醇的终浓度,增加用酚、氯仿快速抽提的过程,获得了良好的提取效果[15-16],得到的DNA 可满足酶切、PCR等分子生物学分析.
1.3.3 高盐低pH 法的特点
高盐低pH 法在DNA 提取中应用也较广泛,此方法所用的试剂仅有无机盐和异丙醇,而醋酸钾等又是常用的无机盐试剂.而且高盐低pH 法无需反复抽提,因此所需材料相对较少.但高盐低pH 法无法在多糖物质或者次级代谢产物含量高的组织中提取到高质量的DNA,所提取的DNA 中蛋白质污染严重、重复性也不好,因此其应用也存在局限性.
1.4 异硫氰酸胍(GuSCN)法
1.4.1 异硫氰酸胍(GuSCN)法原理
异硫氰酸胍是一种蛋白质变性剂,它可以迅速破坏细胞结构,释放核酸,高浓度的异硫氰酸胍溶液还会使核酸酶变性,防止核酸降解.异硫氰酸胍裂解液(GuSCN 5 mol/L,Tris-HCl 0.1 mol/L,EDTA 0.02 mol/L,pH 8.0)可裂解细胞,释放核酸,Tris-HCl 提供缓冲环境,防止核酸被破坏,EDTA 结合二价金属离子,抑制核酸酶活性.
1.4.2 异硫氰酸胍法在植物油脂DNA 提取中的应用
异硫氰酸胍法不但适用于普通动植物DNA 提取,还适用于经过加工的食用油DNA 提取.Simona Pafundo 等[17]使用Nucleospin Plant 试剂盒(该试剂盒的裂解液中的主要成分之一为异硫氰酸胍)提取橄榄油中的DNA,并将提取的DNA 成功用于AFLP 分析.闻伟刚等[18]在2005 年运用此方法从市售的大豆油中提取DNA,他们用异硫氰酸胍裂解液与大豆油混匀乳化,取水相,加蛋白质沉淀剂离心沉淀蛋白质,氯仿抽提,异丙醇去酚类杂质,离心弃上清,乙醇漂洗收集DNA,但结果发现异硫氰酸胍裂解液与大豆油互溶,因此,其不能用于大豆油DNA 的提取.
1.5 试剂盒法
试剂盒法提取油脂DNA 已经越来越普遍,也是操作最简便、最省时省力的方法.例如油类DNA提取试剂盒,核酸共沉剂法[19]等,特别是QIamp DNA stool kit(QIagen)、Gene Elute Plant Kit(Sigma)、Nucleospin Food 和Nucleospin Plant(Macherey Nagel)已经获得了很好的应用效果.Wizard Genomic DNA Purification Kit(Promega 公司)试剂盒方法,其主要成分为异硫氰酸胍.金红等[20]在2004 年采用DNA 提取试剂盒(中国农科院生物技术研究所)提取大豆色拉油DNA,结果证明充分乳化、反复沉淀以富集小片段DNA、延长醇沉淀时间等措施是从精炼食用油中提取DNA 的关键.通过采取上述措施,可有效地从大豆色拉油中提取到DNA,以此为模板可通过PCR 扩增得到大豆特异内源基因(Lectin 基因).
1.6 其他方法
食用油DNA 提取方法中,除以上比较传统的、应用最为广泛的几种方法外,还有一些针对实验情况,综合各种改进的提取方法,也具有很好的提取效果.
1.6.1 离心柱法及手提法
离心柱法是将树脂或硅胶膜固定在离心管中,在高盐低pH 值条件下,DNA 选择性吸附于离心柱内的树脂或膜上,通过漂洗、离心等步骤,去除蛋白和多糖杂质,最后用低盐高pH 值的洗脱缓冲液将DNA 从树脂或硅胶膜上洗脱.Joana Costa 等[21]使用以离心柱法为原理的Nucleospin DNA 提取试剂盒从精炼油中提取到大豆DNA.
程红梅等[22]在2007 年利用人工手提法和离心柱法提取精炼大豆油中的DNA,研究证明利用人工手提法从500 mL 大豆油中或利用离心柱法从10 mL 大豆油中均可提取获得0.4 μg 高纯度DNA.他们采用的手提法是将正己烷与油脂充分混匀乳化,沉淀离心取水相,硫酸铵沉淀过夜使蛋白质盐析.离心取沉淀,用酚和氯仿抽提,因DNA存在于上清液中,用乙醇漂洗上清液,富集回收DNA.
1.6.2 冷冻干燥法
姚菲等[11]利用冷冻干燥法从茶籽油中提取到茶籽DNA,他们将20 mL 茶籽油与20 mL 无菌水混匀,使DNA 充分溶于水相,取水相-80 ℃冷冻过夜,然后转至真空干燥机干燥至水分完全蒸发,加入CTAB 缓冲液冲洗,与线性丙烯酰胺、NaAc、无水乙醇混匀沉淀DNA,线性丙烯酰胺作为担体提高DNA 提取效率,弃上清液乙醇漂洗DNA,无菌水溶解收集DNA.
1.6.3 磁珠法
磁珠法的原理是将细胞中游离的核酸分子吸附到磁性颗粒表面,蛋白质等杂质留在溶液中.在磁场作用下,磁性颗粒与液体分开,回收颗粒(即磁珠-DNA 混合物),再用洗脱液洗脱即可以得到纯净的DNA.
利用磁珠法提取的DNA 质量高、纯度好,已经被应用于多种复杂及深加工食品的DNA 提取.Wu等[1]比较了Wizard 磁珠纯化试剂盒和CTAB 法对大豆油DNA 的提取效率,发现磁珠法提取DNA 的lectin 基因扩增效率更高.Catherine 等[23]对比Wizard 试剂盒磁珠、硅胶和羟基磷灰石3 种材料吸附提取橄榄油中的DNA,结果发现Wizard 磁珠试剂盒法对橄榄油DNA 提取效果最好,提取的DNA 可用于微卫星分析.磁珠法提取的DNA 相对分子质量高、纯度好、质量可靠,且不需要离心、操作简单、试剂简单,基本达到核酸自动化提取的要求,也是未来核酸提取的发展方向.
1.6.4 担体法
在食用油DNA提取过程中,加入适量的DNA或者RNA等物质作为担体,可以提高DNA的提取效率,且所加担体一般要选择与目的DNA物种关系较远的物种的DNA或者RNA.
覃文等[7]在用异丙醇沉淀油脂DNA 之前加入植物基因组DNA 作为担体,获得良好的提取效果.白立群等[24]在大豆油DNA 富集过程中,比较了以线性丙烯酰胺和鲑鱼精DNA 为担体的效果,发现前者富集的DNA 扩增效率更高.Giménez 等[25]在提取橄榄油DNA 过程中,也使用了线性丙烯酰胺作为担体,且提取效果显著.王澎等[26]在提取大豆油中DNA 过程中,在用无水乙醇沉淀DNA 时加入少量东北大豆黑衣33 号DNA 作为担体,不仅能够提高大豆油中DNA 的得率,而且不会影响转基因检测的结果,从而为转基因深加工产品检测过程中的DNA 提取提供了新的手段.
2 植物油脂DNA 提取方法的综合评价
应用于植物油脂DNA 的提取方法很多,对这些方法的提取效果、成本、复杂度等方面进行全面的综合评价可为今后的研究工作提供指导.姚菲等[11]对高盐低pH 法、改良SDS 法、冷冻干燥法、试剂盒法、手提法进行了对比分析,栾凤侠等[27]比较了CTAB 法和离心柱法提取精炼大豆油DNA 的效果,结果表明离心柱法操作简单快速,提取的DNA质量高,效果显著优于CTAB 法.Andreas Zimmermann 等[28]比较了SDS 法、离心柱法、CTAB 法等9种DNA 提取方法在提取大豆深加工产品中的效果,并从DNA 质量和产量两个方面进行评价.他们发现,离心柱法提取的DNA 质量高、易进行PCR扩增,但提取量相对较低;与之相比,CTAB、SDS 等方法虽然提取的DNA 质量低,含有PCR 抑制剂,但其提取量却较高.Angela Di Pinto 等[29]也发现,试剂盒中采用的磁珠法和离心柱法与CTAB 法和SDS 法相比,含有相对较少的污染物和PCR 抑制剂.对上述植物油脂DNA 提取方法进行综合评价,结果见表1.
虽然CTAB 法和SDS 法提取的DNA 可以满足后续试验要求,但其提取耗时、费力,提取过程中DNA 损失较大,且所提DNA 质量不高,有些提取试剂例如:酚、三氯甲烷有毒,损害操作者的身体健康.因此,其使用有一定的缺陷.磁珠法和离心柱法多被应用于提取试剂盒,除去了三氯甲烷、酚等有毒试剂,操作安全可靠,且提取的DNA 质量较好,用时较短、操作简便、但成本高.冷冻干燥法及乳化法操作步骤简单,提取过程中DNA 损失量少,富集程度较好.
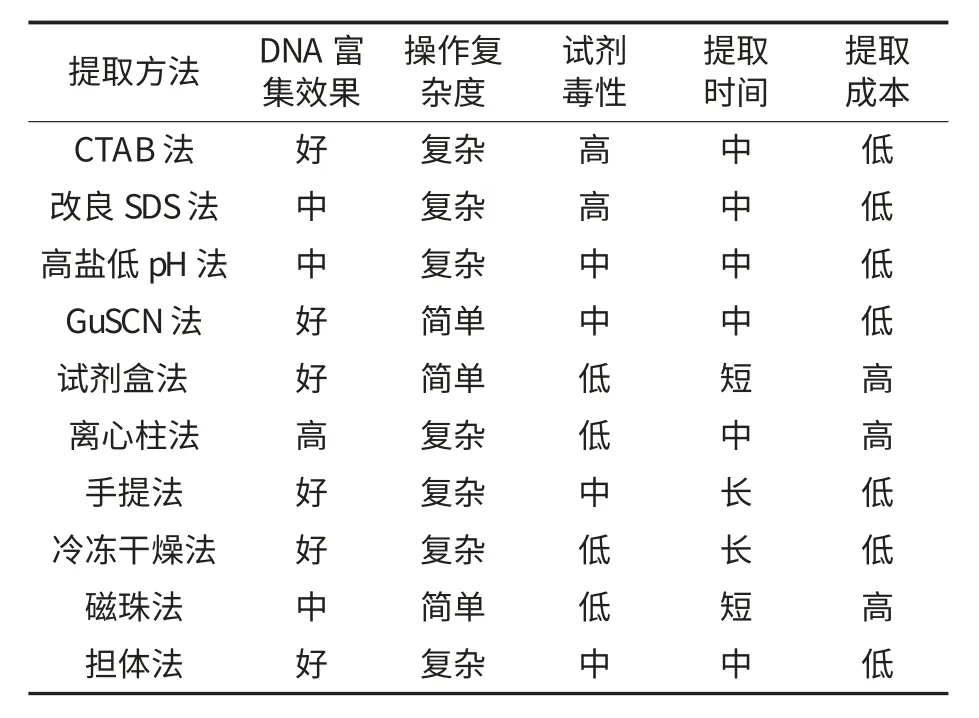
表1 植物油脂DNA提取方法的综合比较
[1]Wu Yajun,Chen Ying,Ge Yiqiang,et al.Detection of olive oil using the Evagreen realtime PCR method[J].Eur Food Res Technol,2008,227:1117-1124.
[2]Rayda Ben Ayed,Naziha Grati-Kamoun,Fabienne Moreau,et al.Comparative study of microsatellite profiles of DNA from oil and leaves of two Tunisian olive cultivars[J].Eur Food Res Technol,2009,229:757-762.
[3]Innocenzo Muzzalupo,Massimiliano Pellegrino,Enzo Perri.Detection of DNA in virgin olive oils extracted from destoned fruits[J].Eur Food Res Technol,2007,224:469-475.
[4]Innocenzo Muzzalupo,Enzo Perri.Recovery and characterisation of DNA from virgin olive oil[J].Eur Food Res Technol,2002,214:528-531.
[5]Pauli U,Liniger M,Zimmermann A.Detection of DNA in soybean oil [J].Z Lebensm Unters Forsch A,1998,207:264-267.
[6]Matteo Busconi,Chiara Foroni,Massimiliano Co-rradi,et al.DNA extraction from olive oil and its use in the identification of the production cultivar[J].Food Chemistry,2003,83:127-134.
[7]覃文,董洁,邓鸿铃,等.PCR 法定性检测食用油脂中转基因成分[J].中国油脂,2002,27(2):4-6.
[8]张海亮,吴亚君,陈银基,等.食用油中DNA提取方法的研究进展[J].食品与发酵工业,2010(11):128-132.
[9]王亚.食用油DNA 提取方法及转基因成分检测技术的研究[D].合肥:安徽大学,2007.
[10]Hellebrand M,Nagy Marion,Morsel Jorg -Thomas.Determination of DNA traces in rapeseed oil[J].Z Lebensm Unters Forsch A,1998,206:237-242.
[11]姚菲,周慧,吴苏喜.茶籽油DNA 提取方法的比较[J].粮油食品科技,2012,20(3):17-19.
[12]易干军,于晓英,霍合强,等.香蕉种质资源的AFLP 鉴别与分类中DNA 模板的制备[J].果树学报,2001,18(6):345-348.
[13]王彩虹,王倩,戴洪义,等.苹果基因组AFLP分析的DNA 模板的制备及技术体系的建立[J].山东农业大学学报:自然科学版,2001,32(2):197-200.
[14]周明芹.SDS 法和CTAB 法提取蜡梅DNA 质量的比较[J].长江大学学报:自然科学版,2009,6(3):42-44.
[15]裴黎,牛慧媛,涂政,等.改良高盐低pH 方法提取陈旧大麻DNA 初探[J].中国法医学杂志,2009,24(3):145.
[16]刘少林,靖深蓉,郭立平,等.用改进的高盐低pH 法分离和纯化棉花叶绿体及叶绿体DNA[J].棉花学报,1997,9(5)∶239-241.
[17]Simona Pafundo,Matteo Busconi,Caterina Agrimonti,et al.Storage-time effects on olive oil DNA assessed by Amplified Fragments Length Polymorphisms[J].Food Chemistry,2010,123:787-793.
[18]闻伟刚,崔俊霞,赵秀玲.大豆油中转基因成分的Nested PCR 和Semi-nested PCR 检测方法研究[J].生物技术通报,2005(6):84-87.
[19]邓鸿铃,覃芳芳,郭新东,等.食用大豆油中转基因成分的检测[J].中国油脂,2007,32(8):79-81.
[20]金红,程奕,赵昕,等.大豆色拉油中转基因成分检测技术研究[J].华北农学报,2004,19(1):24-27.
[21]Joana Costa,Isabel Mafra,Joana S Amaral,et al.Detection of genetically modified soybean DNA in refined vegetable oils[J].Eur Food Res Technol,2010,230:915-923.
[22]程红梅,彭于发,金芜军,等.一种快速、简便提取大豆油DNA 的方法及转基因大豆油的检测[J].中国农业科学,2007,40(5):1069-1072
[23]Breton C,Claux D,Metton I,et al.Comparative study of methods for DNA preparation from olive oil samples to identify cultivar SSR alleles in commercial samples:possible forensic applications[J].J Agric Food Chem,2004,52:531-537.
[24]白立群,吴亚君,韩建勋.一种有效的大豆精炼油DNA 提取新方法—冷冻干燥法[J].食品与工业发酵,2009,35(12):155-159.
[25]Maria J Giménez,Fernando Pistón,Antonio Martín,et al.Application of real-time PCR on the development of molecular markers and to evaluate critical aspects for olive oil authentication[J].Food Chemistry,2010,118:482-487.
[26]王澎,金丽晨,耿志明,等.食用大豆油中DNA 的快速提取和转基因成分定性检测[J].江苏农业学报,2008,24(6):940-943.
[27]栾凤侠,张洪祥,白月.食用油脂中DNA 高效快速提取方法及实时荧光PCR 检测技术的研究[J].中国油脂,2005,30(7):41-43.
[28]Andreas Zimmermann,Jürg Lüthy,Urs Pauli.Quantitative and qualitative evaluation of nine different extraction methods for nucleic acids on soya bean food samples [J].Z Lebensm Unters Forsch A,1998,207:81-90.
[29]Angela Di Pinto,Vito Tony Forte,Maria Corsignano Guastadisegni,et al.A comparison of DNA extraction methods for food analysis[J].Food Control,2007,18:76-80.
