19 种花茶提取液中总黄酮得率及其清除自由基活性的研究
2014-03-27任顺成常云彩刘梦文
任顺成,常云彩,刘梦文
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
将植物的果实、花朵或者叶泡制而成的茶水,人们称之为“花茶”.古人已经有了“上品饮茶,极品饮花”之说,给予了花茶极高的评价,而现代亦有“男人品茶,女人饮花”的说法.国内外流行病学和临床研究表明花茶不仅能降低癌症、心血管疾病的风险,还具有美容养颜的特殊功效,并被用于传统的镇咳祛痰等治疗处方中,成为了当今主流的健康饮品[1-2].而国内女性花茶市场几乎是空白,国内以天然花茶为主题的商品市场尚未形成,流行的全球花茶健康产品在我国还稍显空白.目前,国内很多地方花茶的销售还处于超市内售卖散装花茶的低层次,没有形成一种独特的文化,满足不了消费者的要求.
黄酮类化合物是人们最为关注的一种天然自由基清除剂,具有抗过敏、抗氧化、消炎、保护神经系统及预防肥胖等多种药理及保健作用[3].而且黄酮类化合物在人体内不能直接合成,只能从食品中获得,所以近年来科学家都积极关注从植物体中提取纯度高、活性强的天然黄酮成分.花茶是富含黄酮类物质的植物,作者旨在通过对不同花茶在自然冲泡条件下有效成分的浸出量及其清除游离基活性的研究,为了解常见花茶的功能特性提供参考.
1 材料与方法
1.1 主要材料
花茶样品包括贡菊王、金盏菊、胎菊、紫罗兰、金莲花、红巧梅、粉玫瑰、茉莉、千日红、杭白菊、桃花、康乃馨、黄贡菊、乳菊、勿忘我、红花、迎春花、康仙花和百合花19 种,均为郑州市售.
1.2 主要设备
UV-2000 紫外-可见分光光度计:尤尼柯(上海)仪器有限公司;SHZ-(DIII)循环水式真空泵:巩义市予华仪器有限公司;HH-S 恒温水浴锅:巩义市英峪予华仪器厂;THZ-82B 恒温振荡器:江苏金坛医疗仪器.
1.3 方法
1.3.1 花茶中黄酮类化合物含量的测定
1.3.1.1 芦丁标准曲线的绘制
精确称取2.5 mg 芦丁标准品,用甲醇溶解,转移到25 mL 容量瓶中定容,摇匀后得到浓度为0.1 mg/mL 的芦丁标准溶液.精确吸取1.0、2.0、3.0、4.0、5.0 mL 芦丁标准溶液分别置于25 mL 容量瓶中,分别加入20 mL 0.1 mol/L 三氯化铝甲醇溶液,定容,摇匀,10 min 后在400 nm 处测定吸光度(A),以A 为纵坐标、浓度为横坐标,绘制标准曲线[4].
1.3.1.2 花茶提取液的制备
水提液的制备[5]:将已经干燥好的花茶用剪刀剪碎,用数显电子天平称取2 g,放入锥形瓶中,按照1∶50 固液比,加入100 ℃蒸馏水,置于90 ℃恒温水浴锅中浸提30 min.浸提结束后趁热用真空泵抽滤,然后定容于100 mL 容量瓶中,备用.
60%乙醇提取液的制备[6-7]:将已经干燥好的花茶用剪刀剪碎,用数显电子天平称取2 g,放入锥形瓶中,按照1∶50 固液比,加入60%乙醇溶液,在300 W 功率下,微波加热3 min.加热结束后用真空泵抽滤,然后定容于100 mL 容量瓶中,备用.
1.3.1.3 花茶提取液中总黄酮得率的测定
取1 mL 提取液于25 mL 容量瓶中,加20 mL 0.1 mol/L 三氯化铝甲醇溶液,定容,摇匀.10 min后,在400 nm 处测定吸光度,由标准曲线求得样品中总黄酮含量[4].
总黄酮得率=[(Y×25V)/(M×1 000×1 000)]×100% . (1)
式中:Y 为测定的浓度,μg/mL;25 为测定时定容的体积,mL;V 为提取液的总体积,mL;M 为样品的质量,g.
1.3.2 DPPH 自由基清除能力的测定
吸取2 mL DPPH 贮备液,并加入2 mL 试样液,摇匀,静置40 min 后,以无水乙醇为空白,测定反应体系在517 nm 处的吸光度Ai;同时测定2 mL DPPH 溶液与2 mL 无水乙醇混合液的吸光度Ac及试样液与2 mL 无水乙醇混合液的吸光度Aj.每个样品平行做3 次[8].

1.3.3 羟基自由基(·OH)清除能力的测定
在试管中依次加入1 mL 6 mmol/L 的硫酸亚铁,1 mL 6 mmol/L 水杨酸-乙醇,1 mL 花茶提取液,然后加入0.1%的过氧化氢1 mL 启动反应,总体积5 mL,以双蒸水补足体积.其中对照管不加样液,样底管不加H2O2,摇匀后在37 ℃水中温育30 min,在510 nm 处测定吸光度.平行测定3 次,取平均值[9].

式中:A样品为硫酸亚铁+水杨酸+样品+过氧化氢+蒸馏水的吸光度;A对照为硫酸亚铁+水杨酸+过氧化氢+蒸馏水的吸光度;A样底为硫酸亚铁+水杨酸+样品+过氧化氢+蒸馏水的吸光度.
2 结果与分析
2.1 总黄酮标准曲线
经过统计处理,得到回归方程:A=0.029 2X+0.009 4,R2=0.999 1.其中,Y 为吸光度,X 为黄酮浓度(μg/mL),R2为相关系数.
2.2 两种提取条件下花茶中的总黄酮得率(表1)
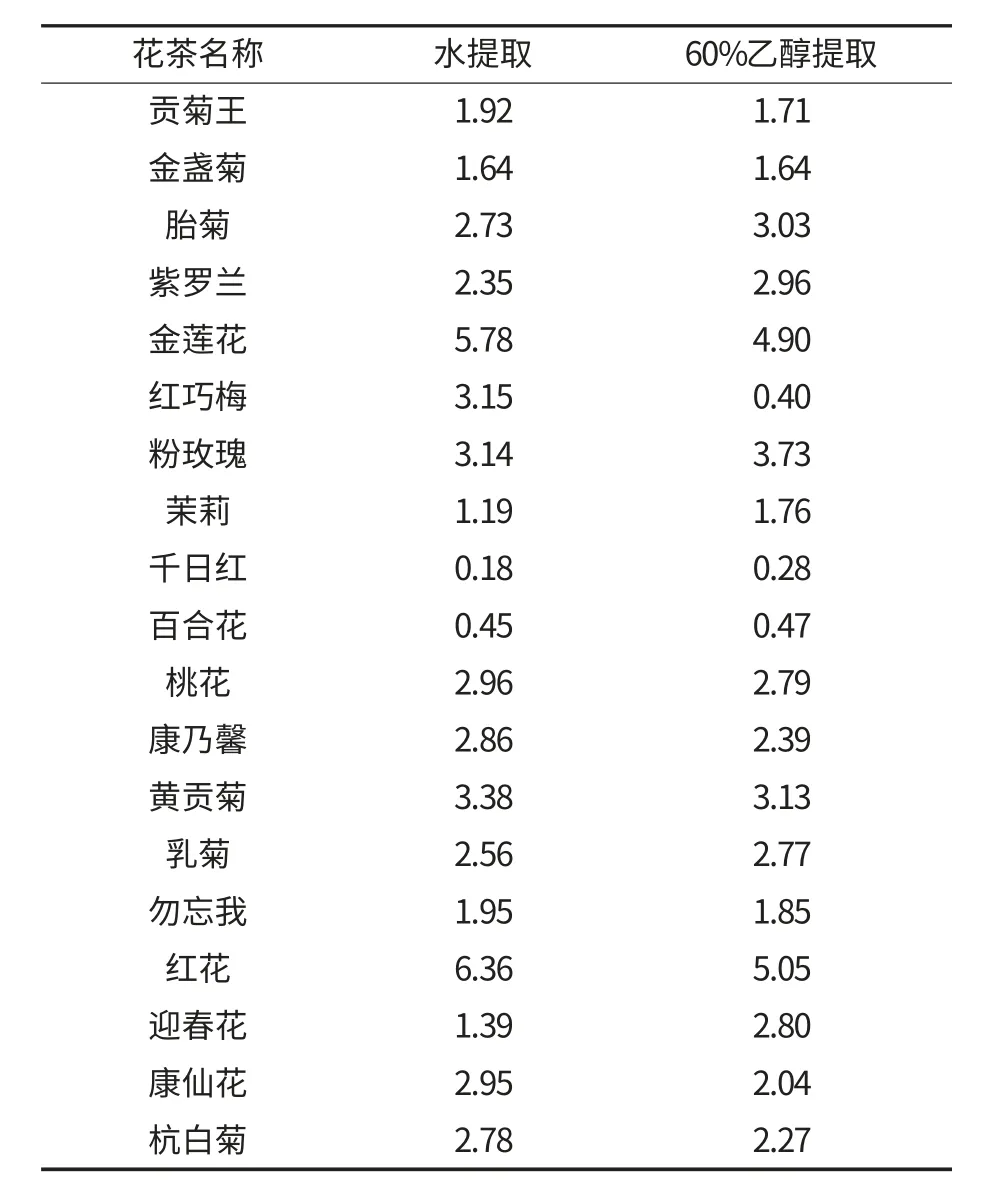
表1 不同提取方法下花茶中总黄酮的得率 %
由表1 可知,在水提条件下,19 种花茶中红花的总黄酮得率最高,为6.36%,是黄酮得率最低的千日红(0.18%)的39 倍.在60%乙醇微波提取的条件下,红花的总黄酮得率仍然是19 种花茶中最高的,约为5.05%,千日红得率最低,为0.28%,红花的总黄酮得率约为千日红的18 倍.
在19 种花茶中,贡菊王、金莲花、红巧梅、桃花、康乃馨、黄贡菊、勿忘我、红花、康仙花、杭白菊这10 种花茶在水提条件下的总黄酮得率大于在60%乙醇条件下提取的,而金盏菊、胎菊、紫罗兰、粉玫瑰、茉莉、千日红、百合花、乳菊、迎春花这9种花茶在醇提条件下的总黄酮得率较水提更高.多数黄酮类物质易溶于水、乙醇、甲醇等极性较强的溶剂中.水的极性较乙醇更强,之所以会出现上述含量上的差别,是因为每种花茶中所含有的黄酮类物质的种类和结构不尽相同,在不同的溶剂、不同的方法下所提取出的物质会发生一定的变化[10-11].
2.3 花茶黄酮类提取液清除自由基活性研究
2.3.1 DPPH 自由基清除能力
水提条件下19 种花茶提取液对DPPH·的清除率见图1.
60%乙醇提取条件下19 种花茶提取液对DPPH·的清除率见图2.
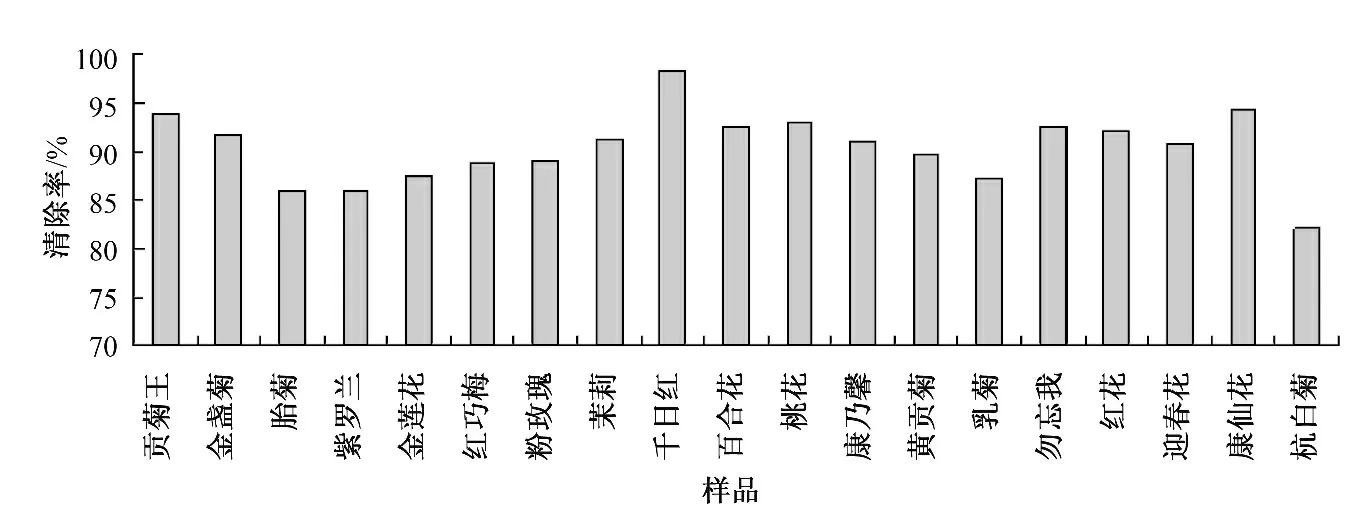
图1 水提条件下19 种花茶提取液对DPPH·的清除率

图2 60%乙醇提取条件下19 种花茶提取液对DPPH·的清除率
由图1 和图2 可知,对于在相同体积的待测样品,每种花茶都对DPPH·有着较强的清除能力.不论是在水提液还是醇提液中,千日红的DPPH·清除率都是最高,分别为98.31%和99.31%,最低的为杭白菊,分别为82.18%和81.17%,二者对DPPH·的清除能力也都很强.曾佑炜等[5]测定了16种花茶对DPPH·的清除能力,其中红花对DPPH·的清除率仅有50.70%,其原因可能是由于花茶的浸提时间过短(5 min),没有将黄酮类化合物充分浸提出来,也可能是由于原料产地或品种不同所致.
2.3.2 羟基自由基(·OH)清除能力
水提条件下19 种花茶提取液对·OH 的清除率见图3.
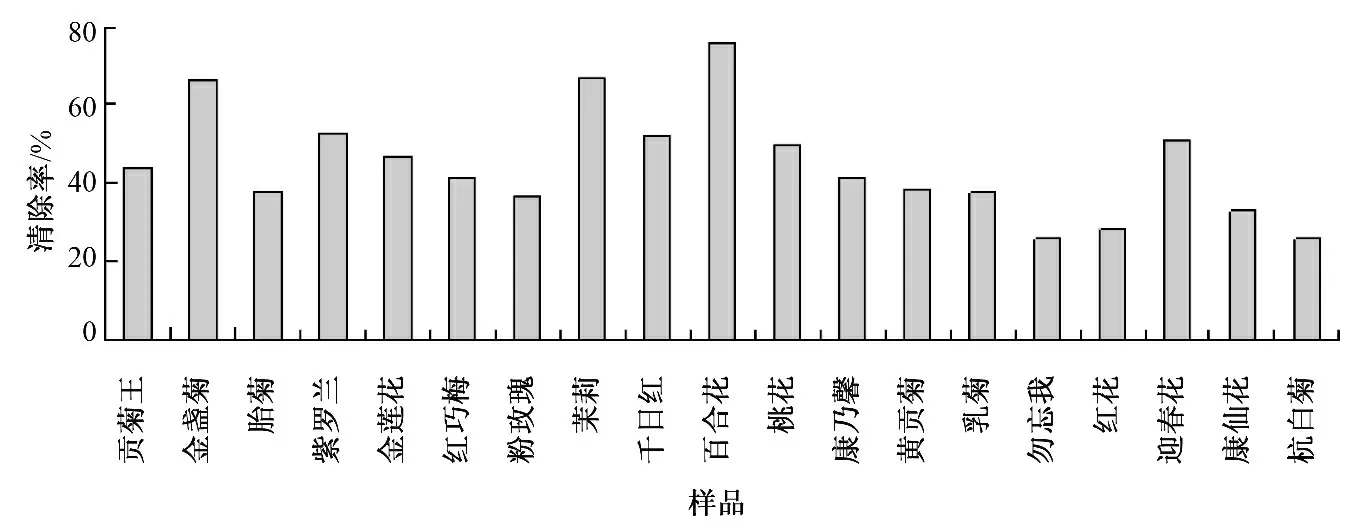
图3 水提条件下花茶提取液对·OH 的清除率
60%醇提条件下19 种花茶提取液对·OH 的清除率见图4.
结果表明,在水提液中,对·OH 清除能力最强的是百合花,清除率为75.65%,最弱的为勿忘我,清除率为25.86%;用60%乙醇为提取液时,对·OH清除力最强的是金莲花,为65.83%,最弱的是康乃馨,清除率为17.16%,不同种花茶之间对·OH 的清除率相差很大.
19 种花茶提取液清除游离基活性不同的原因主要有:不同提取条件下的每种花茶提取液都可能含有不同的黄酮类化合物.不同的黄酮类化合物对不同体系的抗氧化作用可能不同,对不同自由基和不同组织的作用也存在一定的选择性,而且黄酮类化合物清除·OH 与DPPH·的活性部位和作用机制也不完全相同,因此,这可能是造成花茶总黄酮对两种自由基清除效果不同的原因[12-14].而且在不同的提取条件下,所提取出的黄酮类化合物的含量、种类及特性有所不同,另外,这19 种花茶的粗提液中可能含有一些酚类物质及其他抗氧化成分,在不同的提取工艺下,这些抗氧化物质的特性及含量也有区别,它们对自由基的清除能力存在一定的选择性,在抗氧化体系中发挥的作用也不尽相同,所以会造成上述清除游离基活性的差别[15-17].
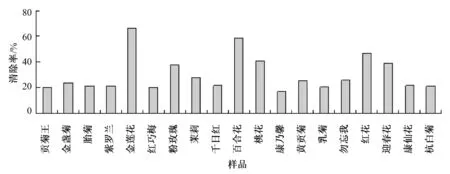
图4 60%乙醇提取条件下花茶提取液对·OH 清除率
2.3.3 花茶提取液中总黄酮得率与自由基清除率的相关性
用SPSS16.0 软件对花茶提取液总黄酮得率与DPPH·、·OH 清除率之间进行单因素方差分析,用P 值表示相关性是否显著,P>0.05 代表不显著,P<0.05 代表具有显著性,P<0.01 代表极显著,结果见表2 和表3.
由表2 和表3 可知,水提条件下,花茶提取液中总黄酮得率与DPPH·清除率没有明显相关性,P值为0.169,但与·OH 清除率之间存在一定的相关性,P 值为0.015.60%乙醇提取条件下,花茶提取液的总黄酮得率与DPPH·和·OH 清除率之间没有显著的相关性,P 值分别为0.078 和0.075;不论在水提条件下还是醇提条件下,DPPH·和·OH 清除率之间都没有明显相关性,P 值分别为0.253 和0.799.之所以黄酮得率与DPPH·和·OH 清除率之间没有显著的相关性,其原因可能是由于花茶中还含有其他的抗氧化成分,譬如酚类物质、维生素等.

表2 水提条件下单因素方差分析

表3 60%乙醇提取条件下的单因素方差分析
3 结论
在19 种花茶提取液中,红花、黄贡菊、粉玫瑰、金莲花的总黄酮得率较高,均在3%以上,千日红和百合的总黄酮得率较低,在1%以下;每种花茶都对DPPH·有着较强的清除能力,清除率在80%以上;百合花对羟基自由基的清除率较强,但是胎菊、粉玫瑰、黄贡菊、乳菊、勿忘我、康仙花和杭白菊对羟基自由基的清除率较低.不同种类花茶提取液之间的总黄酮得率差异比较大,并且在水提条件下和醇提条件下的黄酮得率差异明显.千日红中的总黄酮得率在19 种花茶提取液中是最低的,但是对DPPH 自由基的清除率却最强.花茶提取液的总黄酮得率与DPPH·和·OH 清除率之间没有显著的相关性,这说明花茶的抗氧化活性并不完全取决于其总黄酮,还可能和其他抗氧化成分,譬如总酚等有关,有待深入研究.
[1]Amira M,Gamal-Eldeen,Eman F A,et al.In vitro cancer chemopreventive properties of polysaccharide extract from the brown alga,Sargassum latifolium [J].Food and Chemical Toxicology,2009,47(6):1378-1384.
[2]Bo Li,Yuxia Jin,Yi Xu,et al.Safety evaluation of tea(Camellia sinensis(L.)O.Kuntze)flower extract:Assessment of mutagenicity,and acute and subchronic toxicity in rats[J].Journal of Ethnopharmacology,2011,133(2):583-590.
[3]Bendjeddou D,Lalaoui K,Satta D.Immunostimulating activity of the hot water-soluble polysaccharide extracts of anacyclus pyrethrum,alpinia galangal and citrullus colocynthis[J].Joumal of Ethnopharmacology,2003,88(2-3):155-160.
[4]谭仁祥.植物成分分析[M].北京:科学出版社,2002,590-591.
[5]曾佑炜,赵金莲,王方.16 种花茶对DPPH 的清除能力及其优化配比研究[J].天然产物研究与开发,2008(20):39-43.
[6]唐津忠,鲁晓翔,陈瑞芳.金莲花中黄酮类化合物的提取及其抗氧化性研究[J].食品科学,2003,24(6):88-91.
[7]郭娇娇,罗佳,宫智勇.桂花中总黄酮提取工艺及其抗氧化活性的研究[J].武汉工业学院学报,2011,30(1):5-8.
[8]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业,2006,32(3):92-98.
[9]刘宝剑,郭延生,刁鹏飞,等.红车轴草总黄酮体外清除自由基作用的研究[J],天然产物研究与开发,2009(21):44-47.
[10]孙克杰,汤坚.异黄酮类化合物在不同氧化体系中的作用研究[J].食品科学,2001,22(3):22-26.
[11]张英,吴晓琴,丁宵霖,等.黄酮类化合物结构与清除活性氧自由基效能关系的研究[J].天然产物研究与开发,1998,10(4):26-33.
[12]谢琼,张益娜,李敏,等.紫外分光光度法测定玫瑰花和玫瑰花渣中的总黄酮含量[J].农产品加工学刊,2007(4):19-20.
[13]孙艳梅,徐雅琴,杨林.天然物质类黄酮的抗氧化活性的研究[J].中国油脂,2003,28(3):54-57.
[14]白凤梅,蔡同一.类黄酮生物活性及其机理的研究进展[J].食品科学,1999,20(8):11-13.
[15]刘秀河,赵祥忠.茶叶提取液抗菌效果的研究[J].山东轻工业学院学报,2000(1):59-62.
[16]刘昌平.金银花黄酮的抗氧化活性分析[J].安徽农业科学,2009,37(20):9483-9484,9505.
[17]屠大伟,张保顺,李学刚.黄连花茶加工工艺及其抗氧化作用研究[J].食品工业科技,2007(5):165-167.
