利用双重PCR同时检测婴幼儿配方奶粉中克罗诺杆菌和沙门氏菌方法的建立
2014-03-23,,,,,
, ,, , ,
(1. 南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 2. 南昌大学中德联合研究院,江西南昌 330047; 3. 江西中医药大学基础医学部,江西南昌 330004)
2004年,联合国粮农组织和世界卫生组织(FAO/WHO)对婴幼儿配方奶粉中可能存在的病原微生物进行风险评估后,认为婴幼儿配方奶粉中的克罗诺杆菌和沙门氏菌污染是导致婴幼儿感染疾病和死亡的主要原因,并将克罗诺杆菌和沙门氏菌定义为婴幼儿配方奶粉中的“A类致病菌”[1]。
克罗诺杆菌(原阪崎肠杆菌)是一类食源性条件致病菌[2],能够引起新生儿脑膜炎、菌血症和小肠结肠炎,特别是28d以内的早产儿、体重较轻或免疫缺陷的婴幼儿更容易被感染,死亡率高达50%以上[3 - 4]。进行溯源分析后,认定婴幼儿配方奶粉是其最主要的传播途径[5]。沙门氏菌是最常见的食源性人兽共患病原菌,能导致人类发生伤寒、副伤寒、败血症、胃肠炎和食物中毒[6],我国内陆地区细菌性食物中毒中有70% ~ 80%是由沙门氏菌引起的[7]。
近些年,关于婴幼儿配方奶粉中可能存在的两种“A类致病菌”引起感染的报道越来越多,但同时检测两种致病菌的方法较少。仅有Hyeon等[8]利用荧光定量PCR实现对奶粉中克罗诺杆菌菌和沙门氏菌的同时检测,但需长达12h的预增菌处理,检测限才均能达到100CFU/g。大多单一检测方法也需要长时间的预增菌培养[9 - 10],很难满足病原菌快速检测的要求[11 - 12]。因此,亟需快速、准确、灵敏度高的联合检测奶粉中克罗诺杆菌和沙门氏菌的方法。

表1 本实验所用菌种及双重PCR特异性检测结果Table 1 Bacteria used in this study and the results of duplex - PCR specificity test
注:+表示d - PCR检测结果阳性; - 表示d - PCR检测结果阴性。
本文利用克罗诺杆菌和沙门氏菌的特异性引物结合双重PCR反应,建立了一种能够准确、快速地同时检测婴幼儿配方中的克罗诺杆菌和沙门氏菌的方法。对于预防和控制病原菌的流行,保障婴幼儿食品安全,具有至关重要的意义。
1 材料与方法
1. 1 材料与仪器
本实验涉及20株克罗诺杆菌、4株沙门氏菌以及18株其它食源性致病菌或益生菌,所用菌株均由食品科学与技术国家重点实验室保存,具体菌株见表1。
LB培养基、MRS培养基 北京中杉金桥生物技术有限公司;克罗诺杆菌显色培养基 环凯微生物技术有限公司;沙门氏菌显色培养基 青岛海博生物公司;Taq mastermix TaKaRa公司;婴幼儿配方奶粉 南昌市周围超市。
高温蒸汽压力灭菌锅 上海博讯;涡旋振荡器 上海奇特; - 70℃超低温冰箱 Thermo USA,PCR仪 Eppendorf Germany;电泳仪 Bio - RAD USA;普通低温冰箱 青岛海尔;超纯水仪 Millipore USA;微量移液器 Eppendorf Germany;凝胶成像分析系统 Bio - RAD USA;电子天平 上海良平;ZHWY - A2102C恒温培养箱 上海智城分析仪器制造有限公司;恒温培养振荡器 上海智城分析仪器制造有限公司;YQX - II型厌氧培养箱 上海跃进医疗器械厂。
1. 2 实验方法
1. 2. 1 细菌培养及基因组DNA提取 克罗诺杆菌与沙门氏菌均采用普通Luria - Bertani(LB)液体培养基,37℃恒温培养振荡器180r/min过夜培养,其他菌株采用LB或MRS液体培养基进行常规培养。取2mL过夜菌悬液,用天根公司细菌基因组DNA提取试剂盒提取细菌DNA,所提取DNA溶于20μL无菌水中, - 20℃保存备用。
1. 2. 2 双重PCR引物设计 分别根据GenBank登陆号为NR044060. 1和HG326213. 1中的基因序列,利用在线NCBI公共数据库运用OMIGA软件设计克罗诺杆菌和沙门氏菌的特异性引物并由上海英骏生物技术有限公司合成(见表2)。
1. 2. 3 双重PCR反应体系及条件 双重PCR反应体系(25μL)为:2. 5×Taqmastermix 10μL,引物Cro- F、Cro- R、InvA- F、InvA- R(浓度均为10μmol/L)各0. 3μL,DNA模板溶液5μL,加水补足至25μL。混和均匀后,按照以下条件进行扩增:95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸30s,共30个循环;最后72℃充分延伸10min。反应结束后,取10μL PCR扩增产物在浓度为1. 5%(w/v)的琼脂糖凝胶中进行电泳检测(电泳条件为5V/cm),利用凝胶成像系统成像分析。

表2 本实验所用引物Table 2 d - PCR Primers used in this study
1. 2. 4 双重PCR特异性检测
1. 2. 4. 1 引物特异性检测 以全部实验菌株基因组DNA为模板,按上述双重PCR反应体系及条件进行双重PCR扩增并电泳检测。
1. 2. 4. 2 目标菌株交叉实验 以克罗诺杆菌和沙门氏菌作为对比分析对象,进行目标细菌交叉实验(见表3),两种细菌浓度均为104CFU/mL,按上述条件和方法进行双重PCR扩增并电泳检测。

表3 目标细菌交叉实验Table 3 Target bacteria cross - over test
注:表中○表示未添加细菌,表中●表示添加细菌。
1. 2. 5 奶粉样本灵敏度检测 在无菌奶粉样品中分别添加克罗诺杆菌ATCC 29544和相同浓度鼠伤寒沙门氏菌ATCC 13311,使两种致病菌浓度均为100、101、102、103、104、105、106、107CFU/g,取1g人工污染的奶粉样本接种于10mLLB液体培养基中,37℃恒温培养振荡器180r/min进行培养,选取2、4、6、8h为四个时间节点进行实验。按1. 2. 1方法提取增菌液中细菌基因组DNA作为扩增模板,进行双重PCR检测。用未人为添加致病菌的无菌婴幼儿配方奶粉,按相同方法进行实验,作为阴性对照。
1. 2. 6 高浓度杂菌干扰实验 在1. 2. 5中人工污染相同浓度的克罗诺杆菌ATCC29544和鼠伤寒沙门氏菌ATCC13311的奶粉样本中加入106CFU/g肠致病性大肠杆菌CMCC44496,经4h增菌,提取基因组DNA后进行双重PCR检测,考察高浓度杂菌对双重PCR检测方法灵敏度的影响。
1. 2. 7 人工污染婴幼儿配方奶粉样本检测 在40份无菌婴儿配方奶粉中人工随机掺杂不同浓度克罗诺杆菌(100~ 106CFU/g)和不同浓度沙门氏菌纯培养物(100~ 106CFU/g);在20份无菌婴儿配方奶粉中人工掺杂不同浓度克罗诺杆菌(100~ 104CFU/g);在20份无菌婴儿配方奶粉中人工掺杂不同浓度沙门氏菌(100~ 106CFU/g);共制备人工污染样本80份,无菌婴儿配方奶粉样本20份。总计100份检测样本根据上述实验方法进行样本处理及检测。同时依据FDA分离鉴定克罗诺杆菌和沙门氏菌的方法分别进行对比实验。
2 结果与分析
2. 1 双重PCR检测的特异性
2. 1. 1 引物的特异性 为检测引物特异性,20株克罗诺杆菌、5株沙门氏菌及18株其他食源性致病菌或益生菌经过夜培养后,提取菌株DNA作为PCR反应扩增模板,按上述双重PCR反应体系及条件进行检测。结果统计后如表1所示,全部20株克罗诺杆菌、4株沙门氏菌样本均得到条带单一、位置正确的电泳条带,而其他18株其他食源性致病菌或益生菌样本均无条带产生。电泳结果表明引物Cro和InvA均具备良好特异性,符合双重PCR实验特异性要求。
2. 1. 2 交叉检测实验结果 为检测双重PCR反应引物之间是否存在交叉影响,因此,针对克罗诺杆菌和沙门氏菌进行交叉检测实验,结果如图1所示,双重PCR单一检测克罗诺杆菌或沙门氏菌均得到大小正确、条带单一的扩增产物;双重PCR联合检测克罗诺杆菌和沙门氏菌混合样本,得到两条条带清晰、位置正确的扩增产物;双重PCR检测阴性样本,无扩增条带。因此,克罗诺杆菌和沙门氏菌交叉检测实验结果说明,引物Cro和InvA均无交叉干扰,能够满足实验特异性要求。

图1 交叉检测实验结果图Fig. 1 The results of target bacteria cross - over test注:M:DL2000 marker;1,2,3,4分别对应表3中组合。
2. 2 双重PCR检测的灵敏度
为检测双重PCR反应的灵敏度,同等浓度的克罗诺杆菌和沙门氏菌混合奶粉溶液样本在经过增菌、基因组DNA提取后,进行双重PCR扩增并电泳检测。接种低浓度目标菌株的增菌液在培养2、4、6、8h后的检测结果如表4所示,接种量均为100CFU/g的两种目标菌种在两个小时增菌后均未检出,四个小时增菌后均能够检出。接种量为101CFU/g的两种目标菌种在两个小时增菌后均可检出,因此,选取4h为预增菌时间。

表5 人工污染奶粉样本检测结果Table 5 The detection of Cronobacter in artificially contaminated PIF
不同浓度接种量的增菌液培养4h后,按上述方法进行检测。结果如图2所示,初始浓度均为100CFU/g的克罗诺杆菌和沙门氏菌可同时被检测到。双重PCR检测对两种食源性致病菌的灵敏度均为初始浓度100CFU/g。

表4 增菌后d - PCR检测克罗诺杆菌和沙门氏菌结果Table 4 The detection results of d - PCR after enrichment
注:“+”表示两种目标菌株均可检测到,“ - ”表示两种目标菌株均不可检测到或只可检测到一种。
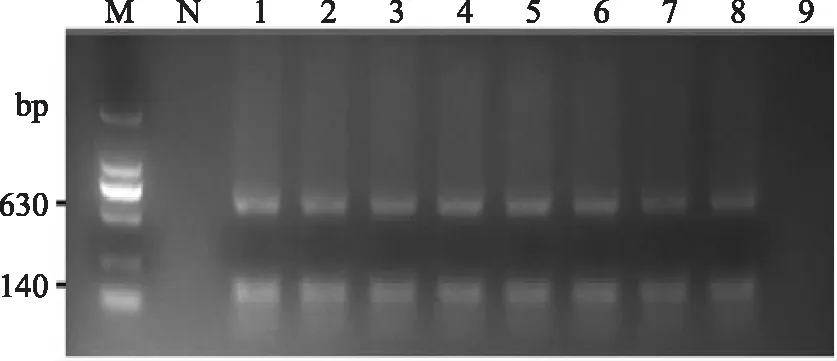
图2 双重PCR灵敏度检测实验结果图Fig. 2 The detection sensitivity results of d - PCR注:M:DL2000 marker;N:阴性对照;1,2,3,4,5,6,7,8,9表示克罗诺杆菌和沙门氏菌的初始接种量均为107,106,105,104,103,102,101,100,0CFU/g的婴儿配方奶粉样本。
2. 3 双重PCR抗高浓度杂菌干扰能力检测结果
为排除高浓度杂菌对双重PCR检测造成干扰的可能性,在同等浓度的克罗诺杆菌和沙门氏菌的混合奶粉稀释样本(100~ 104CFU/g)中掺入106CFU/g肠致病性大肠杆菌(CMCC44496)后,按上述实验步骤进行检测,结果如图3所示,该方法最低检测限仍可达到100CFU/g,说明双重PCR具备抗高浓度杂菌干扰能力。
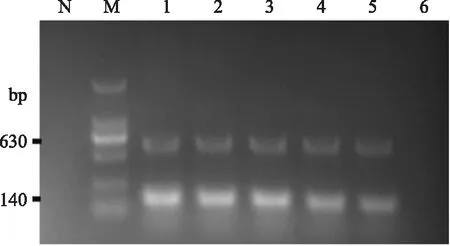
图3 双重PCR抗干扰能力检测实验结果图Fig. 3 The anti - interference ability test results of d - PCR注:M:DL2000 marker;N:阴性对照;1,2,3,4,5,6表示克罗诺杆菌和沙门氏菌的初始接种量均为104,103,102,101,100,0CFU/g并混有106CFU/g肠致病性大肠杆菌的婴儿配方奶粉样本。
2. 4 人工污染的婴幼儿配方奶粉样本检测结果
与FDA检测方法进行对比分析后,统计结果如表5所示,在对80份人工污染和20份无污染的婴幼儿配方奶粉样本检测中,均无假阳性结果。在克罗诺杆菌和沙门氏菌混合阳性样本检测中,克罗诺杆菌检测准确率为97. 5%,沙门氏菌检测准确率为95%;在克罗诺杆菌阳性样本检测中,克罗诺杆菌检测准确率为100%,沙门氏菌检测准出率为0%;在沙门氏菌阳性样本检测中,克罗诺杆菌检测准出率为0%,沙门氏菌检测准确率为100%;在阴性样本检测中,克罗诺杆菌、沙门氏菌均无检出。人工污染的婴幼儿配方奶粉样本检测中,无假阳性出现。由此可知,双重PCR方法检测克罗诺杆菌和沙门氏菌的准确率均在95%以上。
3 结论
PCR检测方法的特异性主要取决于相应检测靶点的选择和特异性引物的设计[13],本实验设计的分别针对克罗诺杆菌和沙门氏菌的引物,在特异性检测实验中均展示出良好的特异性,同时二者不会产生交叉干扰,符合双重PCR反应要求。与传统的单一致病菌检测相比,本研究建立的双重PCR检测体系可以在6h左右(包括4h增菌,30min基因组提取和1h30minPCR扩增检测),完成对奶粉中的2种重要食源性致病菌的联合检测,而且结果准确、灵敏度高,节省检测时间的同时,也减少试剂耗材的消耗,具有高效和经济简便的优点。该方法不需配置荧光定量PCR仪等昂贵的仪器设备,只需普通PCR仪、电泳仪,适合基层实验室使用,为食品微生物安全的卫生监测和流行病学调查等提供技术手段。同时也为突发卫生事件中致病菌的分离鉴定和溯源提供强有力的证据,具有较强的实际应用价值和良好的应用前景。
[1]Healy B,Cooney S,O’Brien S,etal.Cronobacter(Enterobacter sakazakii):An Opportunistic Foodborne Pathogen[J]. Foodborne Pathog Dis,2010,7(4):339 - 350.
[2]Urmenyi AM,Franklin AW. Neonatal death from pigmented coliform infection[J]. Lancet,1961,1(7172):313 - 315.
[3]Clark NC,Hill BC,O’Hara CM,etal. Epidemiologic typing of Enterobacter sakazakii in two neonatal nosocomial outbreaks[J]. Diagn Micr Infec Dis,1990,13(6):467 - 472.
[4]Lehner A,Stephan R. Microbiological,epidemiological,and food safety aspects of Enterobacter sakazakii[J]. J Food Protect,2004,67(12):2850 - 2857.
[5]Bowen AB,Braden CR. Invasive Enterobacter sakazakii disease in infants[J]. Emerging Infectious Diseases,2006,12(8):1185 - 1189.
[6]Coburn B,Grassl GA,Finlay BB. Salmonella,the host and disease:a brief review[J]. Immunol Cell Biol,2006,85(2):112 - 118.
[7]牟成惠,陈淑云. 一起饮食服务人员沙门菌携带率的调查[J]. 中国热带医学,2007,7(7):1231 - 1231.
[8]Hyeon J - Y,Park C,Choi I - S,etal. Development of multiplex real - time PCR with Internal amplification control for simultaneous detection ofSalmonellaandCronobacterin powdered infant formula[J]. Int J Food Microbiol,2010,144(1):177 - 181.
[9]Ye Y,Wu Q,Zhang J,etal. Detection of ViableCronobacterspp. (Enterobacter sakazakii)by One - Step RT - PCR in Dry Aquatic Product[J]. J Food Sci,2012,77(11):M616 - M619.
[10]Alvarez J,Sota M,Vivanco AB,etal. Development of a multiplex PCR technique for detection and epidemiological typing ofSalmonellain human clinical samples[J]. J Clin Microbiol, 2004,42(4):1734 - 1738.
[11]董晓晖,吴清平,莫树平,等. 克罗诺杆菌检测方法研究进展[J]. 华中农业大学学报,2013,31(1):130 - 136.
[12]黎敏英,邓树轩,叶朗光,等. 沙门氏菌检测方法研究进展[J]. 畜牧与饲料科学,2009,30(3):138 - 139.
[13]宋艳,李建林,郑铁松,等. 食源性致病菌PCR检测中常用的靶基因及其参考引物[J]. 食品工业科技,2011,32(1):371 - 376.
