硒对人神经母细胞瘤细胞β-淀粉样蛋白表达影响
2014-03-22,,,,,
,,,,,
(1 青岛大学医学院附属医院特需保健科,山东 青岛 266003; 2 大连医科大学; 3 青岛市市立医院)
阿尔茨海默病(AD) 是以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变。其主要的组织病理学特点是β-淀粉样蛋白(Aβ) 在神经细胞外聚集沉淀形成老年斑以及tau 蛋白过度磷酸化造成微管损伤和神经纤维缠结。4-羟基壬烯酸(HNE)是氧化应激的一个重要指标,它的大量积累是神经退行性疾病(如AD、帕金森病)的一项病理特征[1]。硒是人体必需的微量元素之一。缺硒时脑硒含量所维持的时间远远长于其他任何器官,脑也是最后一个出现缺硒现象的器官[2-3]。研究结果显示,硒缺乏与AD密切相关,AD病人硒的摄入与正常人相比明显偏低,且血清、红细胞和指甲中硒含量也明显降低[4]。本研究应用不同浓度的亚硒酸钠对人神经母细胞瘤细胞进行处理,旨在探讨硒对Aβ产生的影响。现将结果报告如下。
1 材料与方法
1.1 细胞培养
人神经母细胞瘤细胞(SH-SY5Y)和稳定表达淀粉样前体蛋白(APP)的人神经母细胞瘤细胞(SH-SY5Y/swAPP)购于上海细胞库。将两种细胞置于含体积分数0.06的CO2、37 ℃孵箱中培养6~8 d。
1.2 酶活性的测定
将SH-SY5Y细胞首先用不同浓度的亚硒酸钠(0、50、100和200 nmol/L)处理24 h,接着再用10 μmol/L的HNE处理24 h后收获细胞。采用直接荧光法,用连有报告分子EDANS和DABCYL具有酶特异性的肽段检测α-、β-、γ-分泌酶活性,操作按说明书步骤进行。试剂盒购自R&D System公司。
1.3 Aβ的检测
将SH-SY5Y或者SH-SY5Y/swAPP细胞先用不同浓度亚硒酸钠处理24 h,接着用10 μmol/L HNE处理24 h,然后在4 ℃下以14 000 r/min离心10 min,取100 μL样品用于酶联免疫吸附试验(ELISA)。用human β-amyloid 1-40/1-42 ELISA试剂盒(购自美国Bio Source公司)检测SH-SY5Y/swAPP细胞中的Aβ-40和Aβ-42。用双抗体夹心ELISA试剂盒(美国IBL公司)检测SH-SY5Y细胞中的分泌型β-淀粉样蛋白(sAPPβ)。操作按说明书步骤进行。
1.4 淀粉蛋白前β位分解酶1(BACE1)蛋白检测
将SH-SY5Y细胞先用不同浓度的亚硒酸钠处理24 h,然后用10 μmol/L的HNE处理6 h。采用Western Blotting 方法,用ECL蛋白质印迹检测系统检测BACE1蛋白,按说明书进行操作。
1.5 BACE1 mRNA的检测
用RNA提取试剂盒(美国Invitrogen公司)提取SH-SY5Y细胞中RNA,按照说明书合成cDNA(试剂盒购自美国Promega公司),采用Real-time PCR(试剂盒购自Takara公司)进行DNA的扩增。用于BACE1扩增的引物序列如下:正向5′-GCCAAGAAAGATGTTTGAAGCT-3′,反向5′-GCCAGAAACCATCAGGGAACT-3′。用于β-肌动蛋白扩增引物序列为:5′-AGGCCAACCGCGAGAA-G-3′,5′-ACGCCTGGATAGCAACGTACAT-3′。具体操作按说明书进行。
1.6 统计学处理
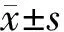
2 结 果
2.1 亚硒酸钠对HNE处理后细胞中α-、β-、γ-分泌酶活性的影响
亚硒酸钠可以降低β-、γ-分泌酶活性,表现出剂量依赖性(F=31、16,P<0.05),但亚硒酸钠对α-分泌酶活性没有影响(P>0.05)。见表1。
2.2 亚硒酸钠对HNE介导Aβ表达的影响
经亚硒酸钠预处理,由HNE介导的sAPPβ表达明显降低(F=56,P<0.01);亚硒酸钠预处理也能够明显降低由HNE介导的Aβ-40和Aβ-42的表达(t=13、12,P<0.01)。见表2。
2.3 亚硒酸钠对HNE处理后BACE1表达的影响
HNE介导的BACE1蛋白和mRNA表达受到了亚硒酸钠的影响而显著下调(F=9 161、213,P<0.01)。见表3。
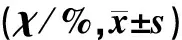

亚硒酸钠浓度(c/nmol·L-1)α-分泌酶β-分泌酶γ-分泌酶 0100.0±6.4100.0±3.4100.0±11.750104.0±6.896.6±5.288.3±6.7100112.0±4.886.2±6.683.3±9.0200113.3±8.182.8±6.976.7±10.0
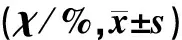
表2 亚硒酸钠对HNE介导的sAPPβ、Aβ-40、Aβ-42表达的影响
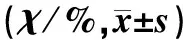

亚硒酸钠浓度(c/nmol·L-1)BACE1蛋白HNE(-)HNE(+)BACE1 mRNAHNE(-)HNE(+) 0100.0±0.8131.4±1.5100.0±0.1287.0±7.350101.4±1.777.1±1.6108.7±21.2113.0±2.310097.1±2.284.3±1.991.3±17.3147.8±19.2200111.4±1.540.0±0.9104.3±16.5160.9±34.6
3 讨 论
AD的临床改变主要与大脑皮质及边缘神经系统的退行性改变有关,如海马和新皮质的弥散性神 经元缺失、细胞内神经纤维缠结及细胞外淀粉斑沉积和神经元末梢变性[5]。Aβ在神经细胞外聚集沉淀是AD的重要病理特征之一;tau 蛋白过度磷酸化所造成的微管损伤及神经纤维缠结是AD的另一重要病理特征。流行病学研究还显示,低教育程度、膳食因素、女性雌激素水平降低、高糖血症、高胆固醇血症、高同型半胱氨酸血症、血管因素、心理社会因素等均与AD相关。
BACE1是产生Aβ的限速酶,其活性水平决定APP的代谢途径。BACE1是一类天冬氨酰蛋白酶,其基因定位于人染色体11q23.2,全长共2 526个碱基对,包含9个外显子。Aβ是老年斑的主要组成成分,它的过量产生及聚集是导致AD发病的主要原因。Aβ由Ⅰ型跨膜的APP经分泌酶水解代谢产生。分泌酶按作用位点可分为α-、β-和γ-等3种,Aβ由β-和γ-分泌酶依次水解APP而产生,具有毒性[6];α-和γ-分泌酶依次水解APP,产生的可溶性sAPPα肽和P3肽段则具有神经营养等作用。若APP的α-和β-代谢失去平衡,产生过多的Aβ,就容易诱发AD。目前,可以减少Aβ产生的药物的研究不多。周丽苹等[7]的研究表明,人参皂苷Rg1可以阻断Aβ25-35所致小鼠海马神经元损伤,具有神经保护作用。
脂质过氧化水平的升高是AD发生的早期改变,其主要产物HNE对神经元具有毒性作用[8-9]。HNE的神经毒性可以直接攻击蛋白质,引起酶活性减弱、基因突变以及细胞代谢紊乱,最终导致细胞死亡[10]。同时,HNE也可通过对膜脂质过氧化介导的DNA继发性损伤或DNA的直接损伤引起神经细胞凋亡[11]。HNE和Aβ的产生具有相互促进的关系,Aβ 本身能诱导神经细胞膜脂质过氧化和产生HNE,反过来,培养的神经细胞暴露于HNE,其BACE1 表达增高,从而裂解APP 生成Aβ[12-13]。
硒是人体所必需的微量元素之一。以往调查显示,长期处于低硒水平地区的人群与低认知功能相关联[14]。然而,硒与AD关系的研究结果仍存在分歧,部分研究显示,硒缺乏与AD的发病密切相关,补充含硒混合物可以改善认知功能[4,15];另有研究显示,AD病人与健康对照的脑脊液和血清中硒水平没有明显差异,AD病人海马区或脑杏仁核区硒水平显著升高,硒水平与AD病人脑脊液中的Aβ-42水平无关[16-18]。多数实验结果表明,硒和硒蛋白与Aβ产生和脂质过氧化密切相关,硒缺乏的直接后果是硒蛋白的产生减少,抗氧化应激能力降低,进而使细胞发生氧化应激并促进AD的形成[19]。tau蛋白过度磷酸化是AD发病的机制之一,PP2A为丝氨酸和苏氨酸特异性磷酸酯酶,它在保持和调节tau蛋白磷酸化平衡中发挥关键作用[20]。PP2A活性与人脑中tau蛋白的磷酸化水平呈负相关,含硒化合物能提高PP2A活性,通过降低tau蛋白的过度磷酸化而减少神经纤维缠结[21]。
本研究结果显示,亚硒酸钠能够显著降低由HNE诱导的β-和γ-分泌酶的活性,从而减少由分泌酶途径产生的Aβ,但亚硒酸钠对α-分泌酶的活性没有影响;并且亚硒酸钠也可直接减少由HNE诱导的sAPPβ和Aβ的产生;此外,亚硒酸钠也可抑制由HNE诱导的BACE1的表达,进一步减少Aβ的产生。本文结果为应用硒化合物限制Aβ的产生从而治疗AD提供了理论基础。
[参考文献]
[1]YIN S T, TANG M L, DENG H M, et al. Epigallocatechin-3-gallate induced primary cultures of rat hippocampal neurons death linked to Calcium overload and oxidative stress[J]. Naunyn Schmiedebergs Arch Pharmacol, 2009,379(6):551-564.
[2]SAVASKAN N E, UFER C, KUHN H, et al. Molecular biology of glutathione peroxidase 4: from genomic structure to developmental expression and neural function[J]. Biol Chem, 2007,388(10):1007-1017.
[3]CALABRESE V, GUAGLIANO E, SAPIENZA M, et al. Redox regulation of cellular stress response in aging and neurodegenerative disorders: role of vitagenes[J]. Neurochem Res, 2007,32(4/5):757-773.
[4]CARDOSO B R, ONG T P, JACOB-FILHO W, et al. Nutritional status of Selenium in Alzheimer’s disease patients[J]. Br J Nutr, 2010,103(6):803-806.
[5]CAPPAI R, WHITE A R. Amyloid beta[J]. Int J Biochem Cell Biol, 1999,31:885-889.
[6]李守业,朱妍,焦悦,等. 阿尔采末病APP分泌酶及其靶向干预研究进展[J]. 中国药理学通报, 2011,27(10):1349-1353.
[7]周丽苹,葛科立,陈文芳. 人参皂苷Rg1对Aβ25-35致小鼠海马神经元损伤保护作用[J]. 青岛大学医学院学报, 2011,47(3):189-191.
[8]HARDY J, SELKOE D J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics[J]. Science, 2002,297(5580):353-356.
[9]FLORANG V R, REES J N, BROGDEN N K, et al. Inhibition of the oxidative metabolism of 3,4-dihydroxyphenylacetaldehyde, a reactive intermediate of dopamine metabolism, by 4-hydroxy-2-nonenal[J]. Neurotoxicology, 2007,28(1):76-82.
[10]JOHNSON M D, XIANG H, LONDON S, et al. Evidence for involvement of Bax and p53,but not caspases,in radiation-induced cell death of cultured postnatal hippocampal neurons[J]. J Neurosci Res, 1998,54(6):721-733.
[11]ZHU M Y, WANG W P, BISSETTE G. Neuroprotective effects of agmatine against cell damage caused by glucocorticoids in cultured rat hippocampal neurons[J]. Neuroscience, 2006,141(4):2019-2027.
[12]MARK R J, LOVELL M A, MARKESBERY W R, et al. A role for 4-hydroxynonenal, an aldehydic product of lipid pero-xidation, in disruption of ion homeostasis and neuronal death induced by amyloid beta-peptide[J]. J Neurochem, 1997,68(1):255-264.
[13]TAMAGNO E, BARDINI P, OBBILI A, et al. Oxidative stress increases expression and activity of BACE in NT2 neurons[J]. Neurobiol Dis, 2002,10(3):279-288.
[14]GAO S, JIN Y, HALL K S, et al. Selenium level and cognitive function in rural elderly Chinese[J]. Am J Epidemiol, 2007,165(8):955-965.
[15]CORNELLI U. Treatment of Alzheimer’s disease with a cholinesterase inhibitor combined with antioxidants[J]. Neurodegener Dis, 2010,7(1/3):193-202.
[16]MESEGUER I, MOLINA J A, JIMENEZ-JIMENEZ F J, et al. Cerebrospinal fluid levels of Selenium in patients with Alzheimer’s disease[J]. J Neural Transm, 1999,106(3/4):309-315.
[17]LEITE R, JACOB-FILHO W, SAIKI M, et al. Determination of trace elements in human brain tissues using neutron activation analysis[J]. Journal of Radioanalytical and Nuclear Che-mistry, 2008,278(3):581-584.
[18]STROZYK D, LAUNER L J, ADLARD P A, et al. Zinc and Copper modulate Alzheimer Abeta levels in human cerebrospinal fluid[J]. Neurobiol Aging, 2009,30(7):1069-1077.
[19]LOVELL M A, XIONG S, LYUBARTSEVA G, et al. Organoselenium (Sel-Plex diet) decreases amyloid burden and RNA and DNA oxidative damage in APP/PS1 mice[J]. Free Radic Biol Med, 2009,46(11):1527-1533.
[20]LOEF M, SCHRAUZER G N, WALACH H. Selenium and Alzheimer’s disease: a systematic review[J]. J Alzheimers Dis, 2011,26(1):81-104.
[21]VAN EERSEL J, KE Y D, LIU X, et al. Sodium selenate mitigates tau pathology, neurodegeneration, and functional deficits in Alzheimer’s disease models[J]. Proc Natl Acad Sci USA, 2010,107(31):13888-13893.
