子宫内膜样腺癌组织eIF-4A与Cyclin D1表达及意义
2014-03-22,,,
,,,
(青岛大学附属医院妇科,山东 青岛 266003)
子宫内膜癌是女性常见的生殖系统恶性肿瘤,近年来在欧美国家其发病率逐渐升高并超过宫颈癌位居妇科恶性肿瘤的第一位[1]。真核起始因子-4A(eIF-4A)是DEAD盒蛋白家族中的一种ATP依赖的双向非连续性的RNA解旋酶[2]。研究显示,eIF-4A在某些肿瘤细胞系中过度表达,提示eIF-4A蛋白可作为恶性肿瘤的预测指标及抗癌治疗的潜在靶点。而肿瘤发生的本质为细胞失控性增殖,细胞周期蛋白D1 (Cyclin D1)是细胞周期蛋白家族重要成员,在细胞由G1期进入S期的过程中起重要作用,其过表达与细胞异常转化密切相关[3]。目前,国内外关于eIF-4A与Cyclin D1在子宫内膜癌组织表 达相关性的研究较少。本研究通过检测子宫内膜样腺癌组织中eIF-4A与Cyclin D1的表达,探讨两者与子宫内膜样腺癌生物学行为之间的相关性。
1 资料和方法
1.1 一般资料
子宫内膜样腺癌组织标本120例,均来自我院2010年1月—2012年12月行手术治疗的病人,病人年龄37~64岁,中位年龄55岁。按FIGO(2009年)分期,Ⅰ期34例,Ⅱ期40例,Ⅲ-Ⅳ期46例;组织学分级:高分化癌48例,中分化癌34例,低分化癌38例;肌层浸润深度<1/2者77例,肌层浸润深度≥1/2者43例;无淋巴结转移31例,有淋巴结转移者89例。所有病例均经病理确诊,术前均未经任何治疗,临床资料完整。选择同期因子宫肌瘤行全子宫切除术病人经病理证实的正常子宫内膜组织标本40例为对照。所有病人对本研究均知情同意。
1.2 试剂
羊抗人eIF-4A多克隆抗体、兔抗人Cyclin D1单克隆抗体、梯度蛋白标准均购自美国Santa Cruze公司,SP免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组化染色方法
免疫组化染色严格按试剂盒说明书要求进行操作。所有标本均经甲醛固定、石蜡包埋、4 μm厚连续切片。组织切片常规脱蜡,逐级乙醇入水,采用SP法检测eIF-4A和Cyclin D1蛋白的表达。羊抗人eIF-4A多克隆抗体、兔抗人Cyclin D1单克隆抗体稀释度均为1∶50,采用PBS缓冲液代替一抗作为阴性对照。
1.4 结果判定
染色结果由两位病理专家根据显色强度和染色细胞百分率进行半定量判定。eIF-4A蛋白表达定位于细胞质,Cyclin D1蛋白表达定位于细胞核。按显色强度计分:不着色为0分,着淡黄色为1分,着棕黄色为2分,着棕褐色或者出现粗大的棕褐色颗粒为3分。按染色细胞百分率计分:无染色细胞为0分,1%~20%为1分,21%~50%为2分,>50%为3分。两者评分相加为最后得分,0~3分为阴性表达,≥4分为阳性表达。
1.5 统计学处理
应用SPSS 16.0统计学软件进行分析。采用四格表χ2检验及两分类变量关联性分析进行数据处理,以P<0.05为差异有统计学意义。
2 结 果
2.1 eIF-4A和Cyclin D1在正常子宫内膜及子宫内膜样腺癌组织中的表达
eIF-4A蛋白定位于细胞质,呈棕色颗粒状,其在子宫内膜样腺癌组织中的阳性表达率为76.7%(92/120),在正常子宫内膜组织中的阳性表达率为20.0%(8/40)。Cyclin D1蛋白定位于细胞核中,其在子宫内膜样腺癌组织中的阳性表达率为79.3%(95/120),在正常子宫内膜组织中的阳性表达率为17.5%(7/40)。子宫内膜样腺癌组织中eIF-4A和Cyclin D1蛋白的阳性表达率明显高于正常子宫内膜组织(χ2=38.72、46.73,P<0.01)。见图1。
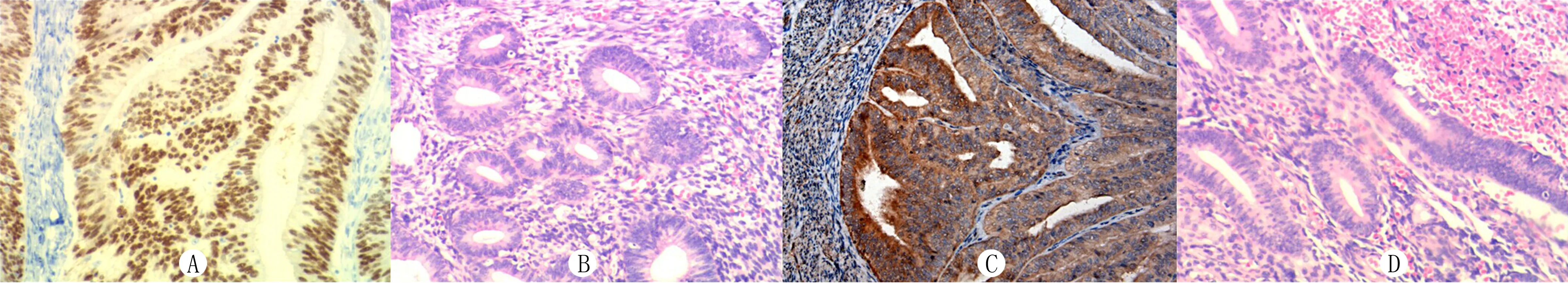
A:Cyclin D1在子宫内膜样腺癌组织中的表达;B:Cyclin D1在正常子宫内膜组织中不表达;C:eIF-4A在子宫内膜样腺癌组织中的表达;D:eIF-4A在正常子宫内膜组织中不表达。
图1eIF-4A和CyclinD1在正常子宫内膜及子宫内膜样腺癌组织中的表达
2.2 eIF-4A和Cyclin D1的表达与子宫内膜样腺癌临床病理特征的关系
eIF-4A蛋白在子宫内膜样腺癌组织中的表达与肿瘤的临床病理分期、淋巴结转移、组织分化程度有关(χ2=4.36~13.36,P<0.05),而与肿瘤的肌层浸润深度无关(P>0.05);Cyclin D1蛋白在子宫内膜样腺癌组织中的表达与肿瘤的组织分化程度及淋巴结转移有关(χ2=24.73、5.24,P<0.05),而与病人的临床病理分期及肿瘤肌层浸润深度无关(P>0.05)。见表1。
2.3 子宫内膜样腺癌组织eIF-4A和Cyclin D1表达的相关性
eIF-4A阳性表达92例病人中有85例Cyclin D1阳性表达,eIF-4A阴性表达的28例子宫内膜样腺癌病人中仅10例Cyclin D1阳性表达,子宫内膜样腺癌组织eIF-4A与Cyclin D1的表达呈显著正相关(r=0.824,P<0.01)。
3 讨 论
肿瘤发病的本质在于细胞周期调控紊乱,细胞呈现失控性生长和凋亡减少[4]。CCND1 基因编码产物Cyclin D1是一种关键的细胞周期调控蛋白,它可促进细胞由G1期向S期转化,在细胞周期G1-S期转换中具有重要的调节作用,在多种肿瘤中存在过度表达[5-6]。在肿瘤发生发展的过程中,恶性组织的增生需要大量蛋白质的合成,许多与肿瘤相关 的蛋白异常表达,这些蛋白在翻译水平上可能存在共同的调控原因。eIF-4A是一种ATP依赖性RNA结合蛋白、RNA依赖性ATP酶及RNA解旋酶,它在真核翻译起始进程中发挥重要作用。
表1eIF-4A、CyclinD1在子宫内膜样腺癌组织表达及其与临床病理特征的关系(例(χ/%))

临床病理特征neIF-4A阳性χ2PCyclin D1阳性χ2P病理分期 Ⅰ3420(58.8)26(66.5) Ⅱ4028(70.0)31(77.5) Ⅲ-Ⅳ4644(95.7)16.31<0.0538(82.6)0.55>0.05组织学分级 高分化4830(62.5)30(62.5) 中分化3426(76.5)27(79.4) 低分化3836(94.7)12.32<0.0538(100)24.73<0.05肌层浸润 <1/27758(75.3)58(75.3) ≥1/24334(79.1)0.22>0.0537(86.0)1.33>0.05淋巴结转移 有3128(90.3)29(93.5) 无8964(71.9)4.36<0.0566(74.2)5.24<0.05
本文结果显示,子宫内膜样腺癌组织eIF-4A蛋白表达明显高于正常子宫内膜组织,提示eIF-4A在子宫内膜恶性转化过程中可能起一定作用。结合分子生物学机制,考虑eIF-4A可能通过被eIF-4E带到mRNA的5′端,让eIF-4A发挥解旋酶活性从而打开mRNA 5′端非翻译区的二级和三级结构,以使核糖体附着更容易,同时允许核糖体进行起始密码子扫描,启动翻译过程[7]。目前研究显示,由eIF-4A参与构成的eIF-4F复合体与帽结构的亲和力高于游离eIF-4E与帽结构的亲和力的10倍,从而加速翻译过程[8]。
本文结果显示,eIF-4A蛋白在子宫内膜样腺癌组织中的表达与肿瘤的临床病理分期及有无淋巴结转移密切相关,提示eIF-4A可能参与了子宫内膜样腺癌的进展及转移过程,或者说eIF-4A表达高的子宫内膜样腺癌更易发生淋巴结转移、进展更快。由于eIF-4A在肿瘤淋巴结转移过程中起重要作用,可将其作为临床预测淋巴结转移的指标,指导子宫内膜癌的治疗。高分化子宫内膜样腺癌组织eIF-4A蛋白的表达低于低分化癌,提示eIF-4A蛋白与癌细胞的分化不良可能存在一定的相关性;但是中分化子宫内膜样腺癌与高分化癌eIF-4A表达无统计学差异,表明细胞分化呈连续性,体现一个由量变到质变的过程。
目前研究认为,当Cyclin D1 表达失控时,则将引起细胞增殖失调,进而导致肿瘤形成[9]。本文结果显示,子宫内膜样腺癌组织Cyclin D1的表达明 显高于正常子宫内膜,提示Cyclin D1与子宫内膜的失控性增长、恶性转化可能有关。进一步分析结果显示,Cyclin D1与子宫内膜样腺癌的组织分化程度及淋巴结转移密切相关,提示子宫内膜样腺癌组织中Cyclin D1的过度表达可能预示肿瘤有较高的侵袭性、容易发生转移和预后不良。但子宫内膜样腺癌组织中Cyclin D1的表达与肿瘤的临床病理分期及肌层浸润深度无关,考虑在疾病的发展进程中,细胞一旦启动恶性转化可能存在一定的阈值。
许多研究结果表明,细胞生长增殖与蛋白质翻译过程密切相关,但这种联系的分子基础尚不明确。Cyclin D1可与细胞周期蛋白依赖激酶(CDK)结合形成特异性底物控制细胞周期进程。而eIF-4A与A型CDK(CDKA)经免疫沉淀法结合,其复合物在活化增殖的细胞中含量最多[10]。Cyclin D1通过控制细胞G1-S期的进程而控制细胞增生,其过度表达与人类肿瘤密切相关[11]。而eIF-4A解旋酶活性在基因翻译起始进程中发挥重要的作用——控制RNA翻译为蛋白质。Cyclin D1和eIF-4A在子宫内膜癌发生中是否起协同作用呢?本研究结果显示,Cyclin D1与eIF-4A在子宫内膜样腺癌组织表达呈显著正相关,提示肿瘤细胞的翻译起始过程与细胞有丝分裂之间可能存在密切联系,子宫内膜癌组织中eIF-4A高表达可导致Cyclin D1表达水平增高,而eIF-4A对Cyclin D1表达起调控作用。
总之,在子宫内膜癌发生发展过程中,eIF-4A对Cyclin D1表达可能起调控作用,两者有望成为预测子宫内膜癌恶性程度的重要生物学指标,指导临床治疗方案的选择。
[参考文献]
[1]张乃怿,吴成,廖秦平. 子宫内膜癌的现状和筛查[J]. 中华临床医师杂志:电子版, 2011,5(3):804-809.
[2]ROGERS G W, KOMAR A A, MERRICK W C. eIF4A: the godfather of the DEAD box helicases[J]. Prog Nucleic Acid Res Mol Biol, 2002,72:307-331.
[3]KNUDSEN K E, DIEHL J A, HAIMAN C A, et al. Cyclin D1: polymorphism, aberrant splicing and cancer risk[J]. Oncogene, 2006,25(11):1620-1628.
[4]SHERR C J. Cancer cell cycles[J]. Science, 1996,274(5293):1672-1677.
[5]COQUERET O. Linking cyclins to transcriptional control[J]. Gene, 2002,299(1/2):35-55.
[6]刘文凤,王言奎,吕艳. 宫颈癌组织CyclinD1和P27表达及意义[J]. 齐鲁医学杂志, 2011,26(5):405-407,411.
[7]HERNANDEZ G, VAZQUEZ-PIANZOLA P. Functional diversity of the eukaryotic translation initiation factors belonging to eIF4 families[J]. Mech Dev, 2005,122(7/8):865-876.
[8]VON DER HAAR T, BALL P D, MCCARTHY J E. Stabilization of eukaryotic initiation factor 4E binding to the mRNA 5′-Cap by domains of eIF4G[J]. J Biol Chem, 2000,275(39):30551-30555.
[9]GAO P, ZHOU G Y, LIU Y, et al. Alteration of cyclin D1 in gastric carcinoma and its clinicopathologic significance[J]. World J Gastroenterol, 2004,10(20):2936-2939.
[10]HUTCHINS A P, ROBERTS G R, LLOYD C W, et al. In vivo interaction between CDKA and eIF4A: a possible mechanism linking translation and cell proliferation[J]. FEBS Lett, 2004,556(1/3):91-94.
[11]ALAO J P. The regulation of cyclin D1 degradation: roles in cancer development and the potential for therapeutic invention[J]. Mol Cancer, 2007,6(10/3/4/3/10/jch):24.
