卵巢上皮癌组织Id-1和HO-1表达及临床意义
2014-03-22,,,,
,,,,
(青岛大学医学院附属医院妇科,山东 青岛 266003)
卵巢癌发现时多为晚期,死亡率位居妇科恶性肿瘤首位。分化抑制因子-1(Id-1)能阻碍DNA与转录因子结合,调控细胞增殖分化[1],与肿瘤血管生成和肿瘤的发生、发展及侵袭密切相关。血红素加氧酶(HO)作为一种诱导型蛋白存在于哺乳动物体内,当机体器官受损时诱导HO-1表达发挥抗氧化作用[2],HO-1过表达不仅能刺激肿瘤细胞生长,增强肿瘤细胞抗氧化及抗凋亡能力,而且能促进肿瘤血管生长和肿瘤细胞转移等。本文采用免疫组化方法检测了Id-1和HO-1在卵巢上皮癌、卵巢良性肿瘤及正常卵巢组织表达情况,探讨两种因子在卵巢上皮癌发生、发展中可能的作用。
1 材料与方法
1.1 标本及其来源
2010年1月—2012年2月,收集我院妇科病人的手术组织标本,其中卵巢上皮癌组织标本50例(均行卵巢癌肿瘤细胞减灭术,术前均未行化疗或放疗,术后病理确诊为卵巢上皮癌),良性卵巢肿瘤标本45例及正常卵巢组织标本15例。卵巢癌病人年龄27~73岁,其中≥50岁29例,<50岁21例;高中分化19例,低分化31例;肿瘤直径≥5 cm者31例,<5 cm者19例;术前有大量腹水者33例,无或少量腹水者17例;术前CA125水平≥200 kU/L者42例,<200 kU/L者8例;浆液性腺癌41例,黏液性腺癌6例,透明细胞癌3例;淋巴结转移阳性者30例,淋巴结转移阴性者20例;I~Ⅱ期22例,Ⅲ~Ⅳ期28例(按FIGO 2000年卵巢癌分期标准)。对照组分别为因卵巢肿瘤行患侧卵巢切除术的病人(术后病理为良性卵巢肿瘤)和因子宫肌瘤行全子宫加双附件切除术的病人(术后病理均为子宫平滑肌瘤,卵巢组织无异常)。
1.2 主要试剂
Id-1及HO-1单抗购于北京博奥森生物技术有限公司,SP试剂盒和DNA显色试剂盒均购于北京 中杉金桥生物技术有限公司,磷酸盐缓冲液(PBS)购自上海研生生物技术有限公司。
1.3 检测指标和方法
Id-1及HO-1的检测均采用免疫组织化学SP法,主要步骤按照试剂盒说明书操作。试验以已知Id-1及HO-1阳性切片作为阳性对照,以PBS替代一抗作为阴性对照。
1.4 结果判定
Id-1阳性表达主要在细胞质,部分在细胞核中,HO-1阳性表达位于细胞核。随机选择5个高倍视野,计数100个以上肿瘤细胞。根据阳性细胞数及细胞染色强度进行判断。阳性细胞数<5%,计0分;阳性细胞数5%~25%,计1分;阳性细胞数26%~50%,计2分;阳性细胞数51%~75%,计3分;阳性细胞数>75%,计4分。根据阳性着色强度不同依次计0、1、2、3分(不着色为0分,浅棕色为1分,棕黄色为2分,棕褐色为3分),将每张切片的两项分数累计,0分为阴性,1~2分为弱阳性(+),3~4分为阳性(),5~6分为强阳性()。
1.5 统计学方法
采用SPSS 17.0统计软件对数据进行χ2检验或Fisher精确概率检验。Id-1及HO-1的关系采用Spearman等级相关分析。
2 结 果
2.1 各组Id-1及HO-1的表达
Id-1在细胞质和细胞核中均有表达,卵巢上皮癌、良性卵巢肿瘤及正常卵巢组织中Id-1阳性表达率分别为88.0%、48.9%与13.3%。HO-1在细胞核中表达,卵巢上皮癌、良性卵巢肿瘤及正常卵巢组织中HO-1阳性表达率分别为76.0%、44.4%和0。Id-1和HO-1在正常卵巢、卵巢良性肿瘤及卵巢上皮癌组织中的表达差异均有显著性(χ2=6.838~31.097,P<0.05)。
2.2 Id-1及HO-1表达与卵巢上皮癌病人临床病理特征的关系
Id-1和HO-1的表达与病人年龄、肿瘤大小、临床分期和有无腹水等均无关(P>0.05),而与术前的CA125水平、病理分级和淋巴结转移有关(χ2=4.678~7.739,P<0.05)。见表1。
2.3 卵巢上皮癌组织中Id-1及HO-1表达相关性
在50例卵巢上皮癌组织中,Id-1及HO-1表达均阳性者29例,均阴性者9例,两者表达呈正相关(r=0.390,P<0.05)。
表1Id-1和HO-1表达与卵巢上皮癌病人临床病理特征的关系(例)
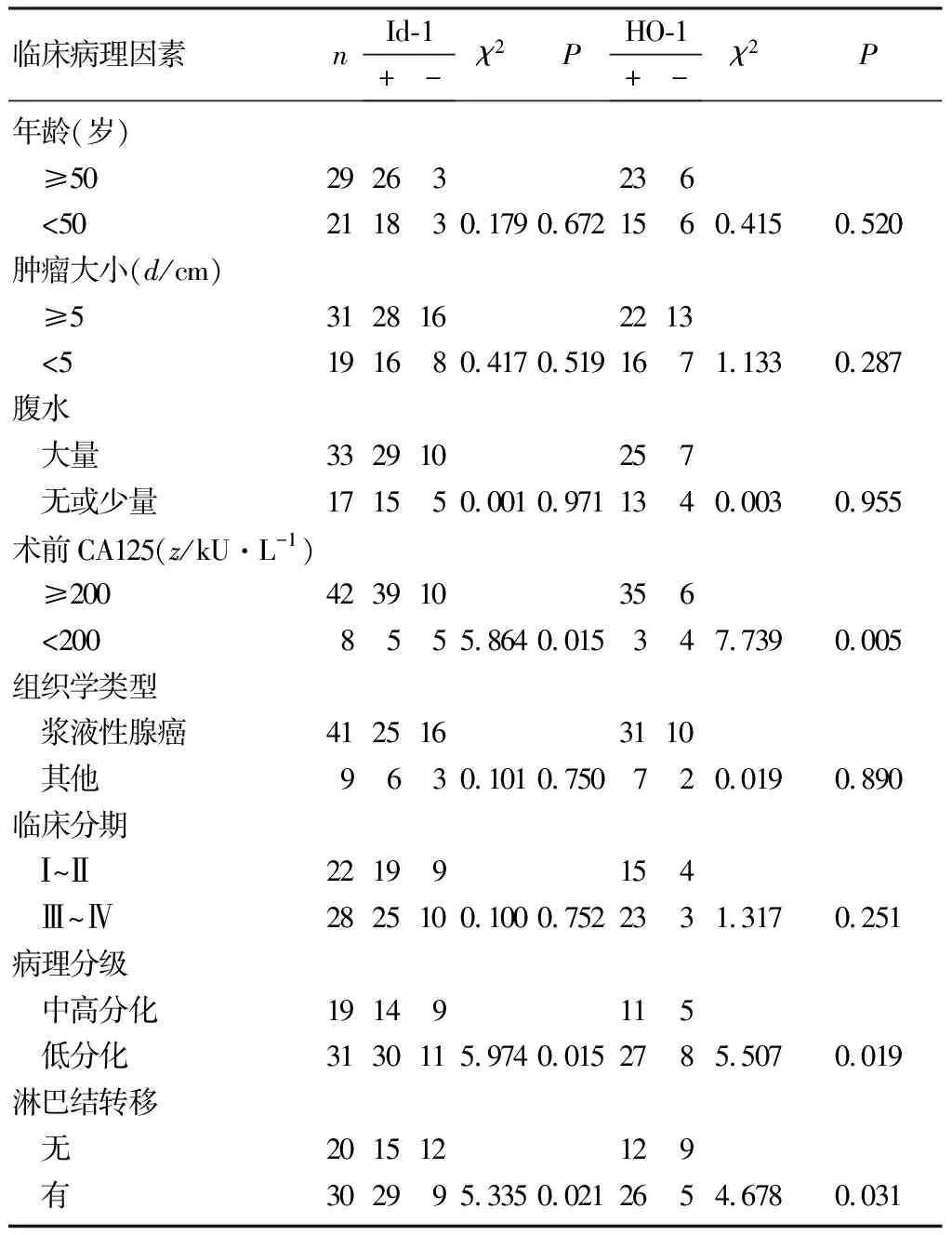
临床病理因素nId-1+-χ2PHO-1+-χ2P年龄(岁) ≥5029263236 <50211830.1790.6721560.4150.520肿瘤大小(d/cm) ≥53128162213 <5191680.4170.5191671.1330.287腹水 大量332910257 无或少量171550.0010.9711340.0030.955术前CA125(z/kU·L-1) ≥200423910356 <2008555.8640.015347.7390.005组织学类型 浆液性腺癌4125163110 其他9630.1010.750720.0190.890临床分期 Ⅰ~Ⅱ22199154 Ⅲ~Ⅳ2825100.1000.7522331.3170.251病理分级 中高分化19149115 低分化3130115.9740.0152785.5070.019淋巴结转移 无201512129 有302995.3350.0212654.6780.031
3 讨 论
3.1 Id-1与卵巢上皮癌的关系
Id-1是Id蛋白家族成员,既参与正常细胞分化调控,还影响肿瘤细胞分化,主要通过促进肿瘤血管生成以及浸润转移,调控细胞定向分化,抑制细胞凋亡等发挥作用[3]。肿瘤的血管生成受多种细胞因子调控,其中血管内皮细胞生长因子(VEGF)是肿瘤生长及远处转移的必要条件。LING等[4]在前列腺癌细胞中通过RNA干扰抑制Id-1的表达,结果显示VEGF表达水平也明显下降。最近研究显示,在宫颈癌进展中,Id-1可能是通过促进肿瘤血管生成而促肿瘤生成的[5]。Id-1诱导的癌细胞增生可以通过抑制p53信号通路和活化NF-κB信号通路,下调caspase3的表达水平,阻止肿瘤细胞的凋亡[6]。还有研究结果显示,Id-1过表达与EGFR表达增高有关,阻断Id-1的表达可抑制卵巢癌细胞浸润转移[7]。上述研究均证实,Id-1可有效促进肿瘤发生、发展。本文研究结果显示,Id-1在卵巢癌组织中高表达。SCHINDL等[8]研究亦显示,卵巢癌组织Id-1过表达,与本研究结果一致。同时本研究结果显示,Id-1的表达与病人术前CA125水平、淋巴结转移和病理分级密切相关。这表明Id-1可能与卵巢上皮癌的发生、发展有关。
3.2 HO-1与卵巢上皮癌的关系
HO-1对肿瘤细胞具有抗凋亡作用,可能是通过降低细胞内促氧化剂浓度、增高胆红素水平、提高CO生成来抑制细胞凋亡。HO-1与肿瘤的血管生成密切相关,而血管生成与肿瘤生长、侵袭和转移有关。主要表现在HO-1和VEGF之间的作用。在研究VEGF对HO-1的影响实验中发现,在肺腺癌细胞中加入HO-1抑制剂锌-原卟啉后,VEGF合成减少,血管生成被抑制,同时VEGF对HO-1合成有调节作用[9]。近期研究结果证实,体外下调HO-1的表达可通过影响caspase3活性抑制人肝癌细胞的凋亡[10]。HO-1所具有的抗凋亡作用还可以通过Nrf2-ARE通路来实现。保肝药物可激活Nrf2-ARE,通过抗氧化酶(如HO-1)抑制ROS的产生,对肝细胞发挥保护作用[11-12]。总之,HO-1通过以上途径促进肿瘤的发生、发展。
本文的研究结果显示,HO-1在卵巢癌组织中呈高表达,推测HO-1可能是卵巢癌形成的重要因素之一。同时本文的研究结果还显示,HO-1阳性表达与病人术前CA125水平、淋巴结转移和病理分级密切相关。由此可见,肿瘤恶性程度越高,HO-1的表达水平越高。这表明HO-1可能与卵巢上皮癌的发生、进展有关。
3.3 Id-1和HO-1之间的关系
本研究结果显示,卵巢上皮癌组织中Id-1和HO-1的表达呈正相关,即Id-1活化的肿瘤组织中存在HO-1的高水平表达。关于卵巢癌组织中Id-1和HO-1相关性研究,国内外鲜有报道。本研究可推测卵巢癌形成及发展过程中,两者具有协同作用,很可能存在VEGF、caspase3共同通路,但具体作用机制还需更深入的研究。这些研究可能成为卵巢癌治疗的实验依据。
总之,Id-1和HO-1的表达水平与卵巢癌发生、发展相关,为卵巢癌进一步的研究和治疗提供了新依据,有望作为卵巢上皮癌的诊断性标志物,并为卵巢癌治疗提供新思路。
[参考文献]
[1]O′TOOLE P J, INOUE T, EMERSON L, et al. Id proteins negatively regulate basic helix-loop-helix transcription factor function by disrupting subnuclear compartmentalization[J]. J Biol Chem, 2003,278(46):45770-45776.
[2]刘召梅,杨艳,赵娜,等. 维生素C并EPO对大鼠肾脏缺血再灌注损伤保护作用[J]. 齐鲁医学杂志, 2013,28(1):39-41,43.
[3]YOKOTA Y, MORI S. Role of Id family proteins in growth control[J]. J Cell Physiol, 2002,190(1):21-28.
[4]LING M T, LAU T C, ZHOU C, et al. Overexpression of Id-1 in prostate cancer cells promotes angiogenesis through the activation of vascular endothelial growth factor (VEGF)[J]. Carcinogenesis, 2005,26(10):1668-1676.
[5]张程玲,李金科,张程珑,等. 分化抑制因子Id-1与VEGF及MVD在宫颈癌变中的相关性分析[J]. 现代妇产科进展, 2013,22(1):10-12.
[6]KIM H, CHUNG H, KIM H J, et al. Id-1 regulates Bcl-2 and Bax expression through p53 and NF-kappaB in MCF-7 breast cancer cells[J]. Breast Cancer Res Treat, 2008,112(2):287-296.
[7]ZHANG X, LING M T, FENG H, et al. Id-Ⅰ stimulates cell proliferation through activation of EGFR in ovarian cancer cells[J]. Br J Cancer, 2004,91(12):2042-2047.
[8]SCHINDL M, SCHOPPMANN S F, STROBEL T, et al. Level of Id-1 protein expression correlates with poor differentiation, enhanced malignant potential, and more aggressive cli-nical behavior of epithelial ovarian tumors[J]. Clin Cancer Res, 2003,9(2):779-785.
[9]HIRAI K, SASAHIRA T, OHMORI H, et al. Inhibition of heme oxygenase-1 by Zinc protoporphyrin Ⅸ reduces tumor growth of LL/2 lung cancer in C57BL mice[J]. Int J Cancer, 2007,120(3):500-505.
[10]刘养岁,曹能琦,蒋维维,等. 血红素氧合酶-1对人肝癌SMMC-7721细胞5-FU化疗敏感性的影响[J]. 中华肿瘤防治杂志, 2010,17(15):1156-1159.
[11]KUMAR K J, CHU F H, HSIEH H W, et al. Antroquinonol from ethanolic extract of mycelium of Antrodia cinnamomea protects hepatic cells from ethanol-induced oxidative stress through Nrf-2 activation[J]. J Ethnopharmacol, 2011,136(1):168-177.
[12]TIAN F F, ZHANG F F, LAI X D, et al. Nrf2-mediated protection against UVA radiation in human skin keratinocytes[J]. Biosci Trends, 2011,5(1):23-29.
