氟西汀对hERG钾通道的阻断作用及佛波酯的抑制作用
2014-03-22汪溪洁惠涛涛
汪溪洁,惠涛涛,宋 征,马 璟
(国家上海新药安全评价研究中心,上海 201203)
氟西汀对hERG钾通道的阻断作用及佛波酯的抑制作用
汪溪洁,惠涛涛,宋 征,马 璟
(国家上海新药安全评价研究中心,上海 201203)
目的 探讨氟西汀对hERG(ether-a-go-go-related gene)钾通道的作用及蛋白激酶C(PKC)激动剂佛波酯(PMA)对氟西汀作用的影响。方法 采用全细胞膜片钳技术记录氟西汀0.01,0.1,1和10 μmol·L-1处理后稳定表达hERG钾通道的HEK293细胞(hERG-HEK293稳态细胞)上hERG钾通道电流(IKr)的变化,研究氟西汀对IKr作用的浓度依赖性和电压依赖性,并观察氟西汀1 μmol·L-1处理后hERG钾通道激活、失活和复活动力学的变化。在此基础上,观察PMA 1 μmol·L-1对氟西汀1 μmol·L-1作用IKr后的影响。结果 氟西汀0.01,0.1,1和10 μmol·L-1对hERG-HEK293稳态细胞上IKr具有浓度依赖性和电压依赖性的抑制作用,半数抑制浓度(IC50)约为0.8 μmol·L-1,Hill系数约为1.1。氟西汀1 μmol·L-1可以减小IKr激活、失活和复活电流,并影响hERG钾通道的激活和复活过程。在氟西汀对IKr电流的抑制作用达到稳态后,PMA 1 μmol·L-1可抑制氟西汀对hERG钾通道的阻断作用。结论 氟西汀对hERG-HEK293稳态细胞上hERG钾通道具有明显的阻断作用,该作用可被PKC激动剂PMA抑制。
氟西汀;hERG;膜片钳技术;全细胞记录
抑郁症是危害人类健康的慢性疾病,据世界卫生组织预测,到2020年抑郁症将成为仅次于心血管疾病的第二大疾病。氟西汀是一种选择性5-羟色胺重摄取抑制剂类抗抑郁药,广泛应用于临床。已证实氟西汀是一种可诱发QT间期延长的药物[1],其作用机制尚未十分明确。
自1964年Selzer和Wray[2]报道了奎尼丁引起QT间期延长和室颤发作的病例以来,由各种不同药物引起的QT间期延长时有报道。迄今为止,已发现的QT间期延长致病基因有10个,分别编码不同的通道亚单位[3]。人类ether-a-go-go相关基因(human ether-a-go-go related gene,hERG)编码的钾通道被认为是诱发QT间期延长的药物优先阻滞的主要离子通道之一。hERG钾通道编码快速型延迟整流钾通道(rapidly delayed rectifier potassium channel,Ikr)的α亚基[4],是一种电压门控型钾离子通道,主要表达在心肌[5],并在心肌细胞动作电位的复极化过程中扮演重要角色。阻断hERG钾通道,可诱发QT间期延长,最终甚至导致尖端扭转型室性心动过速(torsade de pointes,Tdp)。已有资料表明,hERG钾通道的功能受到多种因素的调节[6-9],目前研究的较清楚的有蛋白激酶 C (protein kinases C,PKC)、PKA、肾上腺素能受体和Src家族蛋白酪氨酸激酶等。本文应用全细胞膜片钳技术,通过观察氟西汀对hERG-HEK293细胞上hERG钾电流的作用,了解其对hERG钾通道的作用特征,并初步探讨了 PKC激动剂佛波酯(phorbol-12-myristate-13-acetate,PMA)对氟西汀作用hERG钾通道的影响,为氟西汀临床安全用药提供理论依据。
1 材料与方法
1.1 细胞株
稳定表达hERG钾通道的HEK293细胞株(hERG-HEK293稳态细胞,S.A.R.L CREACELL,法国,批号:APC092811)。
1.2 试剂和溶液配制
高糖DMEM培养基、EDTA、胎牛血清、青链霉素、G418和Accutase消化液均购自美国Gibco公司;PMA,氟西汀,NaCl,KCl,MgCl2,CaCl2,HEPES,葡萄糖,EGTA和Mg-ATP均购自美国Sigma公司;其余试剂均为国产分析纯。
细胞外液(mmol·L-1):NaCl 140,KCl 4.5,MgCl21,CaCl22,HEPES 10,葡萄糖10,NaOH调节pH至7.2~7.4;
电极内液(mmol·L-1):KCl 140,Mg-ATP 4,MgCl21,EGTA 5,HEPES 10,KOH调节pH至7.2~7.4;
封接液(mmol·L-1):NaCl 80,KCl 3,MgCl210,CaCl235,HEPES 10,NaOH调节pH至7.2~7.4。
1.3 主要仪器
Patchliner NPC16(Nanion,德国),EPC10膜片钳放大器(HEKA,德国),倒置显微镜(IMT-2,Olympus,日本),细胞培养箱(Forma Scientific,美国)。
1.4 hERG-HEK293稳态细胞的培养
hERG-HEK293稳态细胞株接种于含DMEM-10培养液(DMEM高糖培养液含1.2 g·L-1G-418、10%胎牛血清以及青霉素100 KU·L-1和链霉素100 g·L-1)的培养瓶中,置于37℃、5%CO2培养箱中培养,每2 d更换1次培养液。
1.5 hERG-HEK293稳态细胞的准备
取光镜下细胞色泽较亮,无明显的漂浮细胞,弃取培养液,加入约1 mL Accutase消化液消化,约1 min后加入DMEM-10培养液吹打,使细胞悬浮,将细胞悬液转入一离心管中,184×g离心约5 min,弃去上清液,加入约2 mL细胞外液,吹打使细胞悬浮。然后将吹打后的细胞悬液转入 Patchliner NPC16工作站的细胞槽中。
1.6 全细胞膜片钳记录
实验在室温(22±2)℃下进行。运用EPC10膜片钳放大器和Patchliner NPC16工作站完成全细胞模式的电压钳记录。首先由Patchliner NPC16工作站的机械臂将细胞悬液加到芯片上,通过调节压力和吸力,将一个细胞定位在芯片的一个小孔上(相当于微管电极的尖端)。然后由 Patchliner NPC16工作站完成封接过程,当芯片电极与细胞膜之间形成高阻抗封接(>1 GΩ)后,进一步加负压破膜,使电极内液与细胞内液相通,形成全细胞记录模式,待破膜稳定后补偿膜电容(Cs)及局部串联电阻(Rs)。采集和滤波频率分别为 20 kHz和3 kHz。实验过程中芯片电阻为 2~5 MΩ,Rs<15 MΩ,且以电流稳定的数据为有效数据。记录加入化合物前hERG钾电流(IKr)作为对照,然后换以含氟西汀0.01,0.1,1.0和10 μmol·L-1或PMA 1 μmol·L-1的细胞外液持续记录5 min以上,分别记录加入药物后的IKr。实验过程中,由PatchMaster软件与EPC10放大器连接,用于控制放大器、采集和存储电流信号及在线分析等,Patchcontrol HT则用于完成实验操作。
1.7 电流记录程序
hERG钾通道尾电流:钳制电压为-80 mV,去极化到 +40 mV,时程为2000 ms,然后复极化到-30 mV,时程为2000 ms;
hERG钾通道激活电流:钳制电压为-80 mV,先给予一组-50~+60 mV、10 mV递增、时程为2000 ms的指令电压刺激,再给予在-30 mV,2000 ms的指令电压;
hERG钾通道失活电流:钳制电压为-80 mV,先给予+20 mV、2000 ms的预刺激,再给予一组-130~+20 mV、10 mV递增、时程为30 ms的条件电压刺激,随后给予+20 mV、500 ms测试脉冲电压;
hERG钾通道复活电流:钳制电压为-80 mV,先给予一组+20 ms、时程为20~1420 ms、100 ms递增的预刺激脉冲,再给予在-40 mV、5000 ms的测试脉冲电压。
1.8 数据分析及统计学处理
采用Igor 6.05与Sigmaplot 8.0软件完成数据处理,SAS 9.1软件完成统计分析,实验数据以表示,应用方差分析和t检验进行统计,以P<0.05为差异有显著性。采用 Hill方程(即 I=Imax·拟合得到浓度效应曲线(Imax代表饱和浓度时的最大反应,C1/2为半数抑制浓度,[C]指药物的浓度,h为 Hill系数),获得药物作用的IC50;以膜电位为横坐标,以标化的IKr值为纵坐标,获得加药前后的电流-电压(I-V)曲线;先以方程G=I/(Vm-VhERG)计算电导(G为峰电导,I峰电流,Vm为膜电位,VhERG为翻转电位),再以 G与Gmax的比值对 Vm作图,数据经 Boltzman方程G/Gmax=1/{1+exp[(Vm-V1/2)/k]}(Gmax为峰电导的最大值,V1/2半数激活电压,k激活斜率因子)拟合得到IKr的激活曲线;以I与Imax的比值对Vm作图,数据经Boltzman方程I/Imax=1/{1+exp[(Vm-V1/2)/k]}(Imax为峰尾电流的最大值,Vm为膜电位,V1/2半数失活电压,k失活斜率因子)拟合得到IKr的失活曲线;以测试脉冲刺激下记录的电流峰值(I2)与不同时程超极化预刺激下记录的电流峰值(I1)的比值(I2/I1)对应预刺激脉冲时间用单指数方程拟和得到复活曲线。
2 结果
2.1 氟西汀对hERG-HEK293稳态细胞上hERG钾通道IKr的作用
2.1.1 氟西汀对ItaiI抑制作用的浓度依赖性
氟西汀0.01,0.1,1和10 μmol·L-1对IKr有抑制作用,经细胞外液冲洗后,可部分恢复(图1)。经Hill方程拟合得到氟西汀作用的浓度-效应曲线(图2),随着浓度升高,氟西汀对IKr的抑制作用越明显,提示该抑制作用具有浓度依赖性,半数抑制浓度IC50为(0.8±0.05)μmol·L-1,Hill系数 h为1.1±0.10(n=5,P<0.05)。选择氟西汀1 μmol·L-1进行后续研究。

Fig.1 Effect of fIuoxetine on ether-a-go-reIated gene (hERG)potassium channeI currents(IKr)of HEK293 ceIIs that stabIy expressed hERG potassium channeI (hERG-HEK293 steady-state ceIIs).Traces of IKrevoked in the control and presence of fluoxetine 0.01,0.1,1 and 10 μmol·L-1in a whole-cell patch-clamp configuration.
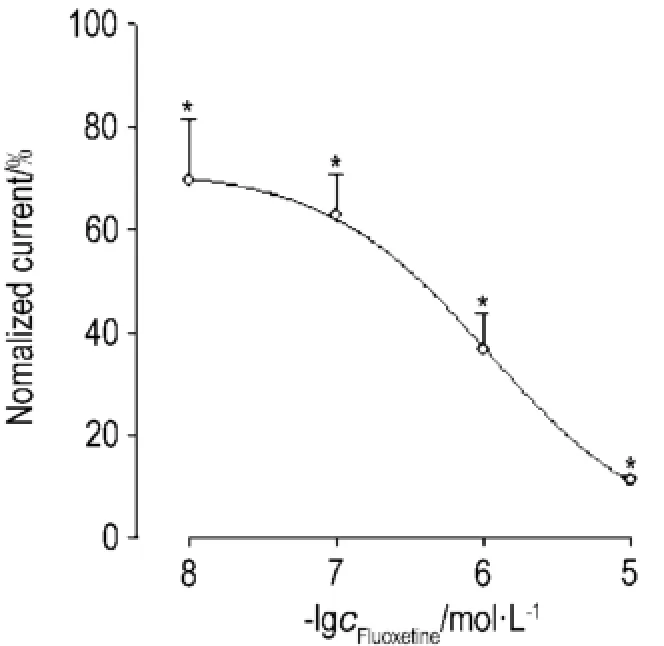
Fig.2 Concentration-response curve for the bIocking action of fIuoxetine on IKr.,n=5.∗P<0.05,compared with the control.
2.1.2 氟西汀对IKr抑制作用的电压依赖性
氟西汀1 μmol·L-1可明显抑制IKr电流,从I-V曲线可见,随着去极化程度的增加,IKr减小的程度越大,提示氟西汀对IKr的抑制作用具有明显的电压依赖性(图3)。
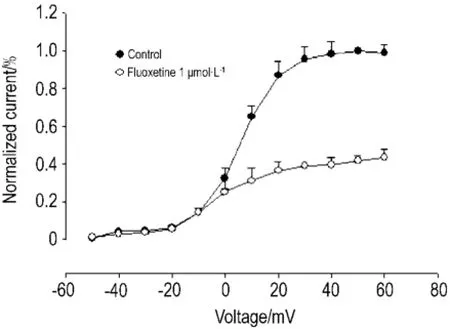
Fig.3 Effect of fIuoxetine 1 μmoI·L-1on current-voItage reIationship of IKr.n=4.
2.1.3 氟西汀对hERG钾通道激活动力学的影响
氟西汀1 μmol·L-1可减小IKr激活电流,经Boltzmann方程拟合得到激活曲线,加药前后IKr的半数激活电压V1/2分别为(18.9±2.8)mV和(22.9± 3.3)mV(n=4,P<0.05),激活斜率因子k值分别为16.5±1.7和15.1±2.1,提示氟西汀1 μmol·L-1使IKr激活曲线向去极化方向移动了约4 mV(图4)。
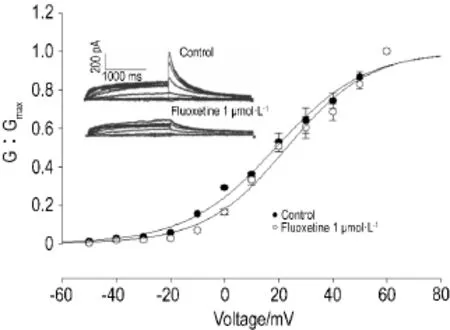
Fig.4 Effect of fIuoxetine 1 μmoI·L-1on activation dynamics of hERG potassium channeI.n=4.
2.1.4 氟西汀对hERG钾通道失活动力学的影响
氟西汀1 μmol·L-1可减小IKr失活电流,经Boltzmann方程拟合得到失活曲线,加药前后IKr的半数失活电压V1/2分别为(-87.0±6.5)mV和(-89.9± 5.8)mV(n=4,P>0.05),失活斜率因子k值分别为-19.6±3.8和-19.8±3.2,提示氟西汀1 μmol·L-1对IKr失活曲线几乎无影响(图5)。
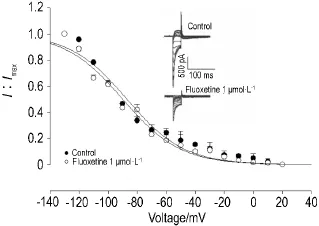
Fig.5 Effect of fIuoxetine 1 μmoI·L-1on inactivation dynamics of hERG potassium channeIn=4.
2.1.5 氟西汀对hERG钾通道复活动力学的影响
氟西汀1 μmol·L-1可减小IKr复活电流,经单指数方程拟和得到复活曲线,加入氟西汀前后复活时间常数τ分别为(71.4±3.4)ms和(82.0±2.2)ms (n=3,P<0.05)(图6)。
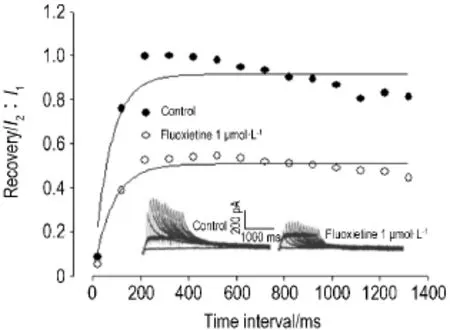
Fig.6 Effect of fIuoxetine 1 μmoI·L-1on recovery dynamics of hERG potassium channeI.n=3.
2.2 PMA对氟西汀抑制IKr作用的影响
氟西汀1 μmol·L-1可使IKr明显减小,电流为加药前的(36.6±7.1)%,待作用稳定后,加入PMA 1 μmol·L-1,IKr轻微增大,电流为加药前的(50.7± 4.4)%(n=3,P<0.05)(图7)。

Fig.7 Inhibition of phorboI-12-myristate-13-acetate (PMA)on the bIocking effect of fIuoxetine on IKr.
3 讨论
本研究表明,氟西汀可抑制IKr,随着浓度升高,抑制作用越明显,提示氟西汀对hERG钾通道的阻断作用具有浓度依赖性。经细胞外液冲洗后,可部分恢复,提示氟西汀对IKr的抑制作用具有一定的可逆性。IC50约0.8 μmol·L-1,Hill系数约1.1,提示氟西汀对hERG钾通道的作用位点可能是唯一的。Thomas等[10]于2002年报道了氟西汀对hERG钾通道的IC50为3.1 μmol·L-1,略高于本实验的结果,可能的原因如下:①他们采用的表达hERG钾通道的爪蟾卵母细胞,该方法是将hERG基因注入爪蟾卵细胞进行表达 hERG钾通道,操作比较复杂;②爪蟾卵母细胞为异源细胞,与人细胞存在着种属的差异,药物对爪蟾卵母细胞上的hERG电流的IC50通常是偏高的。Snyders等[11]于1996年首次提出HEK293细胞可以稳定地表达hERG基因。HEK293细胞是转染腺病毒EIA基因的人肾上皮细胞系,属于人源性细胞,该细胞含有SV4O复制起始点和启动子区的质粒可以复制,因此可连续传代培养而保持表型稳定,具有转染率高,蛋白表达水平高,转染后表达的蛋白易检测的优点。本实验选用更接近人体的哺乳细胞系上稳定表达hERG基因的HEK293细胞,可以消除异源性细胞所带来的种属差异。
本研究结果显示,氟西汀1 μmol·L-1可明显抑制IKr,随着电压的升高,抑制作用越明显,提示氟西汀对hERG钾通道的阻断作用具有电压依赖性。氟西汀1 μmol·L-1减小hERG钾通道激活和失活电流,使hERG钾电流激活曲线向去极化方向移动了约4 mV,失活曲线几乎不改变,提示氟西汀可使hERG钾通道的激活阈值轻微增高,失活阈值不变,进而使hERG钾通道开放电位范围轻微减小,开放时间略有缩短。当去极化时间较短,通道几乎不开放时,抑制作用很小,当通道完全开放时,抑制作用达到最大。其后,随着时间继续延长,药物阻断作用达平台期。氟西汀1 μmol·L-1可减小hERG钾通道的复活电流,复活时间常数ι增加了约10 ms,提示氟西汀使hERG钾通道的复活时间延长,影响了电流失活后复活的速度。
抗抑郁药自20世纪50年代初问世以来,不断有报道服用抗抑郁药的患者出现心血管系统的不良反应,其毒性机制目前也是人们研究的热点[12]。氟西汀是临床上常用的选择性5-羟色胺重摄取抑制剂类抗抑郁药,1998年Raviña等[13]报道了抑郁症患者服用氟西汀后心电图显示T波倒置及严重变形,同时出现窦性心动过速,并伴随T波电交替和QT间期延长,患者出现晕厥,停药2个月后心电图恢复正常,其后陆续有报道显示氟西汀可致QT间期延长。本研究结果表明,氟西汀阻断hERG钾通道可能是其致QT间期延长的主要原因之一,氟西汀可能通过阻断hERG钾通道,引起外向钾离子电流减少,从而使心肌细胞动作电位QT间期延长,最终甚至导致Tdp。
既然hERG编码的钾通道在氟西汀致QT间期延长的过程中扮演重要角色,我们推测调节hERG钾通道的功能可能影响氟西汀对hERG钾通道的作用。既往的资料显示,hERG钾通道的功能受到多种因素的调节,PKC是其中一个主要的调控因素[6,14-15]。非特异PKC激动剂PMA能诱导hERG的激活,而PKC抑制剂bisindolylmaleimideⅠ能阻断hERG钾电流,Cockerill等[14]还研究发现PKC介导了表达于HEK293中hERG钾通道亚单位的直接磷酸化和毒蕈碱对hERG钾电流的调节。本研究表明,氟西汀1 μmol·L-1可使IKr明显减小,加入PMA 1 μmol·L-1后IKr轻微增大,提示PMA可抑制氟西汀对hERG钾通道的阻断作用,其机制有待进一步研究。
总之,氟西汀对稳定表达hERG钾离子通道的HEK293细胞上hERG钾通道具有明显的抑制作用,该作用可被PKC激动剂PMA影响,这不仅为深入探讨氟西汀致QT间期延长从而引发心脏毒性的机制提供了依据,对选择性5-羟色胺重摄取抑制剂类抗抑郁药在临床上安全应用也具有重要意义。
[1] Wilting I,Smals OM,Holwerda NJ,Meyboom RH,de Bruin ML,Egberts TC.QTc prolongation and torsades de pointes in an elderly woman taking fluoxetine[J].Am J Psychiatry,2006,163(2):325.
[2] Selezer A, Wray HW.Quinidine syncope:paroxysmalventricularfibrillation occurring during treatment of chronic atrial arrhythmias[J].Circulation,1964,30:17-26.
[3] Lehnart SE, Ackerman MJ, Benson DW Jr,Brugada R,Clancy CE,Donahue JK,et al.Inherited arrhythmias:a National Heart,Lung,and Blood Institute and Office of Rare Diseases workshop consensus report about the diagnosis,phenotyping,molecular mechanisms,and therapeutic approaches for primary cardiomyopathies of gene mutations affecting ion channel function[J].Circulation,2007,116(20):2325-2345.
[4] Trudeau MC,Warmke JW,Ganetzky B,Robertson GA.HERG,a human inward rectifier in the voltagegated potassium channel family[J].Science,1995,269(5220):92-95.
[5] Pond AL,Scheve BK,Benedict AT,Petrecca K,Van Wagoner DR,Shrier A,et al.Expression of distinct ERG proteins in rat,mouse,and human heart.Relation to functional IKrchannels[J].J Biol Chem,2000,275(8):5997-6006.
[6] Shu L,Zhang W,Su G,Zhang J,Liu C,Xu J. Modulation of HERG K+channels by chronic exposure to activators and inhibitors of PKA and PKC: actions independent of PKA and PKC phosphorylation[J].Cell Physiol Biochem,2013,32(6): 1830-1844.
[7] Chen J, Sroubek J, Krishnan Y, Li Y,Bian J,McDonald TV.PKA phosphorylation of HERG protein regulates the rate of channel synthesis[J].Am J Physiol Heart Circ Physiol,2009,296(5): H1244-H1254.
[8] Thomas D, Kiehn J, Katus HA, Karle CA. Adrenergic regulation of the rapid component of the cardiac delayed rectifier potassium current,IKr,and the underlying hERG ion channel[J].Basic Res Cardiol,2004,99(4):279-287.
[9] Zhang DY,Wang Y,Lau CP,Tse HF,Li GR. Both EGFR kinase and Src-related tyrosine kinases regulate human ether-à-go-go-related gene potassium channels[J].Cell Signal,2008,20(10): 1815-1821.
[10] Thomas D,Gut B, Wendt-Nordahl G,Kiehn J. The antidepressant drug fluoxetine is an inhibitor of human ether-a-go-go-related gene(HERG)potassium channels[J].J Pharmacol Exp Ther,2002,300(2):543-548.
[11] Snyders DJ,Chaudhary A.High affinityopen channel block by dofetilide of HERG expressed in a human cell line[J].Mol Pharmacol,1996,49(6): 949-955.
[12] Mitsumori Y,Nakamura Y,Hoshiai K,Nagayama Y,Adachi-Akahane S,Koizumi S,et al.In vivo canine model comparison of cardiovascular effects of antidepressants milnacipran and imipramine[J]. Cardiovasc Toxicol,2010,10(4):275-282.
[13] Raviña T,Suarez ML,Mendez-Castrillón J.Fluoxetine-induced QTU interval prolongation,T wave alternans and syncope[J].Int J Cardiol,1998,65 (3):311-313.
[14] Cockerill SL, Tobin AB, Torrecilla I,Willars GB,Standen NB,Mitcheson JS.Modulation of hERG potassium currents in HEK-293 cells by protein kinase C.Evidence for direct phosphorylation of pore forming subunits[J].J Physiol,2007,581 (Pt 2):479-493.
[15] Thomas D,Zhang W,Wu K,Wimmer AB,Gut B,Wendt-Nordahl G,et al.Regulation of HERG potassium channel activation by protein kinase C independent of direct phosphorylation of the channel protein[J].Cardiovasc Res,2003,59(1):14-26.
BIocking effect of fIuoxetine on hERG potassium channeI activity and inhibition by phorboI-12-myristate-13-acetate
WANG Xi-jie,HUI Tao-tao,SONG Zheng,MA Jing
(National Shanghai Center for New Drug Safety Evaluation&Research,Shanghai201203,China)
OBJECTIVE To investigate the action mechanism of antidepressant fluoxetine on hERG (ether-a-go-go-related gene)potassium channel,and the effect of protein kinase C(PKC)agonist phorbol-12-myristate-13-acetate(PMA)on fluoxetine inhibition.METHODS The whole cell patch clamp technique was used to record the change in hERG potassium current(IKr)on HEK293 cells that stably expressed hERG potassium channel(hERG-HEK293 steady-state cells),which was treated with fluoxetine 0.01,0.1,1 and 10 μmol·L-1,to study the concentration-and voltage-dependence of the effects on IKr,and to observe the changes in activation,inactivation and recovery dynamics of hERG potassium channel treated with fluoxetine 1 μmol·L-1.On this basis,the effect of PMA of 1 μmol·L-1on inhibition of fluoxetine 1 μmol·L-1was explored.RESULTS Fluoxetine 0.01,0.1,1 and 10 μmol·L-1inhibited IKron hERG-HEK293 steady-state cells in a concentration-and voltage-dependent manner.The half maximal inhibitory concentration(IC50)was about 0.8 mmol·L-1,and the Hill coefficient was about 1.1. Fluoxetine 1 μmol·L-1could reduce the activation,deactivation and recovery currents of IKrand affect the activation and recovery of hERG potassium channel.After fluoxetine inhibition of IKrbecame stable,PMA 1 μmol·L-1could inhibit the blocking effect of fluoxetine on hERG potassium channels.CONCLUSION Fluoxetine has obvious inhibitory effect on IKrof hERG-HEK293 steady-state cells,but the effect could be inhibited by PKC agonist PMA.
fluoxetine;hERG;patch clamp techniques;whole-cell recording
MA Jing,Tel:(021)50801763,E-mail:jma@ncdser.com
R966
:A
:1000-3002(2014)06-0844-06
10.3867/j.issn.1000-3002.2014.06.005
Foundation item:The projectsupported by NationalScience and Technology MajorProjectof China (2012ZX09505001-003);and Shanghai Science and Technology Innovation Action Plan Project(13140900900)
2014-01-13 接受日期:2014-06-30)
(本文编辑:乔 虹)
国家重大科技专项(2012ZX09505001-003);上海市科技创新行动就计划项目(13140900900)
汪溪洁(1979-),女,博士,副研究员,从事心脏毒理学研究,Tel:13585600131,E-mail:xjwang@ncdser.com;马 璟(1963-),女,博士,研究员,博士生导师,从事毒理学研究
马 璟,Tel:(021)50801763,E-mail: jma@ncdser.com
