糖组学研究技术进展
2014-03-22程肖蕊周文霞张永祥王仲孚黄琳娟
曾 菊,程肖蕊,周文霞,张永祥,王仲孚,黄琳娟
(1.西北大学生命科学学院西部资源生物与现代生物技术教育部重点实验室,陕西西安 710069;2.军事医学科学院毒物药物研究所,北京 100850;3.抗毒药物与毒理学国家重点实验室,北京 100850)
糖组学研究技术进展
曾 菊1,2,3,程肖蕊2,3,周文霞2,3,张永祥2,3,王仲孚1,黄琳娟1
(1.西北大学生命科学学院西部资源生物与现代生物技术教育部重点实验室,陕西西安 710069;2.军事医学科学院毒物药物研究所,北京 100850;3.抗毒药物与毒理学国家重点实验室,北京 100850)
糖组学研究通常包括聚糖组的分离与纯化、糖链组的分离和富集糖链的结构解析和定量以及糖链的性质和功能研究。根据糖蛋白组、蛋白聚糖组和糖脂组生物化学性质的不同,可相应采用分步沉淀法、硼酸亲和法、二氧化钛法、亲和层析法、体积排阻法、凝胶过滤层析和柱层析法等进行分离与纯化,进而通过植物凝集素、亲水色谱和固相萃取等技术富集高纯度且特异性的糖链。通过凝集素芯片技术、各种生物质谱及其联用并辅以糖链的衍生化标记对糖链进行结构解析,并用同位素标记法和代谢标记法对糖链进行相对定量。最后,借助糖链结构解析软件工具及糖链相关数据库进行生物信息学分析,可对糖链的生物学功能进行更全面的解析。本文对复合糖的分离纯化、结构分析以及糖组生物信息研究方法进行了综述。
糖组;糖组学;糖蛋白;蛋白聚糖;糖脂
糖类成分根据分子大小可分为单糖、寡糖、多糖及复合糖,大分子糖链可单独存在,但在生物体主要以复合糖的形式存在,即糖蛋白、蛋白聚糖和糖脂。复合糖的糖链合成是由糖基的供体、受体和糖基转移酶三者相互协调完成,而其降解则靠糖苷水解酶,因此,糖基转移酶和糖苷水解酶的表达和活性在很大程度上调控着复合糖的状态。糖蛋白通常有N-糖基化、O-糖基化、C-甘露糖糖基化和磷脂酰肌醇锚蛋白4种类型。蛋白聚糖是以糖胺聚糖为主通过共价键与若干肽链连接的化合物。糖脂则是通过糖的还原末端以糖苷键与脂类连接起来的化合物,通常包括分子中含鞘氨醇或甘油酯的鞘糖脂、由磷酸多茚醇或类固醇衍生的糖脂4类。糖组(glycome)是一个生物体、一个器官、一种特定组织或某个细胞、细胞器在某一条件所具有的整套(全部)聚糖。高等动物的糖组可分为糖蛋白糖组、蛋白聚糖糖组和糖脂糖组。糖组学(glycomics)则是研究糖组结构与功能的科学,糖组学研究包括聚糖组(糖蛋白组、蛋白聚糖组和糖脂组)的分离与纯化、糖链组(糖蛋白糖链组、蛋白聚糖糖链组和糖脂糖链组)的分离、糖链的结构解析和定量及糖链性质和功能的研究。糖组学的研究离不开糖组研究技术的发展,关于糖组研究技术的综述报道已有多篇[1-6],但均是关于糖蛋白或其糖链分析的研究,关于蛋白聚糖和糖脂的研究方法甚少。本文不仅对糖蛋白、蛋白聚糖和糖脂的分离纯化及其糖链的分离、结构分析及定量等研究方法进行了综述,而且对糖组的生物信息学研究方法进行了综述,可为研究者全面了解糖组学研究方法提供参考。
1 聚糖组的分离与纯化
从生物样品中分离和纯化聚糖组,需要根据所需的目标糖蛋白、蛋白聚糖和糖脂特有的生物化学性质来进行。
1.1 糖蛋白组
糖蛋白组的分离首先是将总蛋白从生物样品如组织或血液等中分离出来,其次是将糖蛋白从提取分离的总蛋白中分离出来,用于后续的研究。糖蛋白兼有多糖和蛋白质的性质,大多可溶于水、稀酸或稀碱溶液,可根据需要用不同的溶剂进行提取分离。
可利用糖蛋白特有的性质将糖蛋白与非糖蛋白进行分离。如游离糖、单糖和寡糖可与凝集素特异结合,可使用亲和层析法分离[7],但其缺点在于只能针对具备特定结构的糖链。二维凝胶电泳结合荧光染色技术可将糖氧化成醛后易于荧光标记[8],进而进行分离;该检测方法比较直观,能针对大部分糖链,但糖链结构容易被破坏,不能进行糖链组成分析。因为蛋白质在氯仿等有机溶剂变性而不溶于水,糖则与色素结合后易被二乙氧乙基(DEAE)-纤维素吸附,所以可采用Sevage法、三氯乙酸法和三氟三氯乙烷法和脱色素法等将糖蛋白与非糖蛋白进行分离。
从糖蛋白中纯化特定类型的糖蛋白,需根据糖蛋白的性质采用不同的方法。如获取不含无机盐等小分子杂质的糖蛋白可用透析法;获取特定溶解度的糖蛋白可用乙醇、硫酸铵、丙酮进行分级分离的分步沉淀法;获取酸性和中性糖蛋白可用季胺盐沉淀法,如十六烷基三甲基溴化铵、十六烷基吡啶沉淀法等;获取特定分子直径的糖蛋白可用滤膜超滤法;获取特定分子质量和等电点的糖蛋白可用区域电泳法。
富集血清样品中混合的糖肽和非糖肽可用硼酸亲和法。硼酸配基几乎可与所有含顺式二醇结构的化合物发生亲和作用,而糖蛋白的糖链结构中几乎都含有顺式邻位羟基,因而硼酸亲和技术可有效富集含顺式二醇的糖蛋白。硼酸功能化的介孔硅胶材料对于富集血清样品中混合的糖肽和非糖肽具有良好的选择性,具有较高的收率[9]。
含唾液酸的糖蛋白和糖肽的分离富集可用二氧化钛法。二氧化钛是一种两性物质,可通过控制pH值达到富集目的。唾液酸化的糖蛋白和糖肽的羧基和羟基带有负电,为 Ti4+提供了结合配基,Palmisano等[10]从817个唾液酸化的糖蛋白中鉴定得到1632个唾液酸化糖肽。
体积排阻法用于糖蛋白的分离,其原理是基于含有糖链的糖蛋白相对分子质量稍大于非糖蛋白的特点。因此,该方法对糖链结构无偏向性,若只需获得糖蛋白则不需要衍生化及多次分离,操作简单,但缺点是并不能分离得到所有的糖蛋白,相对分子质量小于非糖蛋白的糖蛋白会被排出,同时相对分子质量较大的非糖蛋白则会留在分离得到的糖蛋白样品中。相对于此无特异性的分离方法,Klement等[11]将传统用于N-链接的糖蛋白分离的酰肼化学法予以改进,增加高碘酸钠的氧化时间并升高氧化温度,基于酰肼微球实现了对O-链接的糖蛋白的特异性分离富集。
1.2 蛋白聚糖组
蛋白聚糖是一类特殊的糖蛋白,除含有糖胺聚糖外,还有一些O-连接或N-连接的寡糖链。根据所含糖胺聚糖链的多少,存在于细胞外基质的蛋白聚糖可分为大分子型和小分子型。由于蛋白聚糖的分子结构及分子间相互作用复杂且呈多样性,故现在还没有一种分离方法能适用于所有的蛋白聚糖的分离。这也是蛋白聚糖组研究少有进展的原因之一。分离纯化蛋白聚糖方法与糖蛋白的纯化方法基本一致。但由于蛋白聚糖中糖胺聚糖含量多,亲水性强,及其分子具有微观不均一性,凝胶电泳对蛋白聚糖的分离不能达到理想的效果[12],故利用不同孔径的凝胶过滤层析来分离蛋白聚糖[13],如聚集蛋白聚糖(aggrecan)和基底膜蛋白聚糖(perlecan)可用聚丙烯酰胺葡聚糖S-500或S-1000、琼脂糖凝胶CL-2B来分离;核心蛋白聚糖(decorin)和双糖链蛋白聚糖(biglycan),部分降解的蛋白聚糖等可用Superose-6分离;此外,膜联蛋白(annexin)和半乳糖凝集素对糖胺聚糖有特异识别[14],可用凝集素亲和色谱对含膜联蛋白糖胺聚糖进行分离。
1.3 糖脂组
真核生物糖脂中,含鞘氨醇或甘油酯的鞘糖脂因与人类生命活动及生物、医药关系更为密切,是糖脂研究的主要类型。从生物样品(如组织和体液)中提取含鞘氨醇或甘油酯的鞘糖脂,可首先从生物样品中提取总脂肪,然后根据鞘糖脂既具有极性的羟基和羧基,又具有疏水性的脂肪链,既可聚集溶于水中,又能溶于氯仿-甲醇混合液中的性质,再从总脂肪中提取鞘糖脂,可采用大孔吸附树脂柱层析法[15]、柱层析色谱法、薄层层析印迹法、高效液相色谱和逆流色谱[16]等。从糖脂中纯化特定类型的鞘糖脂,可通过DEAE-Sephadex A-25、硅胶柱层析及薄层层析、基于支持液-液分离系统的逆流色谱、离心分配色谱和液滴逆流色谱等进行[16]。
2 糖链组的分离和富集
将糖链从糖蛋白、蛋白聚糖或糖脂(或鞘糖脂)上有效分离下来并进行高效富集,以及糖链结构的解析和定量是糖组学研究中阐明其生物学功能的重要基石。
2.1 糖链的分离
N-糖基化和O-糖基化是糖基化最常见的两种形式,也是糖组中研究的主要对象。对于N-糖链的分离,常用的方法有化学法和酶法。对O-糖链的分离常用化学法,由于O-糖链结构多样,目前仍然缺乏能够特异性地切割O-糖链的糖苷酶。内切α-N-乙酰半乳糖胺酶可识别O-糖链中乙酰半乳糖与半乳糖之间的连接[17]。化学法中肼解法和还原性β-消除法[18],常分别用于N-糖链和O-糖链的释放。在此基础上,本课题组建立了不同于传统的β-消除反应一锅法[19],用于O-糖链的释放。相对于传统的β-消除反应,一锅法在同一体系中同时对O-糖链进行非还原性解离和1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化标记,有效简化了实验过程。一锅法用氨水代替氢氧化钠溶液提供O-糖链解离的碱性环境,其优势在于氨水易挥发除去,PMP在温和碱性条件下可使解离下来的O-糖链的还原性末端衍生化带上发色基团,且糖链的完整性也得到了保护。此外,三氟乙酸[20]和三氟甲磺酸[21]也可水解糖蛋白上连接的糖链,但会对糖链造成不同程度的损伤,所以通常不用于糖链的解离。酶法是利用特异性的内切酶在复合糖的特异部位进行切割获得所需糖链。常用于N-糖链解离的酶有糖肽酶A、肽N-糖苷酶F(peptide-N-glycosidase F,PNGase F)[22]、内切β-N-乙酰葡萄糖胺酶H。用PNGase F切断糖链与天冬酰胺间的糖肽键释放N-糖链是最普遍的方法。该方法反应条件温和、效率高,能够在溶液中或直接在一维或二维电泳的凝胶中进行胶内酶切,但PNGase F对于与肽段直接相连的N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)上发生α-1-3岩藻糖基化的 N-糖链不起作用,需要用PNGase A进行酶切[22]。酶法也受一定的限制,因为并不是所有的糖链都有其对应的酶。
2.2 糖链的富集
为了制备可用于结构解析的糖链,要对目标糖链进行富集以增强其检测信号。各种糖链的富集方法各有利弊,要根据所分析目标物的特点进行选择,同时可将多种糖链富集方法联合使用,以达到最好的富集效果。
2.2.1 植物凝集素
一些游离糖、单糖和寡糖可与植物凝集素(lectin)特异结合,通过不同凝集素柱可直接富集得到目标糖链(表1),但缺点在于不是每一种糖蛋白都能找到与其对应的凝集素。Zielinska等[23]用刀豆凝集素,荆豆凝集素和 蓖麻凝集素3种凝集素对几种模式生物N-糖基化糖蛋白进行富集,鉴定了6种模式生物中上千个N-糖基化位点,发现真核生物的N-糖蛋白组都有不变的特征,包括序列识别模式、结构限制和亚细胞定位。
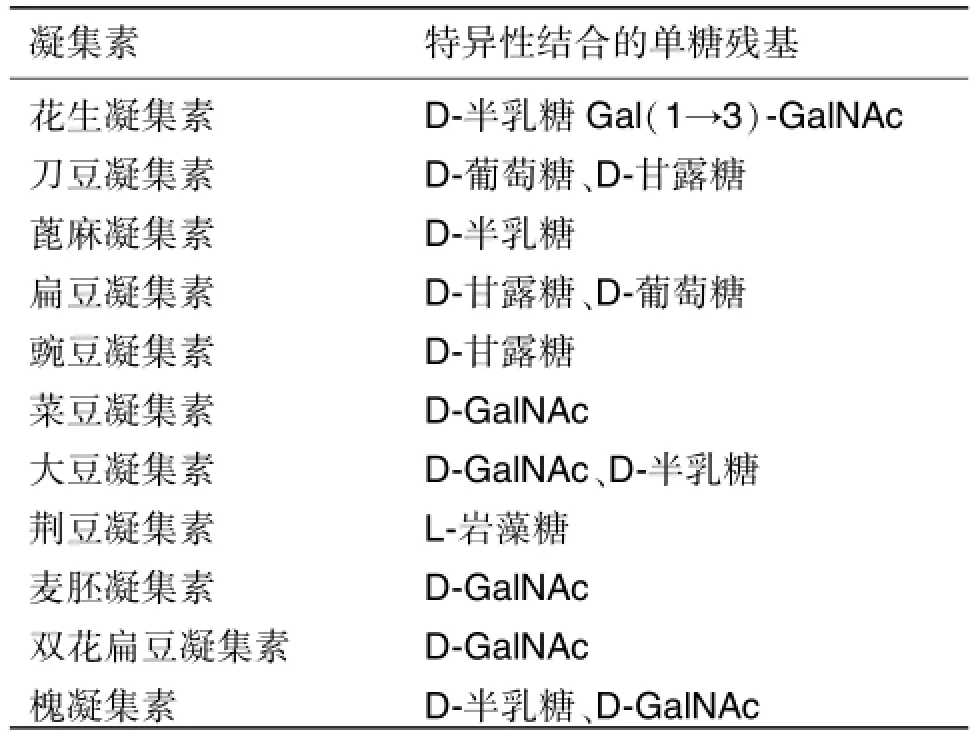
表1 能与单糖特异结合的凝集素
2.2.2 亲水色谱法
因糖链具有较强的亲水性,从而可利用这一特性对其进行富集。亲水色谱的固定相是具有强亲水性的极性吸附剂,流动相是水或有机溶剂[24]。将与待纯化样品有专一可逆结合的配基连接在水不溶性载体上,制成亲和吸附剂并装柱,使混合物通过亲和柱,纯化对象被吸附而其他物质随流动相流出,再用缓冲液将纯化的目标物质洗脱下来从而达到富集的目的。如 Hua等[25]用石墨炭柱和石墨烯、Karg等[26]采用纤维素和琼脂糖来有效富集糖链。
2.2.3 弱阴离子交换色谱
弱阴离子交换色谱基于糖链所带有的带电基团对其进行富集[27],如唾液酸或羧基所具有的阴离子。在进行富集时,糖链中单糖的数目会影响保留时间,在带电基团数目相同的情况下糖单位数目多的糖链保留时间短。为避免在检测混合样品时相似聚糖会共流出峰,Kalay等[28]使用弱阴离子交换-HPLC根据样品中唾液酸的含量,进行轻度去唾液酸而将其分开。
2.2.4 固相萃取技术
固相萃取是由色谱理论发展的一种固-液相萃取的物理过程。样品中目标成分通过溶剂流通被吸附在固相上,而其他杂质则随溶剂流出,再通过合适的洗脱剂将目标成分洗脱下来,获得所需目标成分。现常用石墨碳固相萃取小柱和C18小柱富集纯化糖链。C18小柱用键合硅胶C18做填料为反相吸附剂,石墨碳小柱填料即为活性炭,二者常用于分离糖链与蛋白质及除去盐等杂质。
3 糖链的结构解析和定量
对于糖组学的研究,获取某一特定类型糖链组中所含有的所有糖链结构和含量信息是其核心内容。因此,解析合适浓度和合适纯度糖链组中的糖链结构并对其进行定量分析的技术和方法至关重要。
3.1 结构解析
对于糖链结构的解析,生物质谱、核磁共振、色谱技术、凝集素芯片等技术是重要手段。
3.1.1 生物质谱
基于物理手段的主要有生物质谱技术和核磁共振技术[29]。用于糖组学的生物质谱目前主要有电喷雾电离质谱、基质辅助激光解吸电离时间飞行质谱[26,30]、傅立叶变换离子回旋共振质谱等。
为了提高质谱解析的灵敏度,通常需要对待测糖样品进行衍生化。全甲基化和还原氨化法是最常使用的衍生化方法。全甲基化常用碘甲烷等试剂,使糖链上高极性的OH-,NH-和COOH-变为非极性的OCH3-,NCH3-和COOCH3-,增加了质谱分析的灵敏性。此衍生还可使中性和酸性聚糖在基质辅助激光解吸电离时间飞行质谱正离子模式下同时被检测出。新近产生的将氢氧化钠填充在毛细管或纯化柱中的固相全甲基化,增加了其衍生化分析的再现性,此方法已成功用于定量分析不同癌症间相关的糖组的变化,如食管癌[31]和卵巢癌[32]。还原氨化法所用的衍生化试剂都带有一个活性伯氨基或肼基,可在酸催化的条件下与糖链还原端自由醛基缩合生成希夫碱,而希夫碱的双键被硼氢氰化钠(NaBH3CN)还原为稳定的单键。此类衍生化试剂常见的有2-氨基吡啶、氨基苯甲酰胺、对氨基苯甲酸乙酯、1-氨基吡-3,6,8-三磺酸、8-氨基萘-1,3,6-三磺酸和2-氨基苯甲酸等[33]。对糖链进行衍生化,增强其疏水性,不仅消除了中性和酸性糖之间不同的电离效率而且促进了质谱的分离效率。
另外,为了提高质谱解析的效率和准确性,通常在质谱解析前,采用分离技术与质谱联用将待测糖样品进行进一步预分离纯化。如毛细管电泳结合质谱技术可以用于细胞、组织内低丰度糖蛋白、蛋白聚糖中糖链的结构分析,其优势在于进样量少、灵敏度高,与串联质谱联用结合外切糖苷酶可获得每个聚糖的定位和结构。又如气相色谱-质谱联用就在糖类物质结构分析方面具有独特优势,将糖链全甲基化、乙酰化或三甲基硅醚化之后进行气相色谱-质谱联用分析可确定糖链内部单糖间的连接方式。
3.1.2 凝集素芯片技术
基于芯片的原理,发明了用于糖组研究的糖芯片,能以高通量的方式提供糖结构信息。其中,凝集素芯片是发展较快的芯片技术。通常是将各种植物凝集素以一定的空间距离固定在固体支持物上,再用荧光标记的样本与芯片上的凝集素反应,标记的样本通过自身糖链和固定的凝集素实现特异识别,然后通过芯片扫描仪分析荧光的强度来确定样品的糖结构。如吲哚类菁染料Cy3和Cy5,这类染料可以与赖氨酸结合,因此把糖蛋白的蛋白部分标记后并不影响其糖链部分与凝集素的亲和。简强等[34]对实验条件进行了优化,将刀豆凝集素和雪莲花凝集素固定于环氧化修饰的玻片表面,用Cy3标记标准糖蛋白核糖核酸酶B,利用凝集素识别特异糖链的原理建立凝集素芯片检测糖蛋白的方法,初步检测分析了正常肝细胞总蛋白中糖蛋白的糖链构成。
3.2 结构注解
随着糖组学研究的不断深入,国内外学者通过实验验证建立起了相当多的高可信度结构注释数据库。表2中列举了一些网络资源信息,如SWEET-DB,CFG和KEGG都是关于糖链结构的数据库。
为便于数据分析,学者们也开发了许多注解软件工具用于分析糖链结构。如Cartoonis是第一个基于质谱峰数据自动注解N-糖链的软件工具[35],GlycoPeakFinder是基于串联质谱数据的软件,GlycoPep DB是用于分析糖肽的软件,这些软件都可以快速完成对糖链质谱数据的自动化归属。Mechref等[36]研发了一种开放资源型软件MultiGlycan,是基于基质辅助激光解吸电离时间飞行质谱和液质联用的糖定量分析的软件工具。Vakhrushev等[37]开发了SysBioWare软件对原始聚糖质谱进行处理和注释。由Kronewitter等[38]开发的Glycolyzer软件,集成了一套工具能从原始质谱数据中识别聚糖峰信息,与SysBioWare相似。另外,还有 GlycosidIQ[35],Oscar[35],GLych[35],peptoonist[35]和Glyco-Workbench等软件可对糖链质谱数据进行处理及自动化归属其结构类型。表3列举了一些软件的应用范围。每种软件都有自己的适用范围和局限性,所以在使用这些软件前应充分了解其算法特点,并对其归属结果进行最终的人工筛选和确定。
目前,借助生物信息学构建的标准糖谱已成为样品糖链结构鉴定的主要工具,是糖组学分析技术中不可或缺的,它为糖链结构的测定和新糖链结构的发现提供了强大的技术支持。但由于缺乏一致的算法,各个数据库的相关数据不能实现共享,其强大功能的发挥还有赖于相关应用软件、数据库资源和计算机网络的建立、发展和完善。
3.3 定量研究
糖组学的研究除了要获得不同生物样品中糖的种类和结构信息外,非常重要的信息还包括同种或(和)不同种糖在不同生物样品中的含量高低,这在生物标志物和疾病诊断中极其重要。对于糖组的定量研究包括绝对定量和相对定量研究,通常与结构解析同步进行。
绝对定量需要获得≥1待测糖样品中某种糖或所有糖的绝对含量。绝对定量需要待测物的标准品,因生物体中糖链的组成复杂,标准品不易获得,故对糖链的绝对定量分析目前尚无较为成熟的方法。相对定量则不要求获得待测糖样品中某种糖的绝对含量,只需获得≥2个待测样品中某种糖或所有糖的含量的差值即相对含量。相对定量常用内标法,如同位素标记法和代谢标记法。
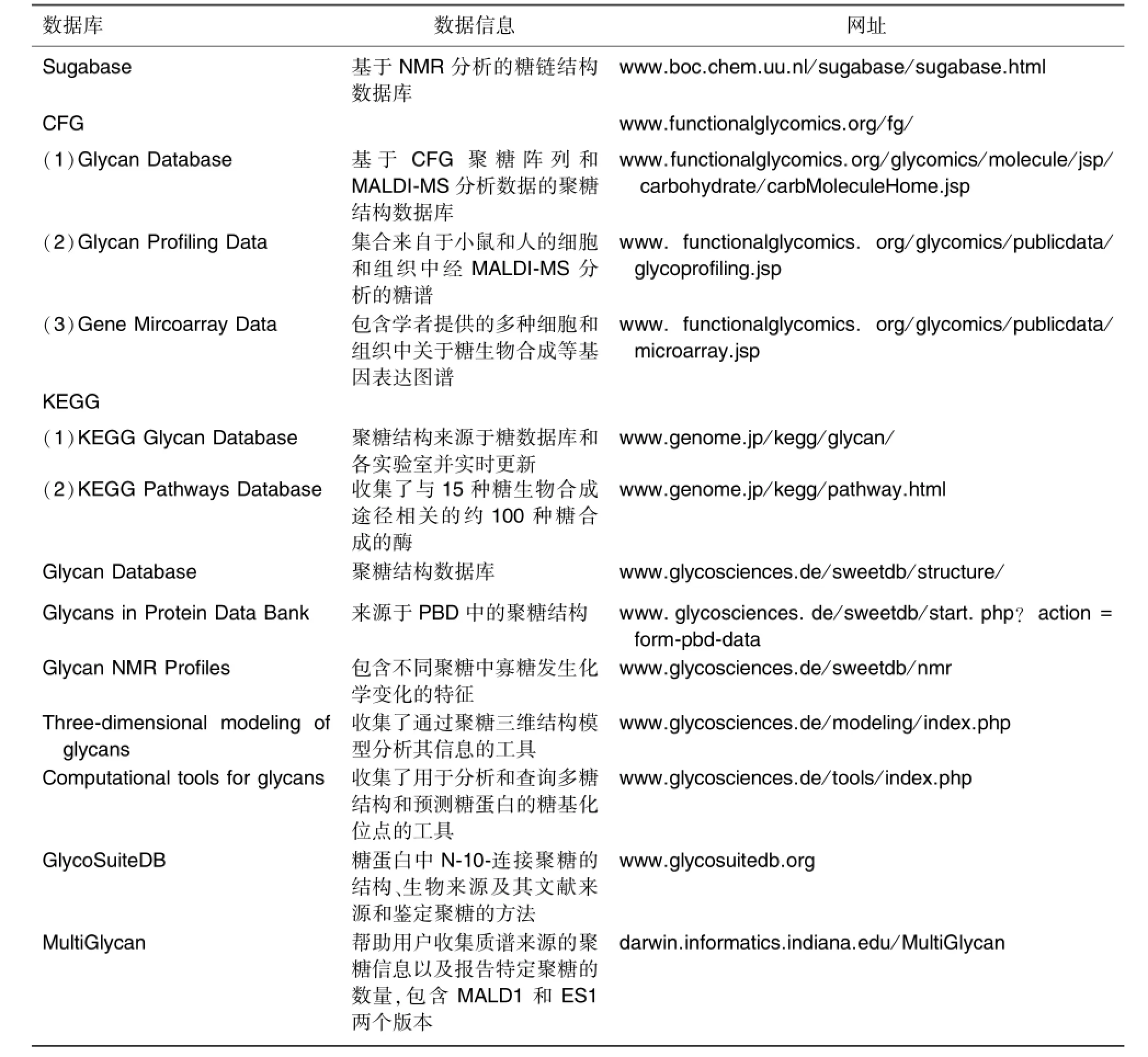
表2 用于糖链结构注解的数据库
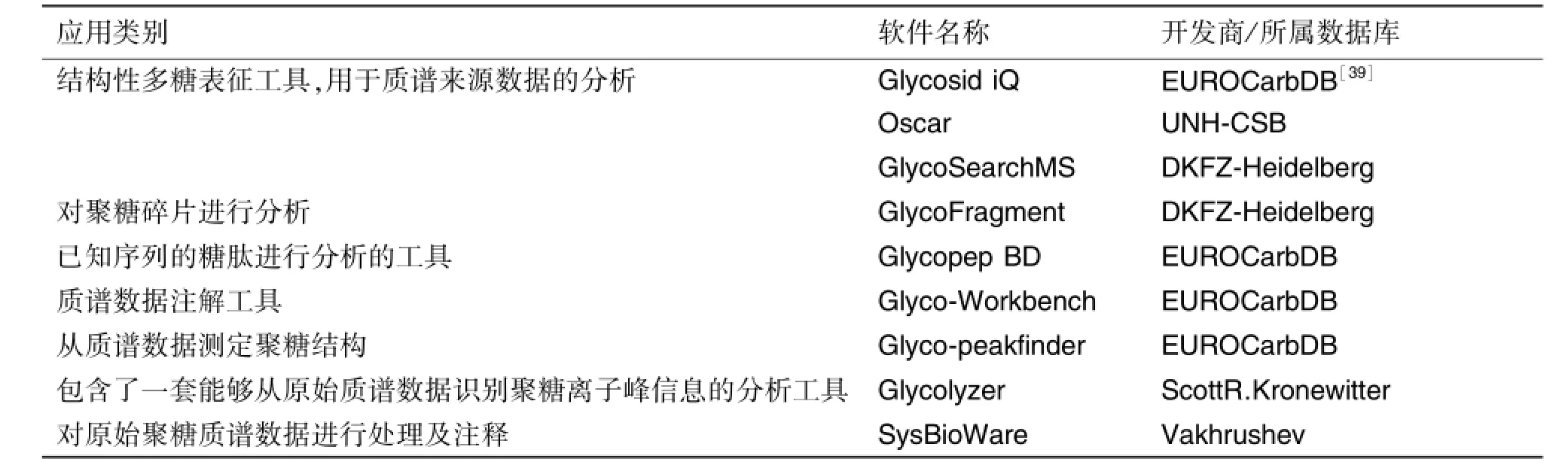
表3 用于糖链结构注解的软件
3.3.1 稳定同位素标记法
对糖链进行化学衍生后用稳定同位素标记,结合质谱对其进行相对定量分析。对不同样品糖链进行标记,再将其按比例混合进行质谱分析,相同的糖链因所带同位素质量不同而产生一对特征峰,对不同来源的同种糖链之间的丰度进行比对,从而达到相对定量。全甲基化或还原胺化衍生与同位素标记通过液质联用进行糖链的定量研究是目前应用较多的方法。全甲基化结合同位素标记的优点是便于多种质谱检测,但缺点在于其要求甲基化效率必须相同,但由于寡糖中存在许多羟基、羧基和氨基,要得到准确的定量就需使甲基化效率完全相同是比较困难的。Wells等[40]用[13C]H3I和[12C]H3I对不同时期黑腹果蝇的糖链进行相对定量研究,发现一些源于早期胚胎的聚糖随着生长有明显的减少。Zaia等[41]将还原氨试剂与不同数目的氘原子进行结合用4种不同的标签方式(+0,+4,+8,+12)进行标记,再通过质谱对4种样品中的硫酸软骨素蛋白多糖、肝素和源于酸性糖蛋白的N-糖链进行了相对定量,这是第一个用于对四链聚糖进行定量分析的试剂。但此方法在检测中也有一定缺陷,对样品进行标记后试剂会使质量位移产生4 U的差异,由于同位素分布差异较小会造成同位素分布区域的重叠,这样就会涉及到后续对正确的四链聚糖离子丰度的理论模拟提取。此外,氘的引入在检测中可能会导致色谱行为发生转变,引起离子化和质谱图方面产生差异。薛向东等[42]对母乳中游离寡糖和牛奶中游离寡糖分别进行d0/d5(不含“氯”的苯胺/含5个“氯”的苯胺)苯胺稳定同位素标记,发现母乳中的乳糖含量高于牛奶、母乳游离寡糖比牛奶游离寡糖种类复杂,且岩藻糖基化程度高。另外,12[C6]-苯胺和13[C6]-苯胺也已用于糖胺聚糖的相对定量[43]。
3.3.2 代谢标记法
己糖合成中谷氨酰胺侧链氨基上的氮是GlcNAc、N-乙酰 半乳糖糖胺 (N-acetylgalactosamine,GalNAc)和唾液酸生物合成中唯一的氮源,在培养基中加入重氮标记的酰胺-[15N]-Gln便可在代谢过程中将15N标记到细胞中所有的氨基糖上,则N-和O-连接的聚糖、糖脂以及在细胞外基质的蛋白聚糖中的每个氨基糖均增加1 U。通过对分别加入轻重两种谷氨酰胺培养基培养细胞的糖蛋白糖链质谱检测的同位素标记的对峰的信号强度进行比较即可进行定量,这种方法称为含谷氨酰胺氨基糖的同位素检测法。Orlando等[44]利用GlcNAc、GalNAc和唾液酸生物合成的基本路径,开发了上述检测方法,即将小鼠干细胞在含酰胺-[15N]-Gln的混合介质中培养72 h以使细胞中聚糖得以标记,通过MS和MS/MS检测对其N-和O-糖链进行了成功的定量分析。
4 糖链的性质和功能研究
糖组中结构清楚、含量准确、理化性质明确的某种糖或所有糖所具有的生物学功能一直是生命科学领域最为关注的问题,也是从基础走向应用的关键问题。为了能有效解决结构与功能间的关系,人们基于DNA芯片的原理建立了糖微阵列技术[45],即将大量的寡糖序列以点阵形式固定在固相基质表面构建微型生物化学分析系统,如共价连接单糖或二糖微阵列、非共价吸附多糖微阵列及寡糖微阵列等。可用于解决聚糖与其他生物分子间的相互作用及作用机制等问题,还可用于发现与聚糖相关的生物标记物。如Aranzamendi等[46]通过糖微阵列技术从上百种不同的糖抗原中筛选出能与感染旋毛虫病个体的抗体结合的抗原。
目前,在临床诊断方面,一些岩藻糖化和唾液酸化的糖链被人们广为关注。临床研究发现肝癌患者体内,岩藻糖苷酶活性异常,其与肝癌细胞中含岩藻糖的糖链结构的改变密不可分[47]。α1-抗胰蛋白酶和α-甲胎蛋白的核心岩藻糖基化的增加已经成为肝癌预测与诊断的指标之一。含岩藻糖-α(1-2)-半乳糖的聚糖在认知过程中具有不可忽视的作用[48]。前列腺特异性抗原在早期前列腺癌患者血清中的表达水平升高,但在良性前列腺增生中也存在该现象,α-1,6-岩藻糖转移酶在转移性前列腺癌组织中高表达[49]。因此,人们通过前列腺特异抗原糖基化结构的变化进一步区分良性和恶性前列腺疾病。唾液酸也会因疾病的发生和发展而改变,由唾液酸残基形成的糖链——多聚唾液酸附着在神经细胞黏附因子上,在细胞间黏附、细胞迁移、神经发育和重塑过程中发挥关键作用[50]。α-(2,3)/(2,6)连接的唾液酸在肝癌中占有很高比例,不同连接方式唾液酸的分布有望成为不同类型肝病诊断的重要标志之一[51]。另一方面,将特异存在的糖基化位点或糖链作为靶标开发抑制肿瘤转移的药物也具有一定的临床意义。
5 展望
糖组学的研究完全依赖于糖组学技术的发展,糖组学技术近年来已取得明显进展,有力地促进了糖组学的发展。但因糖链本身结构的复杂性,在技术上仍然面临许多问题需要解决,如糖链的结构分析和共价键的确定仍是低通量的工作,尚缺乏快速、大量测定细胞所有糖链结构的技术,在糖链的性质和功能研究尤其是功能研究方面进展缓慢。上述问题的解决尚需研究者艰苦卓绝的努力。
[1] Han HH,Zhang YJ,Qian XH.The application of microarray technique in glycomics[J].Chem Life (生命的化学),2008,28(6):763-766.
[2] Wang S,Li Y.Progress in glycomics[J].Chin J Cell Biol(中国细胞生物学报),2006,28:127-131.
[3] Sun XD, Li JM, Geng MY, Guan HS.Analysis techniques of glycoprotein glycan structure for the glycomics study[J].Prog Chem(化学进展),2007,19(1):130-135.
[4] Feizi T, Fazio F, Chai W,Wong CH.Carbohydrate microarrays-a new set of technologies at the frontiers of glycomics[J].Curr Opin Struc Biol,2003,13(5):637-645.
[5] Guo LN,Wang HR,Li XZ.Progress in strategy and technologies at the frontier for glycomics[J]. Chin J Biochem Mol Biol(中国生物化学与分子生物学报),2006,22(9):685-690.
[6] Yang J,Cai SX,Zou QM.Advances in analysis techniques of glycomics[J].Prog Biochem Biophys (生物化学与生物物理进展),2005,32(1):9-12.
[7] Lee LY, Hincapie M, Packer N, Baker MS,Hancock WS,Fanayan S.An optimized approach for enrichment of glycoproteins from cell culture lysates using native multi-lectin affinity chromatography[J].J Sep Sci,2012,35(18):2445-2452.
[8] Zhang Y,Huang LJ,Wang ZF.Techniques for staining glycoprotein on gelelectrophoresis or electroblotting[J].Prog Chem(化学进展),2008,20(7/8):1158-1164.
[9] Liu L,Zhang Y,Zhang L,Yan G,Yao J,Yang P,et al.Highly specific revelation of rat serum glycopeptidome by boronic acid-functionalized mesoporous silica[J].Anal Chim Acta,2012,753:64-72.
[10] Palmisano G, Lendal SE, Engholm-Keller K,Leth-Larsen R,Parker BL,Larsen MR.Selective enrichment of sialic acid-containing glycopeptides using titanium dioxide chromatography with analysis by HILIC and mass spectrometry[J].Nat Protoc,2010,5(12):1974-1982.
[11] Klement E,Lipinszki Z,Kupihár Z,Udvardy A,Medzihradszky KF.Enrichment of O-GlcNAc modified proteins by the periodate oxidation-hydrazide resin capture approach[J].J Proteome Res, 2010,9(5):2200-2206.
[12] Laremore TN,Ly M,Solakyildirim K,Zagorevski DV,Linhardt RJ.High-resolution preparative separation of glycosaminoglycan oligosaccharides by polyacrylamide gelelectrophoresis[J].Anal Biochem,2010,401(2):236-241.
[13] Yanagishita M,Podyma-Inoue KA,Yokoyama M. Extraction and separation of proteoglycans[J]. Glycoconj J,2009,26(8):953-959.
[14] Horlacher T,Noti C,de Paz JL,Bindschädler P,Hecht ML,Smith DF,et al.Characterization of annexin A1 glycan binding reveals binding to highly sulfated glycans with preference for highly sulfated heparan sulfate and heparin[J].Biochemistry,2011,50(13):2650-2659.
[15] Cao DX,Yang SW,Liu JJ,Wang YW,Liu AJ. Isolation and antitumor activities of glycolipids from carp head[J].Food Sci(食品科学),2009,30 (13):245-249.
[16] Hubert J,Plé K,Hamzaoui M,Nuissier G,Hadef I,Reynaud R,et al.New perspectives for microbial glycolipid fractionation and purification processes [J].Comptes Rendus Chimie,2012,15(1):18-28.
[17] Umemoto J, Bhavanandan VP, Davidson EA. Purification and properties of an endo-alpha-N-acetyl-D-galactosaminidase from Diplococcus pneumoniae [J].J Biol Chem,1977,252(23):8609-8614.
[18] Kozak RP,Royle L,Gardner RA,Fernandes DL,Wuhrer M.Suppression of peeling during the release of O-glycans by hydrazinolysis[J].Anal Biochem,2012,423(1):119-128.
[19] Wang C,Fan W,Zhang P,Wang Z,Huang L. One-pot nonreductive O-glycan release and labeling with 1-phenyl-3-methyl-5-pyrazolone followed by ESI-MS analysis[J].Proteomics,2011,11 (21):4229-4242.
[20] Hansen R,Dickson AJ,Goodacre R,Stephens GM,Sellick CA.Rapid characterization of N-linked glycans from secreted and gel-purified monoclonal antibodies using MALDI-ToF mass spectrometry [J].Biotechnol Bioeng,2010,107(5):902-908.
[21] Lebeer S, Claes IJ, Balog CI, Schoofs G,Verhoeven TL,Nys K,et al.The major secreted protein Msp1/p75 is O-glycosylated in Lactobacillus rhamnosus GG[J].Microb Cell Fact,2012,11:15.
[22] Triguero A,Cabrera G,Royle L,Harvey DJ,Rudd PM,Dwek RA,et al.Chemical and enzymatic N-glycan release comparison for N-glycan profiling of monoclonal antibodies expressed in plants[J]. Anal Biochem,2010,400(2):173-183.
[23] Zielinska DF,Gnad F,Schropp K,Wi'sniewski JR,Mann M.Mapping N-glycosylation sitesacross seven evolutionarily distant species reveals a divergent substrate proteome despite a common core machinery[J].Mol Cell,2012,46(4):542-548.
[24] Robbe-Masselot C,Herrmann A,Maes E,Carlstedt I,Michalski JC,Capon C.Expression of a core 3 disialyl-Le(x)hexasaccharide in human colorectal cancers:a potential marker of malignant transformation in colon[J].J Proteome Res,2009,8 (2):702-711.
[25] Hua S,Lebrilla C,An HJ.Application of nano-LC-based glycomics towards biomarker discovery[J]. Bioanalysis,2011,3(22):2573-2585.
[26] Karg SR, Frey AD, Ferrara C, Streich DK,Umaña P,Kallio PT.A small-scale method for the preparation of plant N-linked glycans from soluble proteins for analysis by MALDI-TOF mass spectrometry[J].Plant Physiol Biochem,2009,47 (2):160-166.
[27] Gil GC,Iliff B,Cerny R,Velander WH,Van Cott KE.High throughput quantification of N-glycans using one-pot sialic acid modification and matrix assisted laser desorption ionization time-of-flight mass spectrometry[J].Anal Chem,2010,82 (15):6613-6620.
[28] Kalay H,Ambrosini M,Chiodo F,van Kooyk Y,García-Vallejo JJ.Enhanced glycan nanoprofiling by weak anion exchange preparative chromatography,mild acid desialylation,and nanoliquid chromatography-mass spectrometry with nanofluorescence detection[J].Electrophoresis,2013,34 (16):2350-2356.
[29] Miller MC,Klyosov A,Platt D,Mayo KH.Using pulse field gradient NMR diffusion measurements to define molecular size distributions in glycan preparations[J].Carbohydr Res,2009,344 (10):1205-1212.
[30] Franc V,Sebela M,Rehulka P,Konˇcitíková R,Lenobel R,Madzak C,et al.Analysis of N-glycosylation in maize cytokinin oxidase/dehydrogenase 1 using a manual microgradient chromatographic separation coupled offlineto MALDI-TOF/TOF mass spectrometry[J].J Proteomics,2012,75 (13):4027-4037.
[31] Mechref Y,Hussein A,Bekesova S,Pungpapong V,Zhang M,Dobrolecki LE,et al.Quantitative serum glycomics of esophageal adenocarcinoma and other esophageal disease onsets[J].J Proteome Res,2009,8(6):2656-2666.
[32] Alley WR Jr,Vasseur JA,Goetz JA,Svoboda M,Mann BF,Matei DE,et al.N-linked glycan structures and their expressions change in the blood sera of ovarian cancer patients[J].J Proteome Res,2012,11(4):2282-2300.
[33] Ruhaak LR, Zauner G, Huhn C, Bruggink C,Deelder AM,Wuhrer M.Glycan labeling strategies and their use in identification and quantification[J]. Anal Bioanal Chem,2010,397(8):3457-3481.
[34] Jian Q,Yu HJ,Chen C,Li Z.Establishment of a lectin microarray method for the rapid analysis of glycoprotein and its application[J].Prog Biochem Biophys(生物化学与生物物理进展),2009,36 (2):254-259.
[35] Li F,Glinskii OV,Glinsky VV.Glycobioinformatics: current strategies and tools for data mining in MS-based glycoproteomics[J].Proteomics,2013,13 (2):341-354.
[36] Mechref Y,Hu Y,Desantos-Garcia JL,Hussein A,Tang H.Quantitative glycomics strategies[J]. Mol Cell Proteomics,2013,12(4):874-884.
[37] Vakhrushev SY, Dadimov D, Peter-Katalini'c J. Software platform for high-throughput glycomics [J].Anal Chem,2009,81(9):3252-3260.
[38] Kronewitter SR,De Leoz ML,Strum JS,An HJ,Dimapasoc LM,Guerrero A,et al.The glycolyzer: automated glycan annotation software for high performance mass spectrometry and its application to ovarian cancer glycan biomarker discovery[J]. Proteomics,2012,12(15-16):2523-2538.
[39] Hayes CA,Karlsson NG,Struwe WB,Lisacek F,Rudd PM,Packer NH,et al.UniCarb-DB:a database resource for glycomic discovery[J].Bioinformatics,2011,27(9):1343-1344.
[40] Aoki K,Perlman M,Lim JM,Cantu R,Wells L,Tiemeyer M.Dynamic developmental elaboration of N-linked glycan complexity in the Drosophila melanogaster embryo[J].J Biol Chem,2007,282(12):9127-9142.
[41] Bowman MJ,Zaia J.Comparative glycomics using a tetraplex stable-isotope coded tag[J].Anal Chem,2010,82(7):3023-3031.
[42] Xue XD,Zhang P,Wang ZF,Huang LJ.Analysis method for relative quantitation and qualitation of reductive glycans v/a aniline stable lsotopic labeling and ESI-MS[J].Chen J Chin Univ(高等学校化学学报),2010,31(11):2173-2180.
[43] Lawrence R,Olson SK,Steele RE,Wang L,Warrior R,Cummings RD,et al.Evolutionary differences in glycosaminoglycan fine structure detected by quanti-tative glycan reductive isotope labeling[J].J Biol Chem,2008,283(48):33674-33684.
[44] Orlando R,Lim JM,Atwood JA 3rd,Angel PM,Fang M,Aoki K,et al.IDAWG:metabolic incorporation of stable isotope labels for quantitative glycomics of cultured cells[J].J Proteome Res,2009,8(8):3816-3823.
[45] Oyelaran O, Gildersleeve JC.Glycan arrays: recent advances and future challenges[J].Curr Opin Chem Biol,2009,13(4):406-413.
[46] Aranzamendi C,Tefsen B,Jansen M,Chiumiento L,Bruschi F,Kortbeek T,et al.Glycan microarray profiling of parasite infection sera identifies the LDNF glycan as a potential antigen for serodiagnosis of trichinellosis[J].Exp Parasitol,2011,129 (3):221-226.
[47] Ji J,Gu X,Fang M,Zhao Y,Yi C,Wang A,et al. Expression of alpha 1,6-fucosyltransferase 8 in hepatitis B virus-related hepatocellular carcinoma influences tumour progression[J].Dig Liver Dis, 2013,45(5):414-421.
[48] Wibowo A,Peters EC,Hsieh-Wilson LC.Photoactivatable glycopolymers forthe proteome-wide identification of fucose-α(1-2)-galactose binding proteins[J].J Am Chem Soc,2014,136(27): 9528-9531.
[49] Wang X,Chen J,Li QK,Peskoe SB,Zhang B,Choi C,et al.Overexpression of α(1,6)fucosyltransferase associated with aggressive prostate cancer[J].Glycobiology,2014,24(10):935-944.
[50] Schnaar RL,Gerardy-Schahn R,Hildebrandt H. Sialic acids in the brain:gangliosides and polysialic acid in nervous system development,stability,disease,and regeneration[J].Physiol Rev,2014,94(2):461-518.
[51] Mondal G,Chatterjee U,Chawla YK,Chatterjee BP.Alterations of glycan branching and differential expression ofsialic acid on alpha fetoprotein among hepatitis patients[J].Glycoconj J,2011,28(1):1-9.
Progress in technoIogy for gIycomics
ZENG Ju1,2,3,CHENG Xiao-rui2,3,ZHOU Wen-xia2,3,ZHANG Yong-xiang2,3,WANG Zhong-fu1,HUANG Lin-juan1
(1.Ministry of Education Key Laboratory of Resource Biology and Biotechnology in Western China,College of Life Sciences,Northwest University,Xi′an 710069;2.Beijing Institute of Pharmacology and Toxicology,Beijing 100850,China;3.State Key Laboratory of Toxicology and Medical Countermeasures,Beijing100850,China)
Technologies for glycomics usually involve methods for separation and purification of polysaccharides,and separation,structure resolution,quantification,property investigation and function comment of glycan chains.Because of the different biochemical properties of glycoproteins,proteoglycans and glycolipids,the separation and purification of polysaccharides involve corresponding fractional precipitation,boric acid affinity,titanium dioxide,affinity chromatography,size exclusion method,and gel filtration chromatography column chromatography methods.The lectins,water affinity chromatography,solid phase extraction and other technologies could be applied to the oil enrichment of high pure and specific glycan chains.The structure of glycan chains can be analyzed using lectin microarray technology,mass spectrometry,and derivatization markers of glycan chains.Isotope labelling and metabolic labeling can be used to quantify glycan chains.The glycan biological function can be better understood using glycan chain structure analysis software and database of glycan chains by bioinformatics.
glycome;glycomics;glycoprotein;proteoglycan;glycolipid
ZHOU Wen-xia,Tel:(010)66931625,E-mail:zhouwx@bmi.ac.cn,HUANG Lin-juan,E-mail:Huanglj@nwu.edu.cn
R965
:A
:1000-3002(2014)06-0923-09
10.3867/j.issn.1000-3002.2014.06.016
Foundation item:The project supported by Major Science Foundation of China(2012ZX09301003-002-001);and Major Science Foundation of China(2013ZX09508104)
2014-05-26 接受日期:2014-10-23)
(本文编辑:齐春会)
国家科技重大专项(2012ZX09301003-002-001);国家科技重大专项(2013ZX09508104)
曾 菊(1989-),女,硕士研究生,主要从事中药药理学研究;周文霞(1968-),女,研究员,博士生导师,主要从事中药和神经免疫药理学研究;黄琳娟(1969-),女,教授,博士生导师,主要从事糖生物学与糖工程研究。
周文霞,Tel:(010)66931625,E-mail: zhouwx@bmi.ac.cn;黄琳娟,E-mail:Huanglj@nwu.edu.cn
