乙肝病毒HBx-d382与HBx-d431突变体特异性抗体检测方法的建立及临床应用
2014-03-22祝玲玲朱平安蔡兰兰施培瑶
祝玲玲 ,朱平安 ,蔡兰兰 ,金 娴 ,施培瑶 ,吴 翔
(1.深圳市第七人民医院检验科,广东深圳518081;2.中南大学湘雅医学院病原生物系)
原发性肝细胞癌在东南亚和中国是最常见的恶性肿瘤之一。已有研究表明,长期慢性HBV感染以及HBV X基因突变与原发性肝细胞癌(hepatocellular carcinoma,HCC)发生发展密切相关。以往研究发现,肝癌组织中存在HBx-d382、HBx-d431缺失型突变体,这些缺失型突变体构建的真核表达载体转入QSG7701肝细胞后,能加速QSG7701肝细胞恶性转化,有明显的致瘤作用[1-2]。由于早期诊断、早期治疗是提高原发性肝细胞癌生存率的关键,为了早期诊断肝细胞癌,本研究在前期研究的基础上,建立了检测HBx-d382和HBx-d431突变体特异性抗体的ELISA方法,并对正常人、慢性乙肝病毒感染者和肝细胞癌病人血清进行检测,现将结果报告如下。
1 材料与方法
1.1 实验材料
1.1.1 HBx-d382和HBx-d431特异性多肽抗原的制备 采用生物信息学方法,对乙肝病毒突变体HBx-d382、HBx-d431和乙肝病毒参考序列(AF282917)X基因氨基酸序列进行分析,筛选出HBx蛋白共同抗原肽(HBxP)、HBx-d382特异性多肽(HBxP-d382)和HBx-d431特异性多肽(HBxP-d431),其氨基酸序列分别为 ARDVLCLRPVGA、CIHQHHANWSVTFS、MIFVLGGCRHKLVCIF。 采用多肽合成法制备多肽抗原。抗原肽由上海生工生物工程技术服务有限公司合成。
1.1.2 试剂 辣根过氧化物酶(HRP)标记的SPA购自北京鼎国生物技术发展中心,为美国Southern-Biotech公司产品;包被缓冲液0.05 mol/L、pH值9.6的碳酸盐缓冲液,稀释液为pH值7.2的磷酸盐缓冲液(PBS,含0.05%吐温-20和10%正常兔血清),PBS缓冲洗涤液 pH值7.4,底物显色溶液(TMB),2.5 mL/L H2SO4终止液等试剂均由上海荣盛生物技术有限公司提供。
1.1.3 标本 350例HBV感染者血清标本来自2005年5月~2012年12月深圳市第七人民医院、中南大学湘雅医院和邵阳市中心医院门诊和住院患者。其中慢性HBV感染者266例,男182例,女84例,年龄21~61岁;肝细胞癌患者84例,男55例,女29例,年龄25~65岁。上述患者均为乙肝病毒表面抗原阳性,诊断依据为2000年西安第10次病毒性肝炎及肝病学术会议修订的诊断分型标准。随机选择HBV血清学标志物阴性健康成人20名作为正常对照组,年龄23~62岁。
1.1.4 血清稀释度和酶结合物浓度的选择 采用方阵滴定法,确定血清稀释度和酶结合物最佳浓度。
1.2 抗HBx-d382和抗HBx-d431特异性抗体检测
采用间接法,将 HBx-d382和HBx-d431特异性抗原肽稀释后包被聚丙乙烯反应板。37°C水浴1 h,4°C冰箱过夜,PBS缓冲洗涤液洗板5次并扣干。 每孔加入100 μL封闭液,37°C水浴1 h,4°C冰箱过夜,PBS缓冲洗涤液洗板5次并扣干。在上样孔中加入稀释的血清,37℃水浴1 h,PBS缓冲洗涤液洗板5次并扣干。加入HRP标记的SPA;水浴1 h,PBS洗板5次并扣干,加入底物液(底物A为H2O2,底物 B为 3,3′,5,5′四甲基联苯胺)显色10 min,加入终止液5 min后,1 h内用酶标仪450/630 nm波长检测各孔的吸光度A。结果判断:临界值CO=阴性对照孔A均值×2.1。测定A值/CO≥1为阳性,测定A值/CO<1为阴性。
1.3 统计学方法
使用SPSS17.00软件,采用χ2检验进行统计学分析。P<0.05为差异有显著性。
2 结 果
2.1 包被抗原的最佳浓度、血清标本与酶结合物最佳稀释度
通过生物信息和多肽合成的方法,筛选并合成出了HBx蛋白共同抗原肽、HBx-d382特异性多肽和HBx-d431特异性多肽,经方阵滴定法确定,HBxd382和HBx-d431特异性抗原肽最佳包被浓度为25 μg/mL,血清标本最佳稀释度为1∶10,酶结合物最佳稀释度为1∶6 000。
2.2 重复性
取一中强阳性的标本同一酶标板测定15孔,其批内变异系数为5.20%,用不同批酶标板对同一中强阳性的标本反复检测15次,其批间变异系为7.90%,试剂重复性好。
2.3 慢性 HBV感染者不同血清学模式抗HBx抗体检测
266例慢性HBV感染者不同血清学模式HBx抗体检测结果见表1,抗HBxP为HBx蛋白共同抗原肽抗体,抗HBx-d382为HBx-d382特异性多肽抗体,抗HBx-d431为HBx-d431特异性多肽抗体。在3种HBsAg阳性常见血清学模式中,HBsAg(+)/HBcAb(+)模式抗HBx-d382阳性率最高,阳性率为68.75%,其次为HBsAg(+)/HBeAg(+)/HB-cAb(+)模式,阳性率为56.52%;这两组模式抗HBx-d382阳性率明显高于和HBsAg(+)/HBeAb(+)/HBcAb(+)模式(χ2值分别为13.85,20.68;P<0.05)。而抗HBxP和抗HBx-d431阳性率在这些血清学模式之间差异无显著性(P>0.05)。
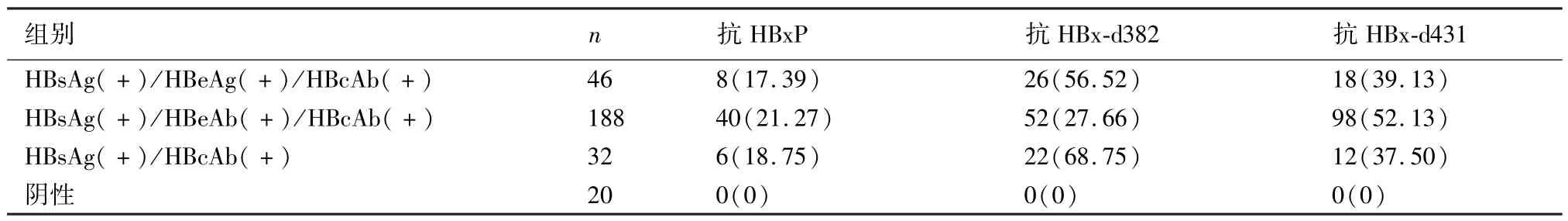
表1 慢性HBV感染者不同血清学模式HBx抗体检测结果(例,%)
2.4 肝细胞癌病人血清中抗HBx抗体的检测
从表2可见,肝癌组、HBV组与正常对照组比较,抗HBxP、抗HBx-d382、抗HBx-d431抗体阳性率明显高于正常对照组(χ2值分别为43.26,69.23,80.01;P<0.05)。肝癌组与HBV组比较,肝细胞癌病人抗HBxP、抗HBx-d382、抗HBx-d431抗体阳性率明显增高(χ2值分别为103.42,78.01,63.12;P<0.05)。
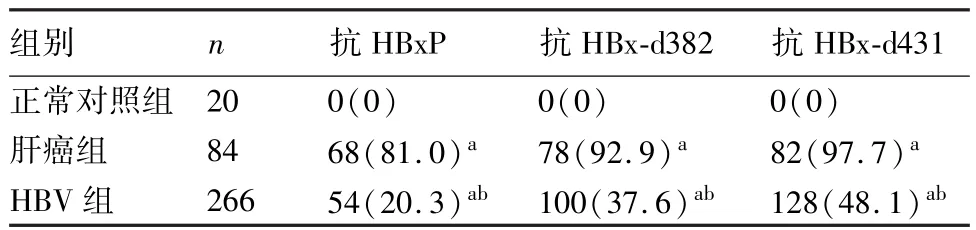
表2 肝细胞癌病人与HBV感染者血清中HBx抗体检测结果(例,%)
3 讨 论
原发性肝细胞癌是世界上最常见的恶性肿瘤之一,每年大约引起40万人死亡。大量流行病学调查表明,长期慢性乙肝病毒感染是导致HCC的主要病因,且HBV感染者发生肝细胞癌的概率大约是非感染者的100~400倍[3]。感染的HBV DNA可整合至肝细胞上,整合的位点恰好位于HBx基因区,且整合的HBx基因经常断裂不全。断裂的HBx基因连接在细胞DNA上,转录成融合的蛋白。已有研究表明,HBx基因及其编码蛋白与肝细胞癌发生发展密切相关[4]。肝癌组织中HBx基因缺失型突变体,表达截短的HBx蛋白导致HBx功能发生变化,参与肝细胞的恶性转化[2,5-6],促进肝癌细胞的增殖[7]。我们在前期研究中发现,肝癌组织中存在 HBxd382、HBx-d431缺失型突变体,这些缺失型突变体能加速QSG7701肝细胞恶性转化[2],促进LO2肝细胞的增殖和细胞周期素D1的表达[8-9]。为了进一步研究HBx-d382、HBx-d431缺失型突变体在早期诊断肝细胞癌上的意义,本研究制备了HBx-d382、HBx-d431缺失型突变体特异性多肽,建立了检测HBx-d382、HBx-d431缺失型突变体特异性抗体的ELISA法,并对肝细胞癌病人、慢性HBV感染者和正常人血清进行检测。研究结果表明,不同血清学模式的慢性HBV感染者抗HBx-d382与抗HBxd431特异性抗体阳性率是不一样的。HBsAg(+)/HBcAb(+)模式抗HBx-d382阳性率(68.75%)和HBsAg(+)/HBeAg(+)/HBcAb(+)模式阳性率(56.52%)明显高于HBsAg(+)/HBeAb(+)/HB-cAb(+)模式阳性率(27.66%)(P<0.05);HBsAg(+)/HBeAb(+)/HBcAb(+)模式抗HBx-d431阳性率(52.13%)虽然高于HBsAg(+)/HBeAg(+)/HBcAb(+)模式(39.13%)和 HBsAg(+)/HBcAb(+)模式(37.50%),但其与抗HBxP一样,各血清学模式之间阳性率无显著性差异(P>0.05)。这提示抗HBx-d382与抗HBx-d431 特异性抗体阳性率与HBV感染的进程、HBV血清学模式转变有关。同时本研究还发现,肝细胞癌病人血清中抗HBx-d382与抗HBx-d431特异性抗体阳性率明显高于慢性HBV感染者(P<0.05),提示抗HBx-d382与抗HBx-d431特异性抗体的出现可能与HCC发生发展密切相关。
由此可见,检测慢性HBV感染者和肝细胞癌病人血清中抗HBx-d382与抗HBx-d431特异性抗体,对于了解HBV感染的进程、HBV血清学模式转变、肝细胞癌发生发展有非常重要的意义,可以用于HBV携带者及慢性乙肝病人的监测。
[1]Zhu PA,Tan DM,Peng ZT,et al.Polymorphism Analyses of Hepatitis B Virus X Gene in Hepatocellular Carcinoma Patients from Southern[J].Acta Biochimicaet Biophysica Sinica,2007,39(4):265-272.
[2]朱平安,谭德明,彭忠田,等.肝癌组织中HBx基因的多态性及突变体对QSG7701细胞生物学行为的影响[J].中华肝脏病杂志,2008,16(1):7-11.
[3]Chemin I,Zoulim F.Hepatitis B virus induced hepatocellular carcinoma[J].Cancer Lett,2009,286(1):52-59.
[4]Moradpour D,Blum HE.Pathogenesis of hepatocellular carcinoma[J].Eur J Gastroenterol Hepatol,2005,17(5):477-483.
[5]Iavarone M,Trabut JB,Delpuech O,et al.Characterisation of hepatitis B virus X protein mutants in tumour and nontumour liver cells using laser capture microdissection[J].J Hepatol,2003,39(2):253-261.
[6]Tu H,Bonura C,Giannini C,et al.Biological impact of natural COOH-terminal deletions of hepatitis B virus X protein in hepatocellular carcinoma tissues[J].Cancer Res,2001,61(21):7803-7810.
[7]刘晓红,朱明华,曹晓哲,等.HBx蛋白羧基端缺失对肝癌细胞生物学行为的影响[J].癌症,2005,24(10):1213-1219.
[8]Zhang H,Shan CL,Li N,et al.Identification of a natural mutant of HBV X protein truncated 27 amino acids at the COOH terminal and its effect on liver cell proliferation[J].Acta Pharmacol Sin,2008,29(4):473-480.
[9]Fu XY,Tan DM,Hou ZH,et al.The effect of miR-338-3p on HBx deletion-mutant(HBxd382)mediated liver-cell proliferation through cyclinD1 regulation[J].PLoS One,2012,7(8):e43204.
