LCM技术筛选胃癌相关蛋白质
2014-03-22
(南华大学肿瘤研究所,湖南衡阳421001)
胃癌(Gastric carcinoma,GC)是消化道恶性肿瘤之一,其发病率居所有恶性肿瘤的第三位,居消化道肿瘤的第一位[1-2]。胃癌起病隐匿、早期症状不明显、具有侵袭转移早的特性,且目前早期诊断技术尚缺乏,治疗效果难尽人意,五年生存率低,不足15%[3-5]。采用蛋白质组学技术,分析肿瘤发生发展过程中蛋白质表达水平及修饰信息,识别与肿瘤相关的特异蛋白质,对发现肿瘤标志物以及揭示肿瘤发病分子机制均具有十分重要意义。
本研究采用冰冻切片、苏木素-伊红染色、甲基绿染色、激光捕获显微切割(laser capture microdissection,LCM)技术,获取高纯度的胃癌组织与正常胃黏膜的腺体组织,提取LCM纯化后组织细胞总蛋白,测定总蛋白浓度。以期为胃癌蛋白质组学研究提供高纯度样品,为寻找胃癌早期诊断的特异蛋白质分子标志物提供重要实验依据。
1 材料与方法
1.1 材料
1.1.1 标本 20例手术切除的新鲜胃腺癌组织(经病理诊断均为低分化腺癌,根据国际抗癌联盟TNM分期为Ⅱ-Ⅳ期)和配对的正常胃黏膜上皮组织取自湖南省衡阳市南华大学附属第一医院肿瘤外科,病人为未经放疗与化疗的初诊病人,患者年龄38~77,平均57.5岁,其中男性12例,女性8例。标本均在胃离体后几分钟内获取,正常胃黏膜均选自距离肿瘤原发灶边缘>5 cm无水肿和糜烂坏死的胃黏膜组织,各所取新鲜标本均用PBS冲洗后,立即放入液氮中速冻,转-80°低温冰箱长期保存。
1.1.2 试剂 甲基绿组织染色剂:美国 Sigma-Aldrich公司,OCT组织包埋剂:德国Leica AS公司,蛋白酶抑制剂:美国Indianapolis公司,RIPA组织裂解液(强)、PMSF:碧云天公司产品,微量BCA蛋白定量试剂盒:美国Thermo scientific公司产品。
1.1.3 仪器 激光捕获显微切割仪为德国Leica AS公司生产,薄膜载片为德国Leica公司生产,C1900冰冻切片机为德国Leica AS公司生产,光学显微镜、倒置显微镜为日本 Olympus公司生产,DU800全自动紫外/可见光分析装置为eppendorf公司生产。
1.2 激光捕获显微切割纯化细胞
1.2.1 冰冻切片制备 将收集待切的胃腺癌组织或正常胃黏膜上皮组织标本从液氮中取出后,立即放入温度为-28℃的冰冻切片机内室,在组织块上滴数滴OCT组织包埋剂,直至将组织块全部包埋。冷却20 min,设置切片厚度为8 μm,每例标本前面一张或数张贴于普通载玻片行H-E染色,用光学显微镜观察,作为病理对照。找到目的细胞后,行8 μm连续冰冻切片,贴附于紫外线照射后的专用薄膜载片上,常温放置60 s,待包埋剂融化切片还未风干时,迅速将切片置入4℃预冷的75%的乙醇中固定。
1.2.2 苏木素-伊红(HE)组织切片染色 切片置于4℃预冷的75%的乙醇中,固定60 s;冰上4℃预冷超纯水中洗涤2次,每次大约5 s;苏木素染色液中染色10 min;1%盐酸酒精分化3 s;流水返蓝10 min;伊红染色液中染色10 s;梯度酒精脱水;二甲苯透明;树胶封片。
1.2.3 甲基绿组织切片染色 切片于4℃预冷的75%的乙醇固定1 min;冰上4℃预冷超纯水中洗涤2次,每次大约5 s;4℃预冷的1%甲基绿染色液(内含蛋白酶抑制剂)中快速染色20 s;冰上的预冷超纯水中洗涤2次,每次大约5 s;冰上4℃预冷的95%的乙醇中脱色1次,时间5 s;常温下风干3~5 min。
1.3 激光捕获显微切割
将已甲基绿染色的胃腺癌组织或正常胃黏膜上皮组织切片固定在显微镜的载物台上,收集管安置在切片的下方随激光移动。组织的形态结构在合适的放大倍数下同步显示在显示器上,用鼠标勾画选择的目的细胞的轮廓,激光沿着鼠标线自动切割,根据视野、放大倍数和目的细胞分布等调整激光孔径、速度及强度,切割目的细胞至收集管中。每片组织摆放的切割机的时间不易过长,在收集管盖内预先滴上2~3 μL的蛋白酶抑制剂,以免蛋白质被空气中的蛋白酶降解。每片组织片各使用一个收集管,并做好标记,超低温离心几秒后,-80℃冰箱保存。
1.3.1 LCM纯化的组织细胞总蛋白的制备 在收集的纯化组织细胞中,加入组织裂解液(7 mol/L urea,2 mol/L thiourea,4%CHAPS,2%NP40,100 mmol/L DTT,0.5 mmol/L EDTA,5 mmol/L PMSF,1%TritonX-100,40 mmol/L Tris,2%Phamarlyte)常温裂解1 h,14 000 g,4℃,离心45 min,取上清即为组织细胞总蛋白。
1.3.2 LCM纯化的组织细胞总蛋白浓度的测定蛋白浓度的测定采用的是美国Thermo Scientific公司的微量BCA蛋白测定试剂盒。Thermo Scientific微量BCA蛋白定量分析试剂的线性工作范围:0.5~20 μg/mL,操作步骤如下:(1)准备显色工作液:将 Micro BCA Reagent A(MA)、Micro BCA Reagent B(MB)、Micro BCA Reagent C(MC)按照 25∶24∶1的比例配成显色工作液(working color reagent);制备标准曲线:根据试剂盒说明书用浓度为2 mg/mL的BSA标准液准备标准曲线。(2)从稀释管和样品总蛋白中各吸取150 μL滴入96孔微板中;吸取150 μL显色工作液滴入以上每孔蛋白微孔中,在微量盘振荡器上震荡30 s混匀;盖上96孔板的盖子,密封后放入37℃恒温箱孵育2 h;从恒温箱取出后在室温下自然冷却;放入酶标仪中自动读出562 nm波长下的吸光值;每个孔吸光值均减去蛋白浓度为0 μg/mL的吸光值;绘制标准曲线,计算直线回归方程,算出待测样品的蛋白浓度。
2 结 果
2.1 正常胃黏膜上皮和胃腺癌组织快速冰冻切片和HE病理切片
在制作激光捕获显微切割切片之前先行快速冰冻切片HE染色,明确组织类型是否符合实验要求,防止浪费价格昂贵的薄膜载片。同时行普通HE病理切片确诊。两种组织的快速冰冻切片见图1,普通HE病理切片见图2。
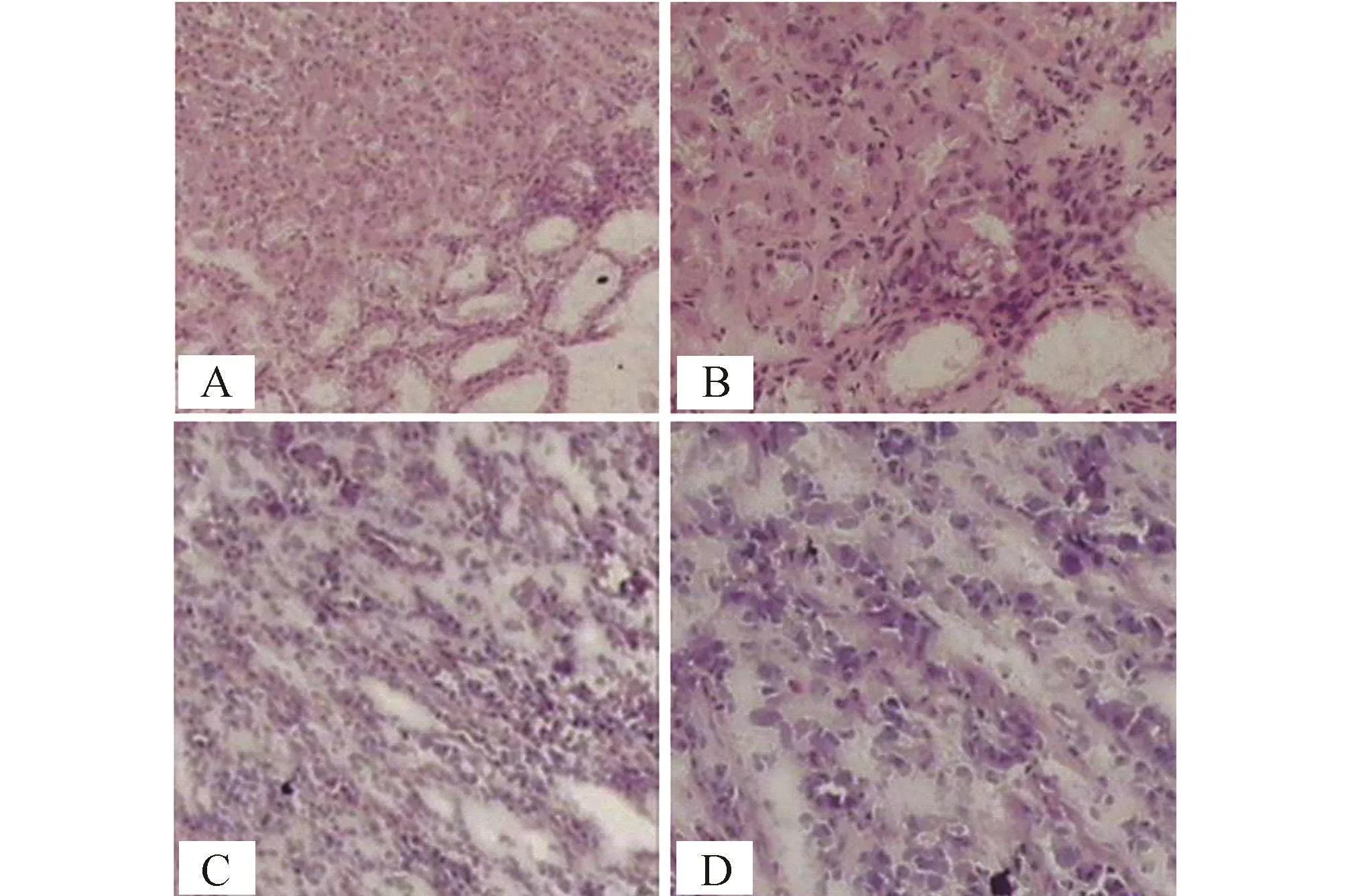
图1 正常胃黏膜上皮组织和胃腺癌组织的快速冰冻切片图(HE染色) A:正常胃黏膜上皮组织(×100);B:正常胃黏膜上皮组织(×200);C:胃腺癌组织(×100);D:胃腺癌组织(×200)
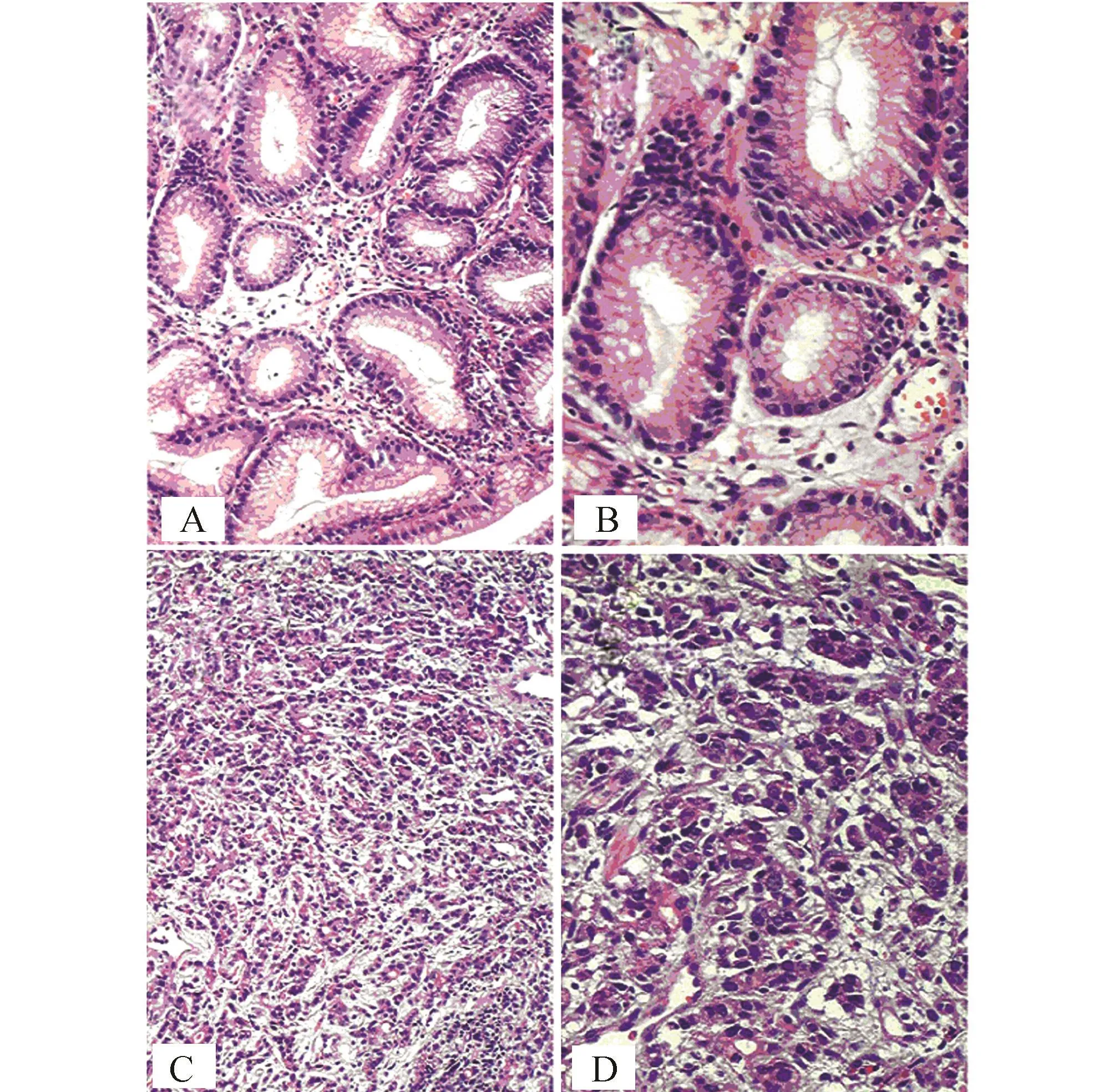
图2 正常胃黏膜上皮组织和胃腺癌组织普通病理切片(HE染色) A:正常胃黏膜上皮组织(×100);B:正常胃黏膜上皮组织(×200);C:胃腺癌组织(×100);D:胃腺癌组织(×200)
2.2 纯化胃腺癌细胞(GAC)和正常胃黏膜上皮细胞(NGEC)
采用LCM技术分别从经甲基绿染色正常胃黏膜上皮组织和胃腺癌组织中分离纯化GAC和NGEC。根据目的细胞在切片中的位置和大小用鼠标描出目的细胞群的轮廓,激光沿标记的轮廓线切割,获得目的细胞。
2.3 蛋白定量标准曲线与直线回归方程
经酶标仪中自动读出562 nm波长下的吸光值;每孔吸光值均减去蛋白浓度为0 μg/mL的吸光值;绘制出标准曲线,计算直线回归方程(图3),以此计算待测样品的蛋白浓度。
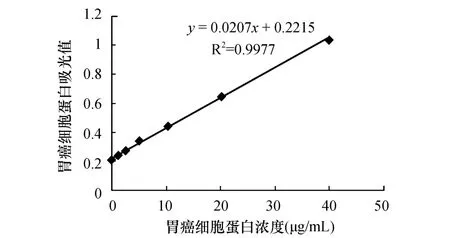
图3 标准曲线与直线回归方程
3 讨 论
胃癌是一种多基因多阶段侵袭性疾病,近年来采用比较基因组杂交(cGH)、微阵列(mieroarray)等新技术,从DNA或mRNA水平对胃癌进行了研究,由于基因功能的执行者是蛋白质,且蛋白质还存在修饰、定位、转运、构象变化等,因此,研究结果并不能完全真实反应出细胞内蛋白质的变化。在疾病发生发展过程中,基因作用的发挥通过其表达产物蛋白质实现[6-7]。直接从蛋白质入手来研究胃癌,印证胃癌相关基因的改变,将更全面、真实地揭示胃癌的本质改变[8-10]。
运用比较蛋白质组学进行肿瘤研究,高纯度组织的获取是关键难题,由于间质污染的存在,所提取的DNA、RNA或蛋白质均难以准确反应同一类细胞的信息。因此,研究疾病发展的相关分子机制,获取高纯度细胞是获得准确结果的前提条件[11]。
激光捕获显微切割技术,以其简单、快速、以及精确度高等多功能特点,成功解决了从复杂组织中获取单一细胞的难题[12]。通过电脑控制激光束的位置,沿着设定好的图形自动切割后,特定细胞或组织就被准确分离,收集于试管,切割过程自动完成。LCM技术的优点是切割自动化、快速、定位精确、捕获细胞形态保持完好、细胞损伤小、蛋白质保存完好。LCM技术已广泛应用于石蜡、冰冻切片、细胞培养片、细胞涂片等各种样本特定细胞的获取。LCM联合蛋白组学技术的应用,所得实验结果更接近真实。程爱兰等[12]应用LCM技术,分别从鼻咽癌和正常的鼻咽上皮组织中纯化出鼻咽癌细胞和正常鼻咽上皮细胞。Neubauer等[13]联合应用LCM与2DE技术,发现了区别(ER)+/(PR)+和ER+/PR-乳腺预后的相关蛋白质transgelin、cydophilinA及Neudesin,这些蛋白质的差异表达,并发现ER+/PR+乳腺癌预后好于ER+/PR-的乳腺癌。上述研究表明LCM联合蛋白质组学技术,可以为肿瘤标志物的筛选提供有效方法。
采用冰冻切片,LCM切割纯化目的细胞过程中染色剂的选择亦显重要。在蛋白质组学研究中,LCM技术常用的组织染液包括苏木素-伊红、甲苯胺蓝、甲基绿等[13],其中甲基绿染色剂易与DNA结合呈现绿色,是一种小分子碱性染料。已有研究证实甲基绿不会影响MALDI-TOF和Q-TOF结果[14-15]。因此在实验中使用甲基绿对胃癌组织冰冻切片进行染色,可以较好的分辨复杂组织中不同类型的细胞,减少对后续质谱的干扰。LCM冰冻切片制备与常规病理切片基本相同,因涉及到后期的核酸、蛋白质研究应注意避免污染。切片前,载物台、机箱内部均应使用75%乙醇擦拭,晾干,组织切片的厚度以8 μm左右为好,因为切片较厚,虽捕获所得细胞多,但易导致非目的细胞污染,切片太薄,虽捕获细胞纯净,但太费时。蛋白质的降解亦是LCM技术中的常见问题,由于进行切割时,切片必须暴露在常温下,如切割时间过长,则会导致蛋白质的降解,因此,切割操作室温度要尽可能的调低,在甲基绿染色剂中和收集管中加入蛋白酶抑制剂可减少蛋白质的降解。所以,事先周密的准备标本和掌握切割技巧是正确运用LCM技术的关键。筛选、纯化胃癌和对应正常胃黏膜上皮细胞之间的特异差异表达蛋白质,为胃癌蛋白质组学研究提供前提基础。寻找早期诊断及治疗的蛋白质分子标志物将有待下一步深入研究与探讨。
[1]Roder DM.The epidemiology of gastric cancer[J].Gastric Cancer,2002,5 Suppl 1:5-11.
[2]Alberts SR,Cervantes A,Van VC.Gastric cancer:epidemiology,pathology and treatment[J].Ann Onco1,2003,14 Suppl 2:31-36.
[3]Choi J,Kim SG,Im JP,et al.Comparison of endoscopic ultrasonography and conventional endoscopy for prediction of depth of tumor invasion in early gastric cancer[J].Endoscopy,2010,42(9):705-713.
[4]Mann M,Hendrickson RC,Pandey A.Analysis of proteins and proteomes by mass spectrometry[J].Annu Rev Biochem,2001,70:437-473.
[5]Maconi G,Manes G,Porro GB.Role of symptoms in diagnosis and outcome of gastric cancer[J].World J Gastroenterol,2008,4:1149-1155.
[6]牛丽婷,曹露.胃癌蛋白质组学的研究进展[J].实用肿瘤学杂志,2013,27(4):355-358.
[7]朱益民,徐其,董来荣,等.应用蛋白质组学技术筛选胃癌SGC-7901细胞中的let-7a功能相关蛋白[J].生物化学与生物物理进展,2011,38(5):441-448.
[8]任磊,周业江,刘春凤.Bcl-2/Bid在胃癌的差异性表达与临床意义[J].中国现代医学杂志,2013,23(20):51-54.
[9]Bi FF,Yang Q,Wang Y,et al.Expression and significance of pro-apoptotic protein Bid in endometrial carcinoma[J].Modern Oncology,2012,20(3):589-592.
[10]张志强,李茂玉,张桂英,等.激光捕获显微切割技术结合^18O标记定量蛋白质组技术在胃癌标志物筛查中的应用研究[J].生物化学与生物物理进展,2009,36(3):311-322.
[11]Murray GI.An overview of laser microdissection technologies[J].Acta Histochem,2007,109(3):171-176.
[12]程爱兰,黄卫国,张鹏飞,等,激光捕获显微切割技术纯化的鼻咽癌和正常鼻咽上皮细胞的比较蛋白质组学研究[J].生物化学与生物物理进展,2008,35(5):521~530.
[13]Neubauer H,Clare SE,Kurek R,et al.Breast cancer proteomics by laser capture microdissection,sample pooling,54-cm IPG IEF,and differential iodine radioisotope detection[J].Electrophoresis,2006,27(9):1840-1852.
[14]Cheng AL,Huang WG,Chen ZC,et al.Identification of novel nasopharyngeal carcinoma biomarkers by laser capture microdissection and proteomic analysis[J].Clin Cancer Res,2008,14(2):435-445.
[15]Jie Yin Yee,Lie Michael George Limenta,Keith Rogers,et al.Ensuring good quality rna for quantitative real-time pcr isolated from renal proximal tubular cells using laser capture microdissection[J].BMC Res Notes,2014,7(1):62-69.
