二苯基甲烷衍生物的合成
2014-03-10胡志明赵卫娟马佳颀莫卫民沈振陆
胡志明,赵卫娟,马佳颀,莫卫民,沈振陆
(1.浙江工业大学化学工程学院,浙江 杭州 310014;2.浙江省化工研究有限公司,浙江 杭州 310023)
许多细胞毒性化合物都含有二苯基甲烷类衍生物单元[1],这类化合物能够很好地联接秋水仙碱作用于微管蛋白,最终除去癌变细胞[2],所以该类物质能够用于抗癌药物的研制。有人曾经报道了使用过渡金属催化偶联反应形成C-C 键,如Pd,Cu,Fe,Zn 等[3-7],二苯基甲烷衍生物的合成一般通过苄基卤代物与芳基硼酸为原料,在过渡金属催化作用下通过Suzuki 反应制得[8]。本文以Pd(OAc)2作催化剂,三苯基膦为配体,在碱性条件下以较高收率合成了二苯基甲烷衍生物。
1 实验部分
1.1 仪器和试剂
本文用的试剂若无特别说明,均为市售CP或AR 级,不经特别处理,直接使用。美国Aglient公司GC7890 气相色谱仪;美国Thermo 公司Thermo Trace GC-MS 气相色谱-质谱联用仪;德国Bruker 公司Bruker DRX 500 核磁共振仪,瑞士BUCHI M-565 熔点仪。
1.2 合成路线
见图1。
1.3 实验步骤
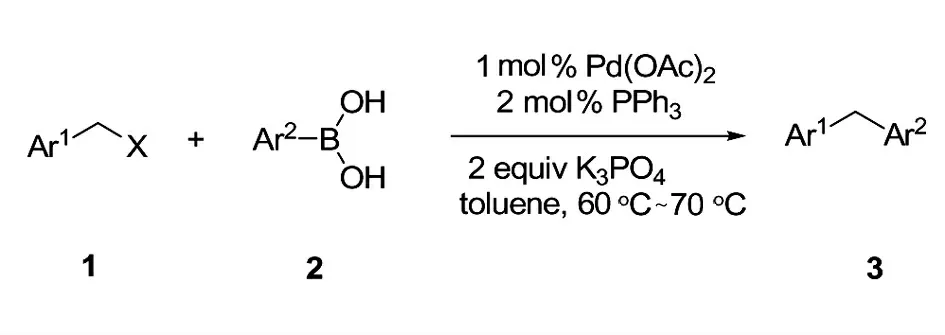
图1 合成路线
在150 mL 的四口烧瓶中分别加入30 mmol苄基卤化物,32 mmol 芳基硼酸化合物,0.6 mmol三苯基膦(2 mol%,0.16 g),16.0 g 三水磷酸钾(6 mmol,2 equiv)和60 mL 甲苯溶剂,用N2置换反应体系中的空气,随后加入0.3 mmol 醋酸钯(1 mol%,67.2 mg),氮气保护下加热升温至80 ℃反应,气相色谱监测反应进程。待原料完全反应后,停止反应,反应液经减压抽滤后,滤液经减压蒸馏除去溶剂,剩余液体经过硅胶柱层析,得到目标产物,由不同的苄基卤化物与芳基硼酸化合物底物反应共得到16 种不同的二苯基甲烷衍生物,具体结构及反应分离收率如表1 所示。经柱层析分离得到的二苯基甲烷衍生物经过质谱MS、1H-NMR、13C-NMR 进行结构确认。
2 结果与讨论
2.1 产物鉴定
3a:以对甲基氯苄和苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率94%,无色液体。1H NMR (CDCl3):δ 2.35 (s,3H),3.98 (s,2H),7.12 (d,J=1.7 Hz,4H),7.21~7.23 (m,3H),7.28~7.33 (m,2H);13C NMR (CDCl3):δ 141.5,138.1,135.6,129.2,129.0,128.9,128.5,126.1,41.6,21.1;MS (EI):m/z182.1 (M+)。
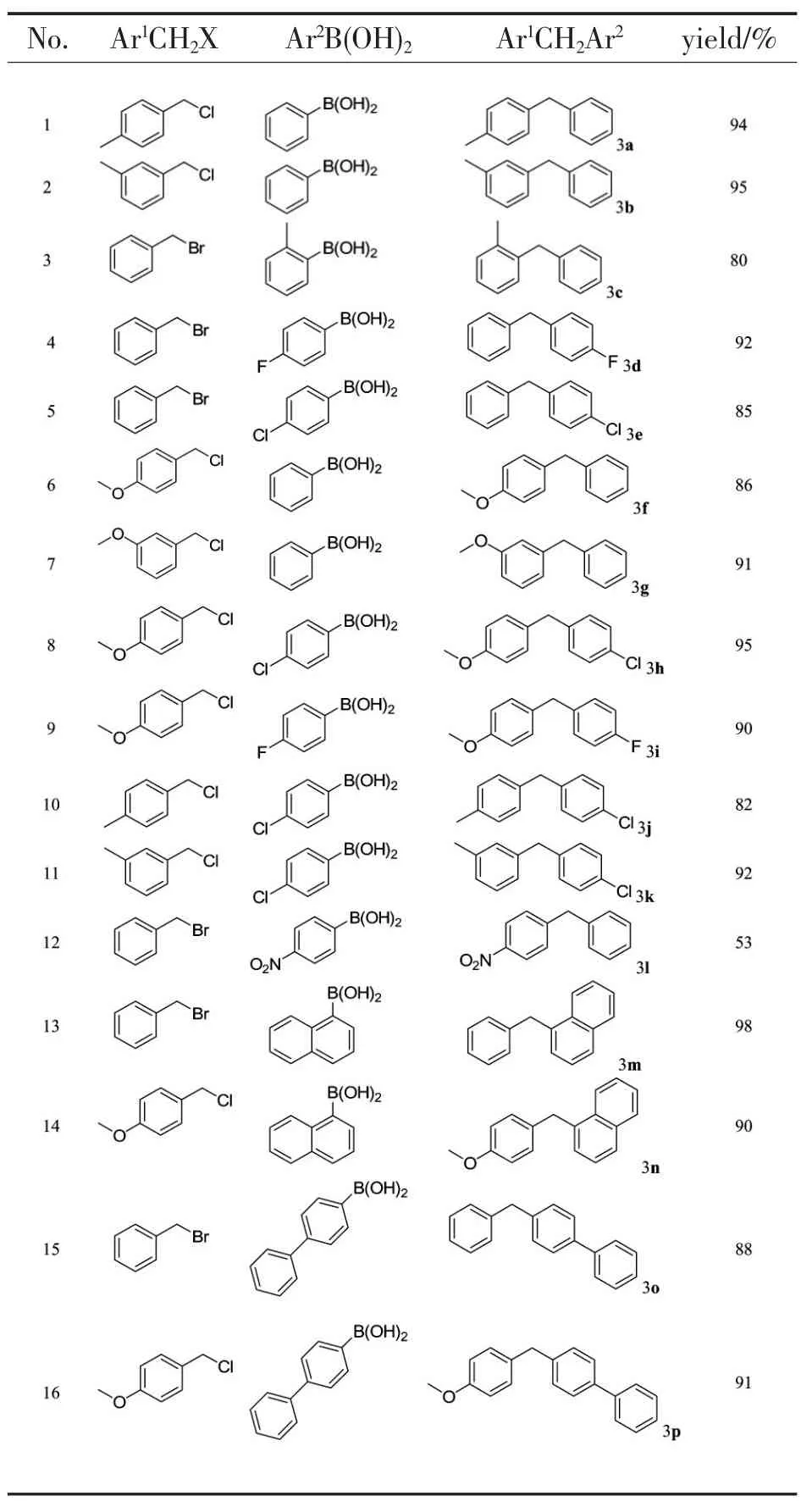
表1 不同的二苯基甲烷衍生物及其反应分离收率
3b:以间甲基氯苄和苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率95%,无色液体。1H NMR (CDCl3):δ 2.38 (s,3H),4.01(s,2H),7.05~7.09(m,3H),7.23~7.28 (m,4H),7.33~7.36 (m,2H);13C NMR (CDCl3):δ 141.3,141.1,138.0,129.8,129.0,128.5,128.4,126.9,126.05,126.03,41.94,2 1.4;MS (EI):m/z 182.1 (M+)。
3c:以溴苄和邻甲基苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率80%,无色液体。1H NMR (CDCl3):δ 2.28 (s,3H),4.03 (s,2H),7.14~7.24 (m,7H),7.28~7.32 (m,2H);13C NMR (CDCl3):δ140.4,139.0,136.6,130.3,130.0,128.8,128.4,126.5,126.0,39.5,19.7;MS (EI):m/z 182.1 (M+)。
3d:以溴苄和对氟苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率92%,无色液体。1H NMR(CDCl3):δ3.98(s,2H),6.98~7.02 (m,2H),7.16~7.28 (m,5H),7.31~7.34 (m,2H);13C NMR (CDCl3):δ 162.5,160.5,141.0,136.8,130.4 (d,J=7.5 Hz),128.8 (d,J=36.3 Hz),126.3,115.3 (d,J=20 Hz),41.1;MS (EI):m/z 186.0 (M+)。
3e:以溴苄和对氯苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率85%,无色液体。1H NMR(CDCl3):δ3.98 (s,2H),7.14~7.35 (m,9H);13C NMR (CDCl3):δ140.6,139.7,132.0,130.3,129.0,128.66,128.65,126.4,41.3;MS(EI):m/z 202.0 (M+)。
3f:以对甲氧基氯苄和苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率85%,无色液体。1H NMR (CDCl3):δ 3.82 (s,3H),3.97 (s,2H),6.87~6.89 (m,2H),7.15 (d,J=8.6 Hz,2H),7.24~7.25(m,2H),7.7.28~7.34 (m,2H);13C NMR (CDCl3):δ 158.0,141.6,133.3,129.9,128.8,128.4,126.0,113.9,55.3,41.1;MS (EI):m/z 198.0 (M+)。
3g:以间甲氧基氯苄和苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率85%,无色液体。1H NMR (CDCl3):δ 3.80(s,3H),3.99(s,2H),6.77~6.83 (m,3H),7.227.23 (m,4H),7.30~7.33(m,2H)。13C NMR(CDCl3):δ 159.7,142.7,140.9,129.4,128.9,128.4,126.1,121.4,114.8,111.3,55.1,42.0;MS (EI):m/z 198.1 (M+)。
3h:以对甲氧基氯苄和对氯苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率95%,无色液体。1H NMR (CDCl3):δ 3.81 (s,3H),3.92 (s,2H),6.86~6.87 (m,2H),6.98 (t,J=8.7 Hz,2H),7.10~7.16 (m,4H);13C NMR (CDCl3):δ 158.2,140.1,132.7,131.8,130.2,129.9,128.6,114.0,55.3,40.4;MS (EI):m/z 232.0 (M+)。
3i:以对甲氧基氯苄和对氟苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率90%,无色液体。1H NMR (CDCl3):δ 3.80 (s,3H),3.90(s,2H),6.84~6.87 (m,2H),7.08~7.12 (m,4H),7.24~7.28(m,2H);13C NMR (CDCl3):δ 160.4,158.1,137.3 (d,J=3.3 Hz),133.1,130.2 (d,J=7.8 Hz),129.8,115.2(d,J=21.2 Hz),114.0,55.3,40.2;MS(EI):m/z 216.0(M+)。
3j:以对甲基氯苄和对氯苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率82%,无色液体。1H NMR (CDCl3):δ 2.35 (s,3H),3.93 (s,2H),7.08~7.09 (m,2H),7.13~7.14 (m,4H),7.26~7.28(m,2H);13C NMR (CDCl3):δ 140.0,137.6,135.9,131.9,130.3,129.3,129.1,128.8,128.6,128.3,40.9,21.1;MS (EI):m/z 215.9 (M+)。
3k:以间氧基氯苄和对氯苯硼酸为原料,反应过程同上,过硅胶柱得产品,收率92%,无色液体。1H NMR (CDCl3):δ 2.35 (s,3H),3.94 (s,2H),6.99~7.00 (m,2H),7.06 (d,J=7.6 Hz,1H),7.14~7.15 (m,2H),7.21(t,J=7.5 Hz,1H),7.27~7.29 (m,2H);13C NMR (CDCl3):δ 140.6,139.8,138.3,131.9,130.4,129.7,128.64,128.57,127.2,126.0,41.3,21.5;MS (EI):m/z 216.0 (M+)。
3l:以溴苄和对硝基苯硼酸为原料,反应过程同上,过硅胶柱得产品为无色液体,收率53%,淡黄色液体。1H NMR (CDCl3):δ 4.09,7.197.20 (m,2H),7.25~7.28 (m,1H),7.33~7.37 (m,4H),8.15~7.17 (m,2H);13C NMR (CDCl3):δ 148.8,146.4,139.1,129.5,128.8,128.7,126.6,123.5,41.5;MS(EI):m/z 213.1 (M+)。
3m:以溴苄和1-萘硼酸为原料,反应过程同上,过硅胶柱得产品,收率98%,白色固体,mp=47 ℃~49 ℃。1H NMR (CDCl3):δ 4.49 (s,2H),7.23~7.34 (m,5H),7.44~7.50 (m,3H),7.80 (d,J=8.2 Hz,1H),7.89~7.91 (m,1H),8.03~8.05 (m,1H);13C NMR (CDCl3):δ 140.7,136.7,134.0,132.2,128.9,128.7,128.5,127.4,127.2,126.1,126.0,125.6,124.3,39.1;MS (EI):m/z 218.1 (M+)。
3n:以对甲氧基氯苄和1-萘硼酸为原料,反应过程同上,过硅胶柱得产品,收率90%,白色固体,mp=82 ℃~86 ℃。1H NMR (CDCl3):δ 3.79 (s,3H),4.41 (s,2H),6.82~6.84 (m,2H),7.13 (d,J=8.65 Hz,2H),7.28~7.30 (m,1H),7.42~7.48(m,2H),7.77 (d,J=8.2 Hz,1H),7.87~7.89 (m,1H),8.01~8.03(m,1H);13C NMR(CDCl3):δ 158.0,137.1,134.0,132.7,132.1,129.7,128.7,127.2,127.1,126.0,125.58,125.56,124.3,113.9,55.3,38.2;MS (EI):m/z 248.1 (M+)。
3o:以苄溴和4-联苯基硼酸为原料,反应过程同上,过硅胶柱得产品,收率88%,黄色固体,mp=83 ℃~87 ℃。1H NMR (CDCl3):δ 4.05 (s,2H),7.24~7.36(m,8H),7.43~7.46 (m,2H),7.53~7.55(m,2H),7.59~7.60(m,2H);13C NMR (CDCl3):δ 141.1,140.3,139.1,129.4,129.0,128.8,128.6,127.3,127.13,127.06,126.2,41.6;MS (EI):m/z 244.1 (M+)。
3p:以对甲氧基氯苄和4-联苯基硼酸为原料,反应过程同上,过硅胶柱得产品,收率91%,白色固体,85 ℃~88 ℃。1H NMR (CDCl3):δ 3.81(s,3H),3.99 (s,2H),6.87 (d,J=8.55 Hz,2H),7.17(d,J=8.5 Hz,2H),7.28~7.28 (m,2H),7.33~7.36(s,1H),7.42~7.45 (m,2H),7.45~7.54 (m,2H),7.58~7.59 (m,2H);13C NMR (CDCl3):δ 158.0,141.1,140.7,139.0,133.2,129.9,129.2,128.7,127.2,127.1,127.0,114.0,55.3,40.7;MS (EI):m/z 274.1 (M+)。
2.2 反应活性
当底物苄基卤代物为氯苄类化合物,其苯环上有供电子基团时,这些氯苄类化合物可以直接与芳基或取代芳基硼酸反应,获得较好的产物收率(表1 中1,2,6~11,14,16)。当其苯环上没有供电子基团存在,直接用氯苄为原料与苯硼酸类底物反应时,发现反应速度很慢,原料很难完全转化。用溴苄替代氯苄,反应明显很快,可获得较高的产物分离收率(表1 中3~5)。当芳基硼酸含强吸电子基如硝基时,产物收率只有53%。
3 结论
以苄基卤代物和芳基硼酸为原料,以Pd(OAc)2为催化剂、三苯基膦为配体、磷酸三钾为碱、甲苯为溶剂,较温和的条件下发生Suzuki 偶联反应,经过简单的后处理可以得到二苯基甲烷衍生物。大部分苄基卤代物与芳基硼酸都能够在该体系中较好地进行反应,获得较高收率的产物。
[1]Shang H,Chen H,Zhao D M,et al.Synthesis and biological evaluation of 4α/4β-imidazolyl podophyllotoxin analogues as antitumor agents [J].Arch.Pham.Chem.Life.Sci.,2012,345:43-48.
[2]李耀武,周有骏,朱驹,等.作用于秋水仙碱位点的微管蛋白抑制剂的结合模式研究和结构构型的构建[J].化学学报,2008,66:1735-1739.
[3]Yeung C S,Dong V M.Catalytic dehydrogenative crosscoupling:forming carbon-carbon bonds by oxidizing two carbon-hydrogen bonds [J].Chem.Rev.,2011,111:1215-1292.
[4]Borduas N,Powell D A.Copper-catalyzed oxidative coupling of benzylic C-H bonds with 1,3-dicarbonyl compounds [J].J.Org.Chem.,2008,73:7822-7825.
[5]Xiang S K,Zhang B,Jiao N,Iron-mediated cross dehydrogenative coupling (CDC) of terminal alkynes with benzylic ethers and alkanes [J].Sci China Chem.,2012,55:50-54.
[6]Ni Z K,Zhang Q,Xiong T,et al.Highly regioselective copper-catalyzed benzylic C-H amination by N-fluoroben zenesulfonimide[J].Angew.Chem.Int.Ed.,2012,124:1270-1273.
[7]Camille A C,Li C J.Copper-catalyzed cross-dehydrogenative coupling (CDC) of alkynes and benzylic C-H bonds [J].Adv.Synth.Catal.,2010,352:1446-1450.
[8]Miyaura N,Suzuki A.Palladium-catalyzed cross-coupling reactions of organoboron compounds [J].Chem.Rev.,1995,95:2457-2483.
猜你喜欢
——腐竹中的形态研究
