正交设计法优化布洛芬缓释骨架片的处方工艺
2014-03-09祝侠丽贾永艳黄海英杜艳龙河南中医学院药学院郑州450008
祝侠丽,贾永艳,黄海英,杜艳龙(河南中医学院药学院,郑州 450008)
布洛芬为非甾体抗炎药,主要用于风湿、类风湿性关节炎和骨关节炎以及神经痛、牙痛、痛经等的治疗[1]。近年来还发现该药是有效的前列腺素合成酶抑制剂,具有较好的解热、镇痛作用,可用于感冒、发烧等,临床应用亦很广泛;口服易吸收,1.2~2.1 h 血药浓度达到峰值,但生物半衰期很短(1.8~2 h),需频繁用药(每日3~4次),因而进一步增加了该药的胃肠道反应,如腹胀、消化不良、恶心、呕吐、腹泻、消化道溃疡等,甚至导致胃肠道出血[2],同时也增加了对肾脏的损伤作用[3]。因此,有必要制备其缓释制剂以减少其不良反应[4]。目前,缓释制剂剂型主要有片剂、微胶囊、微球、微粒、纳米微囊微球等,其中缓释骨架片制备工艺简单、成本较低廉。布洛芬为水不溶性化合物,故笔者采用水溶性高分子材料羟丙甲纤维素(HPMC)为骨架材料,微晶纤维素(MCC)和乳糖为致孔剂,利用正交试验设计对布洛芬缓释骨架片的处方和工艺进行优化,并以累积释放百分率作为评价指标,以确定最佳处方。结果表明,该方法制备的布洛芬缓释骨架片体外释放度符合原国家食品药品监督管理局国家药品标准[5]对缓释片的要求。
1 材料
1.1 仪器
DP-30单冲压片机(北京国药龙立科技有限公司);BS110型电子天平(上海精密仪器仪表有限公司);PD-200C型片剂硬度计(上海黄海药检仪器有限公司);D-800L 智能药物溶出仪(天津大学无线电厂);UV-2201型紫外-可见分光光度计(日本岛津公司)。
1.2 药品与试剂
布洛芬原料药(浙江巨化集团公司制药厂,批号:20110418,纯度:≥98%);60RT50 HPMC(山东瑞泰化工有限公司);乳糖(天津市科密欧化学试剂开发中心);MCC(华北制药康欣药业有限公司,批号:20040630);磷酸二氢钾(北京化工厂,批号:810328)、氢氧化钠(天津市福禄化工试剂厂)等均为分析纯。
2 方法与结果
2.1 布洛芬缓释骨架片的处方筛选
以HPMC为缓释骨架材料,制备布洛芬缓释骨架片。由于其释放速度取决于凝胶层的逐步溶蚀的速度,为加速其在2 h后的释放,加入MCC 和水溶性的乳糖为致孔剂,以硬脂酸镁为润滑剂,90%的乙醇溶液为黏合剂,片重300 mg,每片含布洛芬约192 mg。
2.2 布洛芬含量测定方法考察[6]
精密称取布洛芬原料药5 mg,置于50 ml 量瓶中,加pH 7.2 磷酸盐缓冲溶液溶解并定量稀释制成质量浓度为1、2、4、6、8、10 μg/ml的系列标准溶液,以pH 7.2磷酸盐缓冲溶液为空白,于222 nm 波长处分别测定其吸光度值,以吸光度(y)为纵坐标、质量浓度(x)为横坐标进行线性回归,得回归方程为:y=0.066 4x+0.093 6(r=0.999 6)。结果表明,布洛芬检测质量浓度的线性范围为1~10 μg/ml。将2、6、10 μg/ml的标准溶液于室温放置,分别于同日内测定5 次,结果日内RSD 分别为0.72%、0.50%、0.34%(n=5);每日测定1 次,连续测定5 d,结果日间RSD分别为1.56%、1.22%、0.60%(n=5)。按处方量的80%、100%、120%称取布洛芬原料药适量,分别加处方比例的辅料,以pH 7.2磷酸盐缓冲溶液溶解定容,制成质量浓度分别为6.4、8.0、9.6 μg/ml的样品溶液,过滤后于222 nm波长处测定吸光度,计算回收率,结果各质量浓度样品溶液的回收率分别为98.65%、99.02%、100.05%,RSD 分别为1.04%、0.62%、0.58%(n=5)。
2.3 体外释放度方法考察[7]
以释放度测定法[2010年版《中国药典》(二部)附录ⅩD]第一法(篮法)装置,释放介质为pH 7.2 磷酸盐缓冲溶液900 ml,转速为100 r/min,温度为37 ℃,依法操作,考察24 h 内的体外释放度。样品溶液经滤过后用pH 7.2磷酸盐缓冲溶液稀释,摇匀,作为供试品溶液,照分光光度法于222 nm 波长处测定其吸光度,并代入标准曲线方程计算含量,再计算累积释放百分率。
2.4 正交设计优化处方与工艺
影响片剂制备的因素较多,且各个因素之间又有一定的内在联系,为优化制备工艺,利用均匀试验设计对片剂处方组成和制备条件等因素进行优化[8]。在预试验的基础上,以2、4、6 h的累积释放百分率为考察指标,选择对缓释骨架片释放百分率影响显著的3个因素:HPMC、MCC在处方中的用量及片剂的硬度为考察对象,每个因素取3个水平进行考察。正交试验因素水平见表1,按正交试验设计L9(34)安排试验方案,结果见表2,极差分析见表3,方差分析见表4。
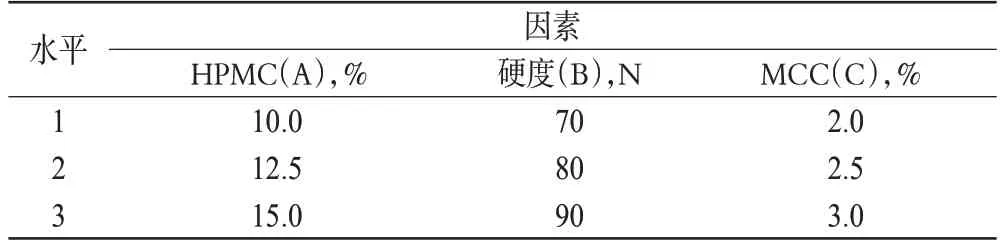
表1 正交试验因素水平Tab 1 Factors and levels of orthogonal test
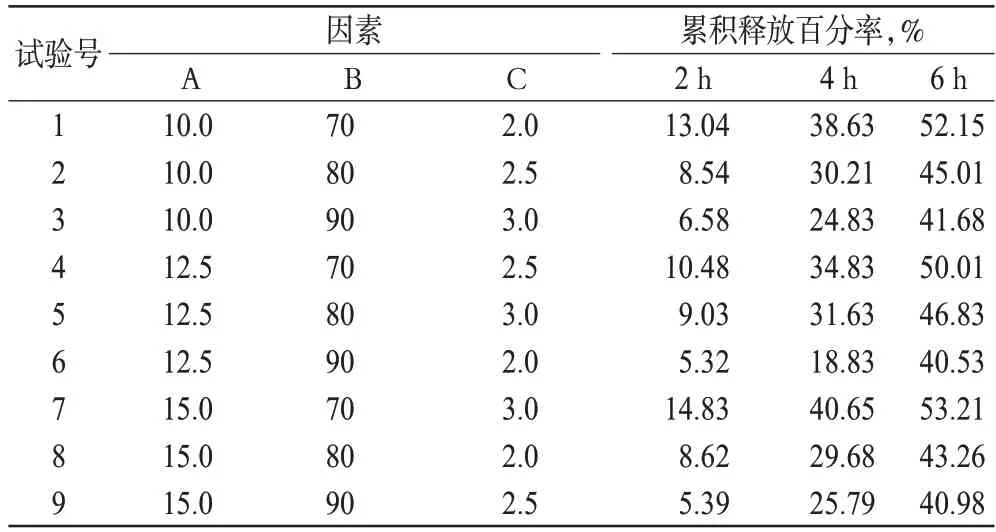
表2 正交试验方案与结果分析Tab 2 Design and results of orthogonal test
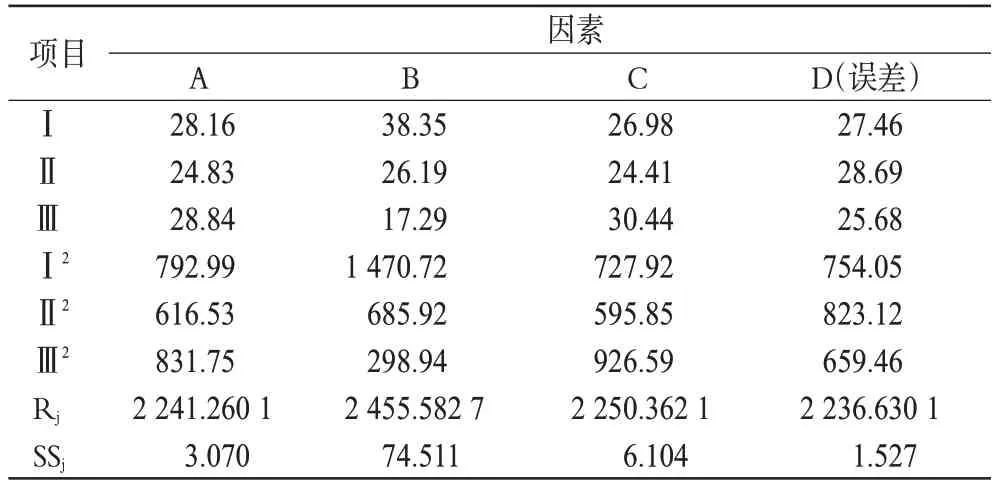
表3 正交试验结果极差分析Tab 3 Results of extreme difference analysis of orthogonal test

表4 正交试验结果方差分析Tab 4 Results of variance analysis of orthogonal test
根据原国家食品药品监督管理局国家药品标准的要求,布洛芬缓释片的释放百分率应符合:在0~2 h 释放百分率小于标示量的10%;0~4 h 累积释放百分率为标示量的25%~55%;0~6 h累积释放百分率为标示量的50%~80%。由表2结果显示,0~2 h的累积释放百分率占标示量的百分含量的值越低,缓释效果越好。所以,本研究以均匀试验设计各因素为自变量(x),0~2 h的累积释放百分率为主要指标(y),并以4、6 h的累积释放百分率两个指标为辅进行考察。结果表明,对处方的影响大小依次为B>C>A,综合考虑4 h 和6 h 的累积释放百分率,最终确定最佳处方为A2B2C3。
2.5 验证试验
按照均匀试验设计所得最佳处方制备布洛芬缓释骨架片3 批。取布洛芬32 g、HPMC 6.0 g、MCC1.5 g 及乳糖6.0 g,粉碎,分别过80目筛。按各自处方量称取上述原辅料,在研钵中混合,过40 目筛混合3 次,加90%的乙醇溶液制成适宜的软材,过16 目尼龙筛制湿颗粒,于55~60 ℃的烘箱中烘干(约1 h),过16 目尼龙筛整粒,加硬脂酸镁4.5 g 混合均匀,压片,硬度为80 N。按照“2.3”项下方法进行体外释放度考察,以累积释放百分率对时间作图描绘布洛芬缓释骨架片体外释放曲线,结果见图1。

图1 3批布洛芬缓释骨架片体外释放曲线Fig 1 Release curves of 3 batches of Ibuprofen sustained-release matrix tablets in vitro
由图1结果显示,本试验制备的布洛芬缓释骨架片具有明显的缓释效果,在0~2 h内累积释放百分率小于10%,释放完全大概需要24 h;3批样品各时间点累积释放百分率的RSD均小于1%,说明批间差异较小、重现性良好。采用一级动力学方程及Higuchi方程对3批布洛芬缓释骨架片的体外释放规律进行数学模型拟合,结果见表5。

表5 布洛芬缓释骨架片的体外释放模型拟合Tab 5 Fitted release model of Ibuprofen sustained-release matrix tablets in vitro
由表5结果显示,所制备的布洛芬缓释骨架片的释放更符合Higuchi过程(r>0.980 0)。
3 讨论
布洛芬原料药为小的块状结晶,可压性较差,而片剂中主药含量又较大,约200 mg,因此除了选择可压性好的赋型剂如MCC、乳糖以外,需特别注意压片过程中压力的选择。本试验中缓释片的质量对压力较敏感,当压力较小、平均硬度为70 N时药物释放较快;当增大压力,释药速度减慢;如继续增大压力、硬度提高至100 N时,与90 N时的药物释放情况无明显差别,但在压片过程中容易出现裂片现象。此外,其他工艺条件如高分子缓释材料溶液与原辅料的混合时间、溶媒量、颗粒干燥温度、干燥时间及辅料质量、黏度等均可能对缓释片体外释药速度产生影响。
水凝胶骨架片剂具有优良的生物相容性和极好的重现性及缓控释性能[9],在药剂方面的应用备受关注。本试验以在水中几乎不溶的布洛芬为模型药物,以湿法制粒对布洛芬水凝胶骨架片药物释放影响因素进行了探索。通过均匀试验设计法,对布洛芬缓释骨架片的制备及工艺进行研究,并确定最佳工艺。本试验研制的布洛芬缓释骨架片成型性好,体外释放符合拟定的释药速度要求,是对工艺优化设计等方面的有益的探索。由正交试验可见,片剂硬度对该缓释骨架片影响最大。由释放度结果可见,布洛芬缓释骨架片具有缓释作用,达到了《中国药典》关于布洛芬缓释片的要求,释放度重现性良好,且释放规律较好地符合一级动力学方程,属于溶蚀释药机制[10],但该缓释片体内释放、吸收等情况还有待进一步研究。
[1]王津,李柱来,陈莉敏.布洛芬缓释微球的释放性能及体内外相关性研究[J].中国药业,2008,17(1):6.
[2]仲珑瑾,程能能.非甾体抗炎药致胃肠道损害机制的研究进展[J].中国临床药学杂志,2004,13(1):56.
[3]Henry D,McGettigan P.Epidemiology overview of gastrointestinal and renal toxicity of NSAIDs[J].Int J Clin Pract Suppl,2003(135):43.
[4]李全斌,乔明艳,钱宏波,等.布洛芬剂型的研究概况[J].黑龙江医药,2010,23(5):765.
[5]国家食品药品监督管理局.WS1-(X-011)-2001Z 布洛芬缓释片[S].2001.
[6]韩秀梅,王佳.用紫外分光光度法测定布洛芬片的含量[J].中国药师,2002,5(9):567.
[7]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录97.
[8]郝行舟,李春生.正交试验设计方法在试验设计中的应用[J].河南交通科技,1999,19(6):26.
[9]许鲁宁,黄芳,吴锡添.布洛芬HPMC骨架片药物释放因素研究[J].海峡药学,2002,14(6):34.
[10]张丽霞,侯永利.盐酸阿夫唑嗪缓释片的初步研制[J].中国药师,2002,5(2):71.
