自制单硝酸异山梨酯缓释胶囊的体外释放度考察
2014-03-09马亚中郭双艳空军总医院药学部北京100142
马亚中,吴 燕,郭双艳(空军总医院药学部,北京 100142)
单硝酸异山梨酯是硝酸异山梨酯的主要活性代谢物[1],其可通过扩张外周血管、减少心肌耗氧量从而缓解或消除心绞痛[2],临床用于冠心病的长期治疗、血管痉挛型和混合型心绞痛的预防[3-4]。目前,国内虽有很多厂家生产单硝酸异山梨酯缓释胶囊,但质量差别较大,缓释效果较不理想,取样时间点分别有不同程度的突释现象,容易产生不良反应。因此,笔者研制了单硝酸异山梨酯缓释胶囊。为了考察该制剂的生产工艺,保证不同批号产品之间的质量稳定性,笔者建立了考察该制剂体外释放度的方法[5-7]。
1 材料
1.1 仪器
1260 型高效液相色谱仪,包括四元泵、VWD检测器(美国Aglient公司);ZRS-8G溶出试验仪(天津市天大天发科技有限公司);KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 药品与试剂
单硝酸异山梨酯标准品(中国食品药品检定研究院,批号:100694-200401,纯度:99.9%);单硝酸异山梨酯缓释胶囊(自制品,批号:20121003、20121004、20 121005;对照品,珠海许瓦兹制药有限公司,批号:611001;规格:均为每粒60 mg);甲醇为色谱纯;水为自制;其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Venusil MP C18(250 mm×4.6 mm,5µm);流动相:甲醇-水(37 ∶63),流速:1.0 ml/min;检测波长:220 nm;进样量:20µl;柱温:25 ℃。溶剂:混合流动相。理论板数按单硝酸异山梨酯峰计不低于5 000。取“2.2”项下标准品溶液、供试品溶液、空白溶剂(即流动相)及空白辅料溶液进样分析,色谱图见图1。
2.2 溶液的制备
精密称取减压干燥后的单硝酸异山梨酯标准品适量,加水溶解并定量稀释制成质量浓度为100µg/ml的溶液,作为标准品溶液。取样品细粉适量(约含主药50 mg),至50 ml 量瓶中,加水适量,超声使溶解并稀释至刻度,摇匀;精密量取1 ml置于10 ml 量瓶中,加水稀释至刻度,摇匀,过滤,作为供试品溶液。按处方量称取本品辅料,按供试品溶液制备方法制备成空白辅料溶液。
2.3 标准曲线的制备
精密称取经减压干燥后的单硝酸山梨酯标准品50 mg,置于50 ml 量瓶中,加水超声溶解并稀释至刻度,摇匀,配制成1 mg/ml溶液;分别精密量取该溶液1、2、3、4、5、6、7 ml,分别置于50 ml量瓶中,加水稀释至刻度,摇匀,制成相当于检测质量浓度20%、40%、60%、80%、100%、120%、140%的溶液,配成20~140 µg/ml 的线性质量浓度,注入色谱仪,记录色谱图。以质量浓度(c)为横坐标、峰面积(A)为纵坐标进行线性回归,得线性方程为:A=9.258 5c+9.077 8(r=0.999 9)。结果表明,单硝酸异山梨酯检测质量浓度线性范围为20~140µg/ml。
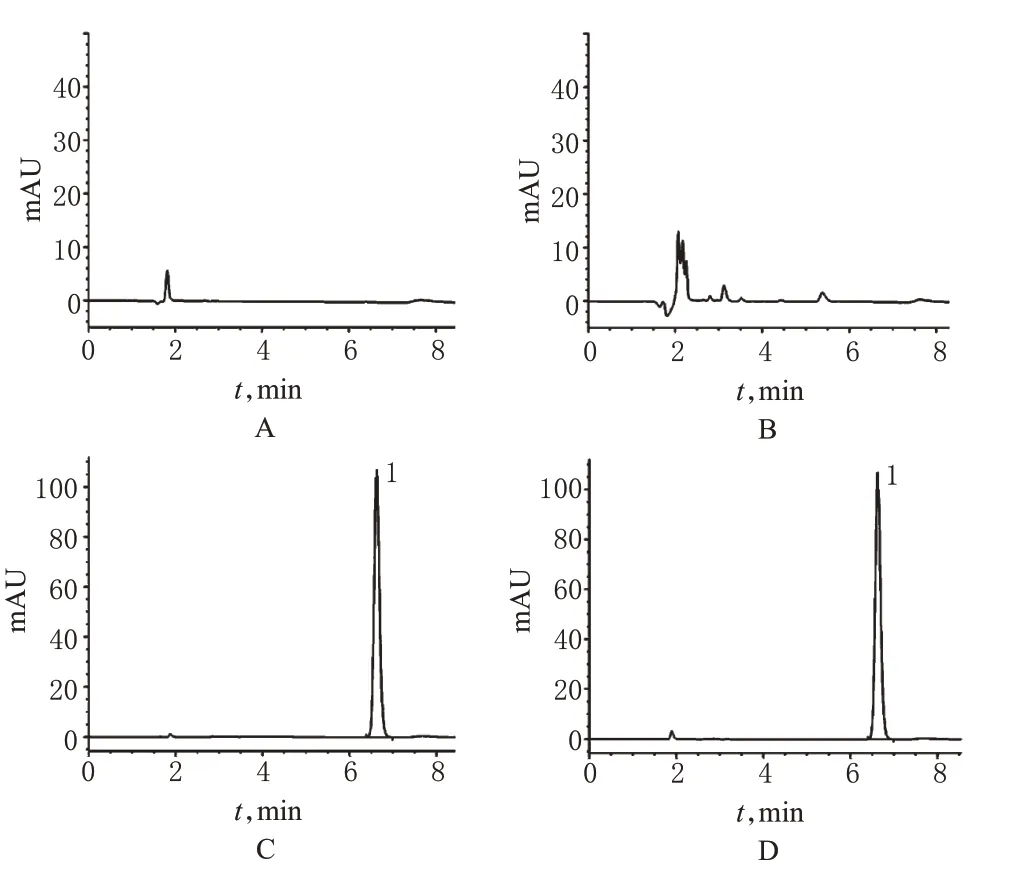
图1 高效液相色谱图A.空白溶剂;B.空白辅料溶液;C.标准品溶液;D.供试品溶液(批号:20121003);1.单硝酸异山梨酯Fig 1 HPLC chromatogramsA.blank solvent;B.blank excipients solution;C.standard solution;D.test solution(lot No.20121003);1.isosorbide mononitrate
2.4 回收率试验
按处方量称取辅料,分别加入单硝酸异山梨酯标准品,相当于处方量的80%、100%、120%,混合均匀,置于50 ml量瓶中,加水适量超声溶解并稀释至刻度,摇匀,过滤;分别精密量取续滤液1 ml至10 ml量瓶中,加水稀释至刻度,摇匀,作为供试品溶液。另精密称取单硝酸异山梨酯标准品约50 mg 置于50 ml量瓶中,用水适量超声溶解并稀释至刻度,摇匀,滤过;精密量取1 ml至10 ml量瓶中,加水稀释至刻度,摇匀,作为对照品溶液。依法测定含量并计算回收率,结果见表1。

表1 回收率试验结果(n=3)Tab 1 Results of recovery test(n=3)
2.5 精密度试验
精密量取“2.2”项下100µg/ml的标准品溶液20µl,重复进样6次,结果单硝酸异山梨酯峰面积的RSD=0.47%(n=6)。
2.6 稳定性试验
取“2.2”项下供试品溶液在室温放置,分别于0、2、4、6、8、10、12 h 进样20 µl,测定。结果单硝酸异山梨酯峰面积的RSD=0.75%(n=7),表明供试品溶液在12 h内稳定。
3 释放度测定
3.1 释放介质的选择
考虑患者年龄、体质、身体状况等的不同,本试验采用2010年版《中国药典》方法[8]及“日本药品品质再评价工程”中推荐使用的4种溶剂(水、pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液)为释放介质(其在后3种介质中的线性方程分别为A=9.617 5c+4.514 3、A=9.842 3c-13.329 0、A=10.021c-24.634,r分别为0.999 9、0.999 5、0.999 9)。分别于1、4、8 h取样(批号:20121003)10 ml,过滤,同时补充等温同体积的释放介质;取续滤液20 µl,测定,计算累积释放度(%),结果见图2。

图2 单硝酸异山梨酯缓释胶囊在4 种介质中的累积释放度比较Fig 2 Comparison of accumulative release rate of Isosorbide mononitrate sustained-release capsules in 4 mediums
由图2可知,单硝酸异山梨酯缓释胶囊在4种释放介质中的释放行为没有明显差异。以简单方便为原则,选择水为释放介质。
3.2 释放度测定方法的选择
本品为胶囊,采用桨法时胶囊会漂浮在液面上,故参照2010年版《中国药典》溶出度测定法第一法(篮法)[8]进行测定。
3.3 转速的选择
以水为释放介质进行本品的释放度测定,转速分别选择50、75、100 r/min,其累积释放度结果见图3。

图3 单硝酸异山梨酯缓释胶囊在不同转速下的累积释放度比较Fig 3 Comparison of accumulative release rate of Isosorbide mononitrate sustained-release capsules at different rotation speeds
由图3可知,采用以上3种转速,释放度无明显差别,药物均可释放完全。综合考虑以上结果,确定本品释放试验转速为50 r/min。
3.4 释放度均一性及重现性试验
取3批样品各6粒,采用篮法,以水500 ml为释放介质,转速为50 r/min,水温(37.5±0.5)℃,分别放入释放杯中,于1、4、8 h时取样10 ml(同时补充等温同体积的释放介质),滤过,作为供试品溶液;另取单硝酸异山梨酯标准品适量,制备成100µg/ml 的标准品溶液,计算各样品在不同时间点的累积释放度,结果见图4。
由图4可知,3批样品在8 h时累积溶出度均大于80%,各取样点RSD 均小于2%(n=6),表明释放度均一性和重现性良好。

图4 3批样品释放度均一性和重现性考察结果Fig 4 Uniformity and reproducibility of release rate for 3 batches of samples
3.5 相似因子(f2)法评价释放曲线
取单硝酸异山梨酯缓释胶囊自制品与对照品进行释放度考察,其释放曲线见图5。

图5 自制品与对照品释放度比较Fig 5 Comparison of release rate of self-made preparation with reference preparation
采用f2法对两条药物体外释放曲线进行评价,计算公式[9]为:
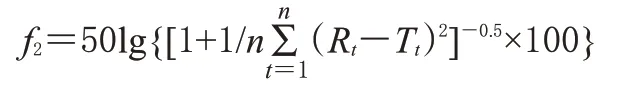
式中,Rt和Tt分别为各取样时间点自制品与对照品的平均释放度,n为取样时间点个数。如果50≤f2≤100,表示两者相似,在此范围内,f2越大表示越相似。计算得自制品和对照品释放曲线的f2为85.37,可认为两者释放度相似。
3.6 释放模型拟合
分别取自制品和对照品按照“3.4”项下释放度测定方法,依法操作,并分别采用一级方程、Higuchi方程及Weibull[10-11]模型对二者的体外释放数据即累积释放度(Q)-时间(t)进行拟合,结果见表2。

表2 释放模型拟合结果Tab 2 Results of release model fitting
将两种制剂分别用不同释放模型进行拟合,结果表明两种制剂的体外释放行为最符合Higuchi方程。
4 讨论
4.1 波长的选择[12-13]
本试验最初采用紫外分光光度法测定单硝酸异山梨酯缓释胶囊的含量,但空白辅料在主药的最大吸收波长处有紫外吸收,而且供试液自身的吸收度值偏低,辅料对其测定有一定的影响。为使测定结果准确,故建立了专属性更强的高效液相色谱法进行测定。在选择测定波长时,最初参考相关文献[14]选用210 nm,但此波长处甲醇的干扰峰较大,为了避免甲醇的末端吸收,最终选择测定波长为220 nm。
4.2 取样时间点的选择
本试验取样点的选择参考国外进口标准[珠海许瓦兹WS1-(X-116)-2006Z][15],分别为1、4、8 h 3个取样点。1 h取样点用于考察药物是否有突释现象,其应在38%~50%;4 h 取样点用于考察释药物是否平稳释放,应在50%~70%;8 h 取样点用于考察药物释放是否基本完全,释放度应为75%以上。试验最初还选择了12 h的取样点,但结果证明与8 h累积释放度无太大差别,故最终确定取样时间点为1、4、8 h。
4.3 对自制品的评价
通过对自制单硝酸异山梨酯缓释胶囊在不同介质及转速条件下的释放度比较,发现其在各种释放条件下差异微小。同时,通过与对照品释放模型的拟合及f2的比较,表明自制品与对照品体外释放行为相似,相关性良好,并且动力学特征以Higuchi方程拟合较好。
[1]孙昌友,苏畅,潘丽.单硝酸异山梨酯缓释片的制备及质量控制[J].武警医学院学报,2010,19(6):456.
[2]Li ZQ,He X,Gao X,et al.Study on dissolution and absorption of four dosage forms of isosorbide mononitrate:level A in vitro-in vivo correlation[J].Eur J Pharm Biopharm,2011,79(2):364.
[3]Kim YH,Choi KS,Kam SH,et al.In vitro dissolution and in vivo bioequivalence evaluation of two brands of isosorbide 5-mononitrate sustained release tablets[J].Arzneimittelforschung,2012,62(12):576.
[4]Vidanagamage RS,Goonewardene IM.The efficacy of two different doses of vaginal isosorbide mononitrate in pre induction cervical ripening:a double blind randomised controlled trial[J].Ceylon Med J,2011,56(3):91.
[5]崔颖,王贺,吕凌,等.复方单硝酸异山梨酯缓释片中单硝酸异山梨酯的释放度测定[J].中国药业,2009,18(4):27.
[6]田洁,黄晓君,车宝泉,等.不同厂家单硝酸异山梨酯缓释制剂释放度比较[J].中国药房,2007,18(34):2 688.
[7]王建卓,李琳,魏树礼.5-单硝酸异山梨酯制剂溶出度的研究[J].中国医药工业杂志,1997,28(6):259.
[8]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录87-88.
[9]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308.
[10]韦广辉.消炎片体外溶出度考察[J].中国现代药物应用,2011,5(13):82.
[11]姜成丽.单硝酸异山梨酯胶囊溶出度比较[J].中国药房,2001,12(11):686.
[12]毛秀梅,韩蕊,杨金荣.复方氨溴索氯雷他定胶囊溶出度测定方法的研究[J].天津药学,2011,23(2):23.
[13]赵洪霞.托拉塞米片溶出度的方法学研究[J].天津药学,2011,23(4):24.
[14]高莉.HPLC 法测定单硝酸异山梨酯的含量[J].黑龙江医药,2009,4(22):451.
[15]国家食品药品监督管理局.WS1-(X-116)-2006Z 单硝酸异山梨酯缓释胶囊[S].2011-04-01.
