基因工程菌发酵表达rhG-CSF的条件优化
2014-03-08李希平
王 娟,李希平
(鲁南制药集团股份有限公司,山东临沂273400)
·工业药学·
基因工程菌发酵表达rhG-CSF的条件优化
王 娟,李希平
(鲁南制药集团股份有限公司,山东临沂273400)
目的通过优化基因工程菌Escherichia coli BL21(DE3)Plys表达重组人粒细胞集落刺激因子(rhGCSF)蛋白的发酵工艺,提高蛋白产量。方法以100 L规模发酵为例,从不同的接种量(1%~10%)、加入IPTG进行诱导时的不同OD600nm值,诱导表达后的不同溶氧可控制范围(20%~80%)等方面进行优化。用SDS-PAGE对蛋白表达量进行检测。结果优化后的方案为:采用5%的接种量,在OD600nm达到10~15时加入诱导剂IPTG,诱导起始后前20 min控制溶氧在80%以下,20 min后通过补加氨水控制pH在7.0左右,补料调节控制溶氧在20%~40%的范围内,诱导表达5 h后收集菌体。优化后的发酵方案极大提高了蛋白表达量。结论rhG-CSF蛋白发酵方案的优化对大规模生产具有重要的指导意义。
重组人粒细胞集落刺激因子;发酵;溶氧;基因工程菌
20世纪基因工程技术诞生以来,应用最为广泛的便是医药科学领域。基因工程技术的快速发展,使人们能够快速有效的获取大量的生物活性物质,能够带来巨大社会和经济效益[1]。利用基因重组技术生产的人粒细胞集落刺激因子(rhG-CSF)与天然产品相比,生物活性在体内、外基本一致[2]。G-CSF是调节骨髓中粒系造血的主要细胞因子之一,可选择性地作用于粒系造血细胞,促进其增殖、分化,并可增加粒系终末分化细胞即分周血中性粒细胞的数目与功能,适用于癌症化疗、放疗等原因导致的中性粒细胞减少症[2~5]。但基因工程发酵在应用于大规模生产的过程中,却往往存在许多例如质粒丢失严重,表达量低等问题。在大规模生产中必须避免这些不稳定因素[6]。本文从控制发酵过程中的接种量,IPTG诱导时机、pH、溶氧等简易可控因素出发,筛选出维持rhG-CSF蛋白以100 L规模发酵表达的稳定性方案。
1 材料与方法
1.1 材料 插入质粒pET3a(转入人源G-CSF基因)的基因工程菌E.coli BL21(DE3)PlysS购自重庆富进生物医药有限公司;异丙基硫代半乳糖苷(IPTG)购自Merk公司;Yeast extract、Tryptone购自Oxoid公司;M9培养基及葡萄糖购自国药公司。30 L-150 L 2联体发酵罐购自上海高机生物公司。
1.2 方法 甘油菌株于Kan抗性LB平板划线,37℃培养16~18 h,挑取规则的单菌落转接入种子瓶37℃培养6~8 h至OD600nm到0.5~1.0之间。10%接种量转入装有100 LM9培养基的发酵罐,37℃恒温通过恒速补料葡萄糖3 g·(L·h)-1培养5 h后,加1 mmol·L-1IPTG诱导蛋白表达,并停止补加葡萄糖20 min,继续诱导培养5 h后,下罐收集菌体,破碎,进行纯化,SDS-PAGE检测蛋白表达和得率。
1.3 蛋白灰度分析 对SDS-PAGE电泳检测后的蛋白凝胶进行扫描,Bandscan分析,计算目的蛋白在总蛋白中所占百分比。
1.4 质粒丢失率计算 发酵结束时的菌液稀释涂布LB平板,37℃培养过夜,每个平板用牙签挑取100个菌落,影印至含Kan抗性的LB平板和普通LB平板,37℃培养过夜,抗性板菌落对比普通板菌落计算得出质粒丢失率。
1.5 优化方法[2~10]实验分别从诱导时机、接种量、诱导起始期及诱导后的参数控制等方面多次进行100 L规模的实验优化。
2 结果
2.1 诱导表达的时机选择 以接种培养后菌悬液的OD600nm为标准,设定5~10、10~15、15~20三个范围确定最佳诱导时机。实验结果表明在OD600nm为10~15时,加入IPTG开始诱导,最后的蛋白表达水平最高,SDS-PAGE蛋白电泳凝胶的Bandscan分析显示,蛋白灰度百分比可高达43.0 %(见表1)。而若当OD600nm达5~10或15~20时进行诱导表达,最后的蛋白灰度百分比仅分别达37.6%及14.3%。

图1 SDS-PAGE检测rhG-CSF在E.coli BL21(DE3)PLysS中的表达水平

表1 目的蛋白灰度对比(%)
2.2 接种量优化 实验设计以1%、3%、5%、8%和10%的接种量对比,进行优化。结果表明采用1%和3%接种量时,达到OD600nm10~15需要6~8 h,而采用5%~10%接种量时达到最佳诱导时机所需要的时间为4~5.5 h;而且蛋白分析数据显示在5%接种量时,细菌最后表达目的蛋白的比例最高,其蛋白灰度百分比为43.2%(见图1、表1)。因此最终确定5%接种量为最佳。
2.3 诱导期优化 IPTG诱导蛋白表达的过程中,为避免补加葡萄糖对蛋白表达的抑制作用,在诱导期间停止补加葡萄糖20 min。在此期间我们通过调整转速以及通入氧气的量,改变发酵液溶氧量进行优化。最后的质粒稳定性(按国家药典检测方法获取质粒的丢失率)测定结果表明诱导期维持溶氧在80%以下为更佳(见表2)。

表2 不同溶氧质粒丢失率
诱导后,采取补料培养的生长方式。我们对补料速度进行了优化。根据罐体溶氧以及pH的变化,调控补料速度;在发酵罐维持恒定转速(200 rpm)和恒定通气量(0.3 m3·h-1)时,通过补加氨水的方式控制菌液pH在7.0左右,调控补料速度以维持溶氧分别在20%~40%、40%~60%及60%~80%的范围。诱导5 h后收集菌液,SDSPAGE电泳检测蛋白的表达并且对包涵体收率进行分析。实验数据和结果表明溶氧控制在20%~40%之间,目的蛋白的表达效果最好(图2、表3、4)。
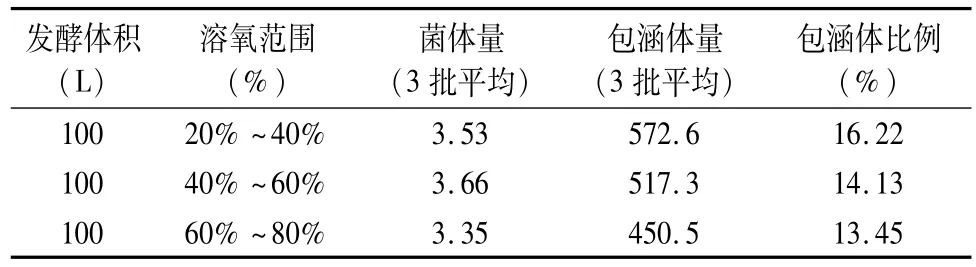
表3 不同溶氧范围包涵体收率
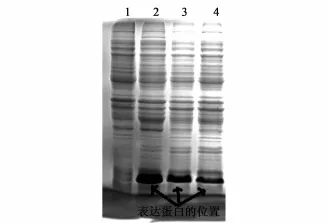
图2 SDS-PAGE检测rhG-CSF在E.coli BL21(DE3)PLysS中的表达水平

表4 目的蛋白灰度对比(%)
3 讨论
利用基因重组技术进行工业化生产人粒细胞集落刺激因子rhG-CSF已经备受关注,我们通过多次重复实验得到较优的发酵条件,实现了rhG-CSF蛋白的高效稳定表达,同时为向更大规模的生产提供了可靠的数据方案,具有重要的理论及应用价值。
在蛋白的发酵生产工艺中,接种量及蛋白表达的诱导时机对产量具有重要的影响,以我们的发酵为例,100 L培养基的接种量为10%,虽然缩短了诱导前的培养时间,也从而缩短整个发酵周期,但如此操作,菌种在前期生长过程中会产生许多不利于菌体生长和蛋白表达的因子,反而抑制了菌种后期目的蛋白的表达;以接种后补料培养时间作为标准确定蛋白诱导起始时间,由于多种不确定的影响因素,可重复性、参考性较差,故本论文优化过程中以OD600nm为标准,大大增强其参考价值。
另外,基因工程菌的部分菌株在诱导表达前会有一定的本底表达[11],而表达产物大部分对菌株都是有害的,这不利于菌株后期的生长及蛋白的表达。在100 L实际发酵表达中,由于生长条件如搅拌、通气等的变化,也会影响诱导前的本底表达。我们在发酵过程中采用的是恒定补料的培养方式,补料培养基是以一定的C/N配制而成的,碳源的主要成分是葡萄糖,氮源则是酵母提取物与蛋白胨按照比例混合而成。通过在种子中增加相应的葡萄糖,发酵中通过pH以及溶氧的参数反馈,在菌体起始生长阶段以稍过量的葡萄糖补料抑制本底表达,但是如果补料速度过快,葡萄糖浓度过高会造成过量的乙酸形成,导致pH迅速下降,溶氧迅速下降,抑制蛋白表达;故在诱导起始时需通过间歇停止补糖解除对蛋白表达的抑制作用;另外如果补料停止,搅拌和通气却仍然维持,就会造成碳源不足,pH、溶氧上升并维持在高位100 %以上,菌体生长趋于利用氮源,亦不利于质粒的稳定及目的蛋白的表达和积累[12]。
发酵过程中,为了维持罐体内的溶氧范围同时避免罐体压力泄露造成染菌,一般维持罐内压力在0.05~0.1 MPa之间。但是这同时增加了罐体内其他气体的分压,例如CO2,高溶解CO2不利于后期的表达[13]。因此在诱导前维持较高的罐压,可以避免接种后延滞期染菌,同时较高溶解CO2抑制菌株的本底表达;而诱导过程中,将罐压降至0.02 MPa左右,结合其他因素的控制可提高目的蛋白的表达。
据郑剑等[14]的研究,用甘油做培养基能够避免葡萄糖对细菌蛋白表达的抑制作用,提高总体菌体量,并增加所有蛋白的表达。而乳糖可起到相应的诱导作用又可促进后期菌体的生长及目的蛋白的表达,也可作为一种备选碳源。此外,可溶性表达也是蛋白表达的一个重要研究方向[15]。
总之,rhG-CSF蛋白的发酵工艺还有很大优化的潜能,还有许多问题值得思考。
[1]熊宗贵.生物技术制药[M].北京:中国高等教育出版社,1999:65-109.
[2]Krishna Rao DV,Ramu CT,Rao JV,et al.Impact of dissolved oxygen concentration on some key parameters and production of rhG-CSF in batch fermentation[J].J Ind Microbiol Biotechnol,2008,35(9):991-1000.
[3]Khalilzadeh R,Mohammadian-Mosaabadi J,Bahrami A,et al.Process development for production of human granulocyte-colony stimulating factor by high cell density cultivation of recombinant Escherichia coli[J].J Ind Microbiol Biotechnol,2008,35(12):1643-1650.
[4]Yim S,Jeong K,Chang H,et al.High-level secretory production of human granulocyte-colony stimulating factor by fed-batch culture of recombinant Escherichia coli[J].Bioprocess Biosyst Eng,2001,24(4):249-254.
[5]Das KM,Banerjee S,Shekhar N,et al.Cloning,soluble expression and purification of high yield recombinant hGMCSF in Escherichia coli[J].Int JMol Sci,2011,12(3):2064-2076.
[6]Babaeipour V,Abbas MP,Sahebnazar Z,et al.Enhancement of human granulocyte-colony stimulating factor production in recombinant E.coli using batch cultivation[J].Bioprocess Biosyst Eng,2010,33(5):591-598.
[7]李民,陈常庆.重组大肠杆菌高密度发酵研究进展[J].生物工程进展,2000,20(2):26-31.
[8]刘社际,杨立明.重组人生长激素在大肠杆菌BL21(DE3)中高效表达研究[J].生物技术通讯,2000,11(4):264-267.
[9]杨炜,王伟刚,田海英,等.重组大肠杆菌高表达高密度发酵研究[J].生物技术,2006,16(3):83-86
[10]薛文娇.重组E.coli生产类人胶原蛋白发酵调控策略与500L中试规模放大方法优化[D].西北大学,2009.
[11]李会成,李文辉.基因工程菌的发酵研究[J].生物工程进展,1997,17(2):40-43.
[12]kesson M,Hagander P,Axelsson JP.A probing feeding strategy for Escherichia coli cultures[J].Biotechnology Techniques,1999,13(8):523-528.
[13]Pan JG,Rhee JS,Lebeault JM.Physiological constraints in increasing biomass concentration of Escherichia coli B in fed-batch culture[J].Biotechnol Lett,1987,9(2):89-94.
[14]郑剑,吴琳琳,李敏.乳糖诱导高分子量重组蛛丝蛋白发酵培养基优化[J].中国生物工程杂志,2008,28(12):41-46.
[15]Zhu F,Wang Q,Pu H,et al.Optimization of soluble human interferon-γproduction in Escherichia coli using SUMO fusion partner[J].World JMicrobiol Biotechnol,2013,29(2):319-325.
Optim ization of the fermentation of rhG-CSF using recom bined strain
WANG Juan,LIXi-ping
(Lunan Pharmaceutical Group Corporation,Linyi273400,China)
ObjectiveTo improve the rhG-CSF protein from the recombined strain Escherichia coli BL21(DE3)Plys,the batch fermentation conditions was optimesed.MethodsWe determined the influence of the parameters at some crucial control points,including different inoculation amount(1%~10%),the OD600nmof fermentation culturewhen adding inducer IPTG and the different concentrations of dissolved oxygen(DO)(20%~80%)on the final protein expression in 100 L batch level fermentation.A SDS-PAGEwas used to analyze the protein expression.ResultsThe optimized fermentation condition was as follow:inoculum quantity 5%,IPTG should be added when the OD600nmof culture reaches10~15,at the beginning of inducing the expression of object protein,the DO concentration was controlled under 80%;After inducing 20 min,the pH ofmedium was kept at around 7.0 by adding ammonia,the DO concentration was keptat20%~40%;The bacteria was collected after inducing 5 hours.The production of rhG-CSFwas higher after optimizing the fermentation conditions.ConclusionThe optimized fermentation conditions for rhG-CSF production in E.coli BL21(DE3)Plys provided import direction for its large scale preparation.
rhG-CSF;Fermentation;Dissolved oxygen;Genetic engineered stains
Q812
:A
2095-5375(2014)07-0428-003
王娟,女,研究方向:基因工程菌的发酵表达与工业化,E-mail:tuky2003@163.com
