速度向量成像技术评估妊娠高血压综合征胎儿心肌节段功能
2014-03-07龙湘党LONGXiangdang
龙湘党LONG Xiangdang
周启昌1ZHOU Qichang
姚 穗3YAO Sui
范雪梅1FAN Xuemei
赵 康2ZHAO Kang
曾 施1ZENG Shi
论著 Original Research
速度向量成像技术评估妊娠高血压综合征胎儿心肌节段功能
龙湘党1,2LONG Xiangdang
周启昌1ZHOU Qichang
姚 穗3YAO Sui
范雪梅1FAN Xuemei
赵 康2ZHAO Kang
曾 施1ZENG Shi
目的探讨速度向量成像技术检测妊娠高血压综合征(PIH)胎儿左、右心室心肌节段功能的临床意义。资料与方法采集81例PIH胎儿,包括妊娠高血压组(GH组)24例、轻度子痫前期组(MPE组)25例、重度子痫前期组(SPE组)32例,以及136例正常胎儿(对照组)的心脏四腔观超声心动图,测量左、右心室各节段收缩期峰值运动速度(Vs)、舒张期峰值运动速度(Vd)、峰值应变(S)、收缩期峰值应变率(SRs)和舒张期峰值应变率(SRd)。结果217例胎儿中成功采集图像192例。PIH各组左、右心室壁Vs和Vd均由基底段至心尖段逐渐减低(P<0.01),S、SRs和SRd在基底段、中间段和心尖段差异无统计学意义(P>0.05)。GH组左、右心室壁Vs、Vd、S、SRs和SRd与对照组相应节段心肌比较,差异无统计学意义(P>0.05);MPE组右心室壁S、SRs和SRd较对照组降低(P<0.05);SPE组左、右心室壁S、SRs和SRd较对照组、GH组和MPE组均降低(P<0.05),右心室壁Vd较对照组及GH组降低(P<0.05)。结论速度向量成像技术可以检测PIH胎儿左、右心室心肌节段功能的变化,PIH对子痫前期胎儿左、右心室功能均有影响,以右心功能损害首先发生。
高血压,妊娠性;超声检查,产前;超声心动描记术,多普勒,彩色;速度向量成像;心室功能,左;心室功能,右
妊娠高血压综合征(pregnancy-induced hypertension, PIH)的基本病理改变是全身小动脉痉挛,导致胎盘功能下降、胎儿缺氧,引起胎儿心脏前后负荷改变和心肌缺氧,最终导致胎儿心功能减退。胎儿超声心动图已经广泛用于无创性地评价胎儿心脏解剖结构和功能[1],射血分数(ejection fraction, EF)和短轴缩短率(fraction shortening, FS)、E、A峰值速度比(rate of max velocity of E-wave and A-wave, E/A)及Tei指数分别反映了心脏的整体收缩和舒张功能,而只有当局部心肌功能下降到一定程度时才会引起心脏整体功能的改变,因此这些指标不能敏感地反映心肌功能的早期改变。速度向量成像(velocity vector imaging, VVI)技术应用斑点追踪成像技术实时追踪心肌运动,获得心肌运动的速度、应变和应变率等,可以定量评估心脏舒缩功能和局部心肌的运动,无角度依赖性,并克服了邻近心肌节段被动牵拉及心脏整体运动的影响,能更准确地评价心肌形变。本研究拟应用VVI技术检测PIH胎儿的左、右心室节段心肌功能,探讨PIH胎儿的心肌力学变化特点,评价PIH对胎儿心肌功能的影响,以更好地监测孕期母儿情况及评价治疗效果。
1 资料与方法
1.1 研究对象 选择2009-01~2011-07在中南大学湘雅二医院和湖南省人民医院住院的81例PIH孕妇,PIH的诊断和分类标准[2]:①妊娠高血压(gestational hypertension, GH)组:妊娠期首次出现血压≥140/90 mmHg,并于产后12周恢复正常,尿蛋白(-);②轻度子痫前期(mild preeclampsia, MPE)组:妊娠20周后出现血压≥140/90 mmHg,尿蛋白≥0.3 g/24 h或随机尿蛋白(+),可伴有上腹部不适、头痛等症状;③重度子痫前期(severe preeclampsia, SPE)组:血压≥160/110 mmHg,尿蛋白≥2.0 g/24 h或随机尿蛋白(++)以上,血清肌酐>106 µmol/L,血小板<100×109/L,血乳酸脱氢酶升高,血清丙氨酸转氨酶或天冬氨酸转氨酶升高,持续性头痛或其他脑神经或视觉障碍,持续性上腹部不适。排除子痫、妊娠合并慢性高血压及其他妊娠高危因素的孕妇,以及合并先天性心脏结构异常的胎儿。对照组136例孕妇,无糖尿病、高血压、心脏病及肝肾疾病史,实验室检查及常规超声检查均无异常。所有孕妇均有明确的停经史,20孕周前均经超声确认孕周大小。所有胎儿均为单胎妊娠,并经产科临床及超声检查无明显结构异常。本研究经医院伦理委员会审核同意,所有孕妇及家属均知情同意并签署知情同意书。各组孕妇及胎儿一般资料比较见表1。
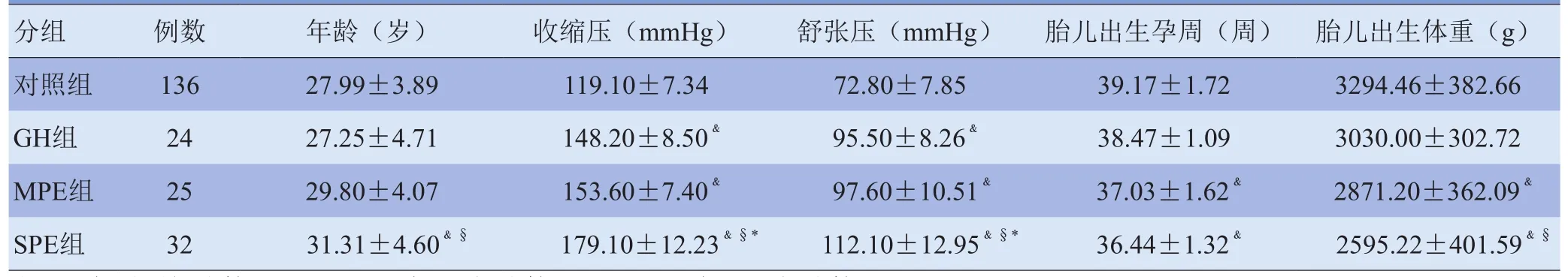
表1 各组孕妇及胎儿一般资料比较
1.2 仪器与方法 采用Siemens Acuson Sequoia 512彩色多普勒超声诊断仪,探头频率3.5~6.0 MHz,选用产科及胎儿心脏检查程序,帧频>50帧/s,功率<100 mW/cm2。常规行产科超声检查评价胎儿生长发育情况,估测胎儿体重。在胎儿脊柱长轴切面相当于心脏水平,探头旋转90°,于胎儿胸部横切面显示心脏标准四腔心切面,调整参数至图像大小合适,内膜显示清晰,采用局部放大功能,胎动较少时嘱孕妇屏气,启用自编速度向量成像设置(VVI),系统自动进行数字化声学采集3600 ms的动态二维图像并保存。
1.3 图像分析 应用VVI分析软件(Axius, Siemens Medical, Solutions USA, Inc.)进行脱机分析。首先根据解剖M型通过二、三尖瓣瓣环确定胎儿心动周期及心率,然后设参照物位于心尖,在一帧舒张末期并清晰显示心内膜的图像上沿心内膜顺时针手动描记,系统将自动追踪心动周期内的心室心内膜缘,得到心肌运动速度曲线、应变及应变率曲线。将胎儿标准四腔心室壁分为12节段,左心室6节段包括左心室侧壁和室间隔左心室面的基底段、中间段和心尖段,右心室6节段包括右心室游离壁和室间隔右心室面的基底段、中间段和心尖段。测量各节段收缩期峰值运动速度(Vs)、舒张期峰值运动速度(Vd)、峰值应变(S)、收缩期峰值应变率(SRs)和舒张期峰值应变率(SRd)。每个参数均测量3个心动周期,取平均值。
从纳入分析的动态图像中随机抽取20个进行重复性检验,由2名主治医师以上职称者分别检测上述VVI参数,进行检查者间的重复性检验。另外随机抽取20个动态图像,由同一名检查者间隔2周重复3次检测上述VVI参数,进行检查者内的重复性检验。
1.4 统计学方法 采用SPSS 17.0软件,计量资料多组间比较采用方差分析,配对资料比较采用配对t检验,不同检查者间和检查者内的一致性采用Bland-Atman法,P<0.05表示差异有统计学意义。
2 结果
2.1 各组胎儿常规超声参数比较 217例胎儿中成功采集到192例(88.5%)胎儿内膜清晰显示的心脏四腔心动态图像,8例因胎位、6例因胎动、11例因心内膜显示不清晰未完成数据采集。GH组成功采集21例,MPE组成功采集23例,SPE组成功采集28例,对照组成功采集120例。与对照组比较,PIH各组左、右心室壁厚度、二尖瓣、三尖瓣E/A及左、右心室EF、FS差异均无统计学意义(P>0.05)。见表2。
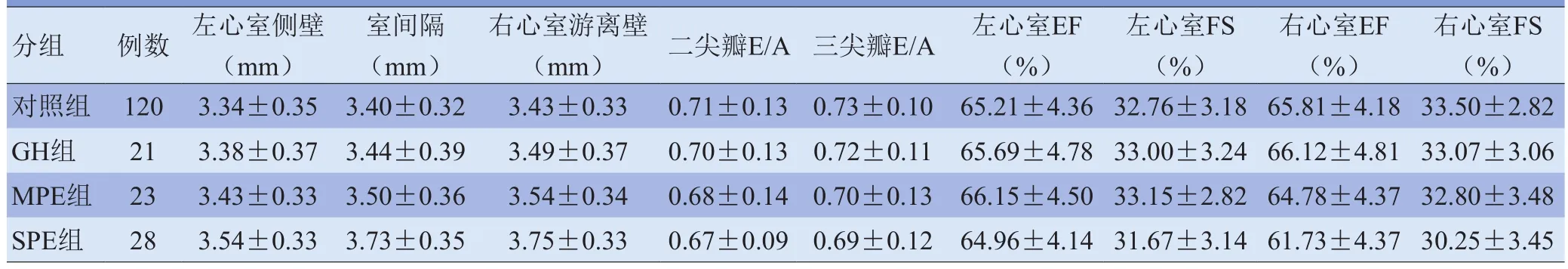
表2 各组常规超声参数比较
2.2 各组胎儿左心室VVI参数比较 各组胎儿左心室侧壁和室间隔左心室面Vs和Vd均由基底段至心尖段逐渐减低(F=1051.9、931.4, P<0.01);基底段、中间段和心尖段S、SRs和SRd差异无统计学意义(P>0.05)。GH组左心室侧壁和室间隔左心室面Vs、Vd、S、SRs、 SRd较对照组差异无统计学意义(P>0.05);MPE组Vs、Vd、S、SRs、SRd较对照组及GH组差异无统计学意义(P>0.05);SPE组S、SRs、SRd较对照组、GH组及MPE组均降低(P<0.05)。见表3及图1~3。
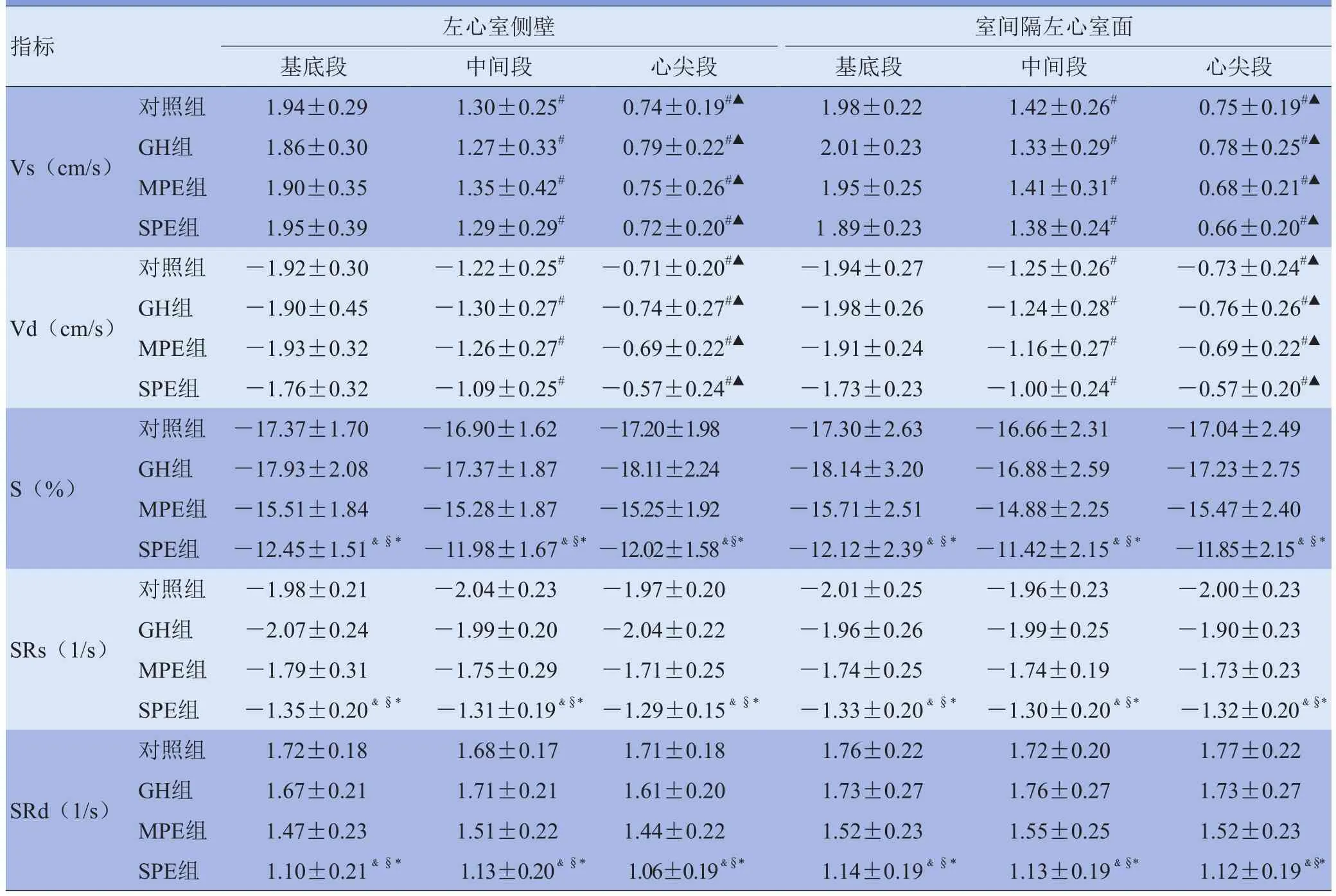
表3 左心室侧壁和室间隔左心室面速度、应变和应变率参数比较
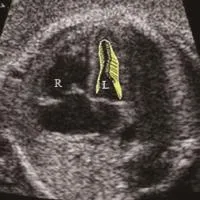
图1 孕38周,重度子痫前期。胎儿左心室收缩期向量图,向量长度代表心肌运动速度的大小,向量方向代表心肌运动的方向
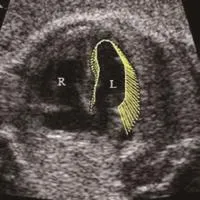
图2 孕38周,轻度子痫前期。胎儿左心室舒张期向量图,向量长度代表心肌运动速度的大小,向量方向代表心肌运动的方向
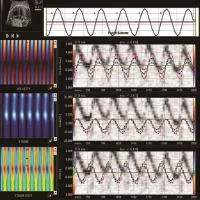
图3 孕38周,轻度子痫前期。胎儿左心室侧壁速度、应变及应变率曲线。红线、蓝线、绿线分别表示左心室侧壁基底段、中间段及心尖段的速度、应变及应变率曲线
2.3 各组胎儿右心室VVI参数比较 各组胎儿右心室游离壁和室间隔右心室面Vs和Vd均由基底段至心尖段逐渐减低(F=415.4、342.8, P<0.01);基底段、中间段和心尖段S、SRs和SRd差异无统计学意义(P>0.05)。GH组右心室游离壁和室间隔右心室面Vs、Vd、S、SRs和SRd较对照组差异无统计学意义(P>0.05);MPE组Vs、Vd较对照组及GH组差异无统计学意义(P>0.05),S、SRs和SRd较对照组降低(P<0.05);SPE组Vd较对照组及GH组降低(P<0.05),S、SRs和SRd较对照组、GH组及MPE组降低(P<0.05)。见表4及图4、5。
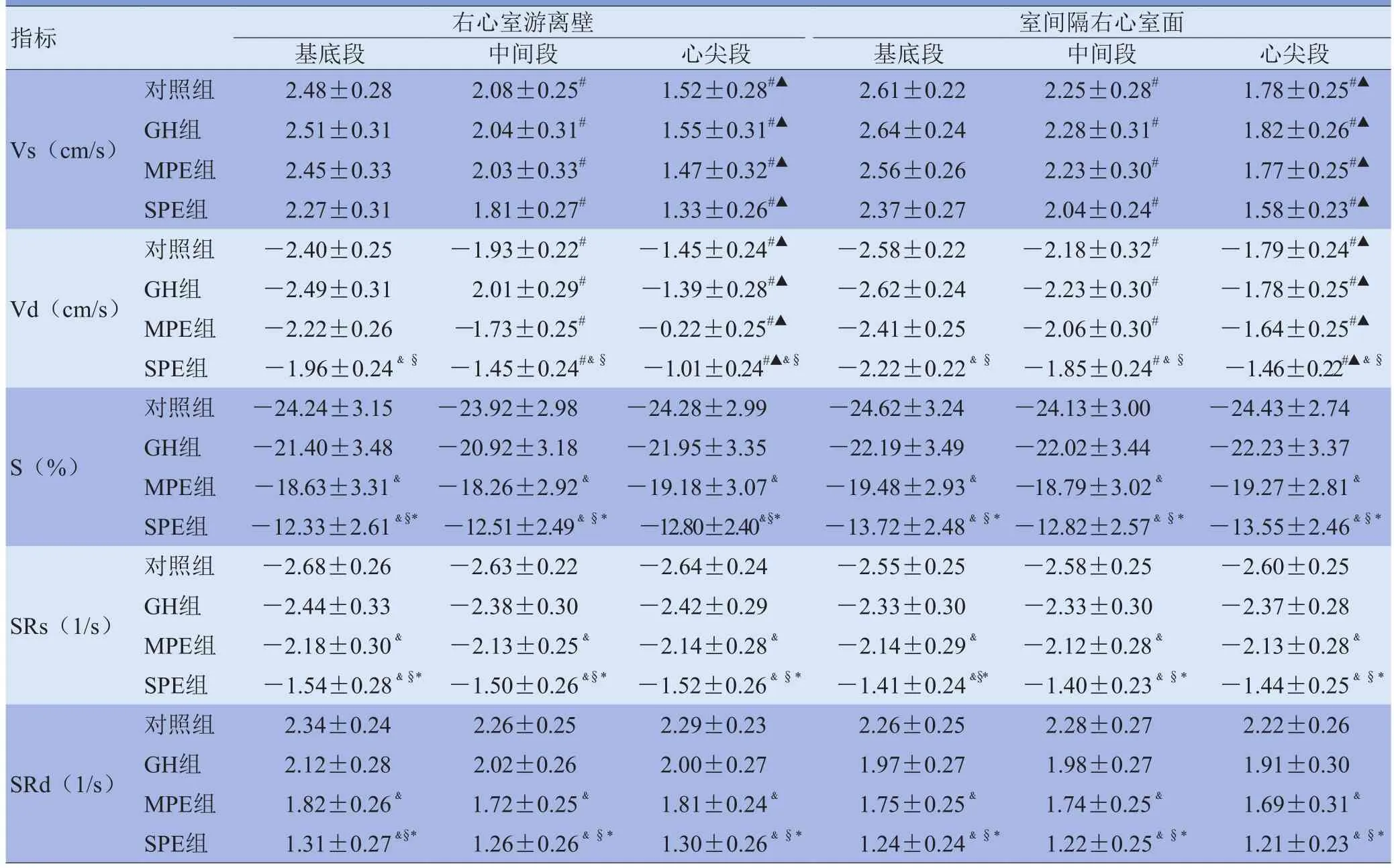
表4 右心室游离壁和室间隔右室面速度、应变和应变率参数比较
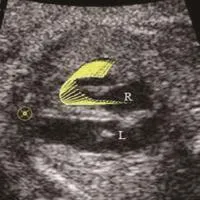
图4 孕38周,GH。胎儿右心室收缩期向量图,向量长度代表心肌运动速度的大小,向量方向代表心肌运动的方向
2.4 重复性检验结果 随机抽取的所有数据经2名不同检查者检测,检查者间的变异系数为7.2%~11.5%;随机抽取的所有数据经同一检查者间隔2周后重复检测,检查者内的变异系数为6.5%~10.8%。
3 讨论
VVI基于二维灰阶成像原理,利用超声象素的空间相干、斑点追踪技术实时追踪心肌的运动,从而获得心肌运动的速度、应变和应变率。与M型超声和组织多普勒不同,VVI不受超声声束角度的影响,同时克服了心脏整体运动和邻近心肌节段的被动牵拉对于室壁运动的影响,时间和空间分辨率很高,可以有效地判断室壁运动功能,是定量评估心脏整体舒缩功能和局部心肌运动的新方法。
VVI作为一种超声斑点成像的新技术,无角度依赖性、重复性好,理论上可以直观地显示心肌纤维纵向、径向和圆周方向上的运动速度和形变,这对于易受胎位影响的胎儿心肌功能检查尤为重要。随着超声仪器与探头技术的发展,胎儿心脏动态图像的帧频及分辨率不断提高,其关键步骤胎儿心内膜曲线描迹研究也不断提高,将极大地提高检查的成功率和重复性。本组217例胎儿心脏动态图像中共成功采集192例,成功分析率为88.5%,说明VVI技术分析胎儿心肌运动具有较高的可行性。部分研究已证实VVI技术可以用于评价胎儿心肌功能[3-5]。本研究结果发现,PIH胎儿左心室壁、右心室壁表现为Vs和Vd由基底段至心尖段逐渐减低,S、SRs和SRd在各节段间均无明显变化,与Younoszai等[3]报道的正常胎儿变化趋势一致。心脏不同节段运动的差异可能与心肌纤维的走行和心脏的整体移动有关[6]。此外,心肌运动速度与心脏的整体运动有关,在心脏收缩和舒张过程中心尖相对固定,长轴方向上心底运动大于心尖,致使速度由基底向心尖方向递减。应变及应变率在同一室壁各节段间无明显差异,说明心室壁的形变能力一致。
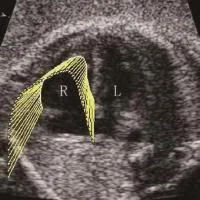
图5 孕38周,正常妊娠。胎儿右心室舒张期向量图,向量长度代表心肌运动速度的大小,向量方向代表心肌运动的方向
PIH的基本病变是全身小动脉痉挛,导致胎盘功能不全、胎儿缺氧。胎盘功能不全可以降低心肌细胞周期活性和终末分化率[7],延缓胎儿心肌细胞的成熟,导致心肌细胞数目减少,从而抑制心脏的生长发育[7]。胎儿缺氧时由于“脑保护效应”[8],使脑部血管扩张和血流量增加,上腔静脉回流入右心房的血液增加,且由于PIH患者胎盘阻力增加导致胎儿的右心前后负荷均增加,同时胎儿缺氧时可致心肌缺氧,心肌细胞凋亡率增加[9],心肌细胞的生物膜受损,细胞代偿性增生肥大,最终影响心脏的收缩和舒张功能,导致右心系统功能受损。本研究发现,MPE组胎儿右心室壁S和SRs、SRd较对照组降低,而SPE组胎儿右心室壁S和SRs、SRd较其他组均明显降低,提示子痫前期胎儿右心功能减退。既往研究[10,11]采用评价心室整体功能的Tei指数来评估PIH胎儿的心功能,结果发现PIH胎儿右心室Tei指数显著高于对照组,也反映了右心功能减退这一病理生理改变。本研究发现,SPE组胎儿左心室壁S和SRs、SRd较对照组、GH组及MPE组明显降低,提示SPE胎儿左心功能亦出现减退,这一结果不同于Api等[12]报道的SPE孕妇胎儿左心室Tei指数与MPE和对照组无显著差异,可能与样本量较小、研究对象存在选择偏倚有关。PIH胎盘小血管痉挛致胎盘功能不全时动脉循环再分配[13],心输出量向左心室分配,使得左心血量增加,左心前负荷增加,加上心肌缺氧最后可能导致左心功能受损。由于其后负荷不增加,左心衰竭远比右心衰竭少得多[14]。此外,由于胎儿特有的心血管解剖及生理特征,胎儿的右心系统在胎儿循环中占优势,因而胎儿缺氧时右心室心肌更易受到损害,心功能减退更明显。
本研究显示,PIH胎儿心肌Vd降低早于Vs,提示舒张功能受损早于收缩功能受损,可能与胎儿期心室舒张功能尚未发育完全、顺应性较低、病理状态下更易受损有关。本研究还发现应变及应变率参数减低早于速度参数,说明应变及应变率在评估PIH胎儿心肌力学改变方面较速度更敏感。
尽管VVI技术能进行斑点追踪,但二维图像是否清晰和心内膜是否清晰勾画会直接影响到分析结果。因此采集图像时应选择胎动较少时,孕妇尽量平静呼吸;在不影响空间分辨力的前提下,应尽量提高帧频,使VVI具有更高的时间分辨力来研究心肌功能[3];胎儿心脏运动较复杂,心脏在做径向、纵向、环向运动的同时,还沿自身长轴做旋转及扭转运动,本研究仅进行了长轴方向上的心肌力学研究,其他方向运动及各方向运动的对比有待进一步研究。
总之,VVI技术可以直接、精确地测量PIH胎儿的心肌力学参数,早期、有效地评价胎儿心肌局部和整体功能的变化,对于指导临床对PIH的诊治及监测、评估胎儿预后具有重要意义。随着图像时间分辨力、空间分辨力与心内膜描迹技术的提高与发展,VVI技术将成为定量评价胎儿心脏功能及其不同方位的复杂运动的有用工具。
[1] 张丽娜, 裴秋艳, 杨雪, 等. 彩色多普勒超声在非高危胎儿产前心脏筛查中的临床意义. 中国医学影像学杂志, 2011, 19(6): 461-464.
[2] 乐杰. 妇产科学. 第7版. 北京: 人民卫生出版社, 2008: 92-100.
[3] Younoszai AK, Saudek DE, Emery SP, et al. Evaluation of myocardial mechanics in the fetus by velocity vector imaging. J Am Soc Echocardiogr, 2008, 21(5): 470-474.
[4] Liu F, Liu S, Ma Z, et al. Assessment of left ventricular systolic function in fetuses without myocardial hypertrophy of gestational diabetes mellitus mothers using velocity vector imaging. J Obstet Gynaecol, 2012, 32(3): 252-256.
[5] Kim SH, Miyakoshi K, Kadohira I, et al. Comparison of the right and left ventricular performance during the fetal development using velocity vector imaging. Early Hum Dev, 2013, 89(9): 675-681.
[6] Kutty S, Deatsman SL, Nugent ML, et al. Assessment of regional right ventricular velocities, strain, and displacement in normal children using velocity vector imaging. Echocardiography, 2008, 25(3): 294-307.
[7] Louey S, Jonker SS, Giraud GD, et al. Placental insuffciency decreases cell cycle activity and terminal maturation in fetal sheep cardiomyocytes. J Physiol, 2007, 580(Pt. 2): 639-648.
[8] Rasanen J, Debbs RH, Huhta JC. Echocardiography in intrauterine growth restriction. Clin Obstet Gynecol, 1997, 40(4): 796-803.
[9] Bae S, Xiao YH, Li GH, et al. Effect of maternal chronic hypoxic exposure during gestation on apoptosis in fetal rat heart. Am J Physiol Heart Circ Physiol, 2003, 285(3): H983-H990.
[10] 储晨, 桂永浩, 任芸芸, 等. 妊娠高血压综合征孕妇的胎儿心功能评价. 中国循证儿科杂志, 2010, 5(3): 212-216.
[11] 陈莞春, 吴凤林, 段学蕴, 等. 妊娠晚期妊高征胎儿左、右心室Tei指数对比研究. 南方医科大学学报, 2010, 30(5): 1031-1033.
[12] Api O, Emeksiz MB, Api M, et al. Modified myocardial performance index for evaluation of fetal cardiac function in pre-eclampsia. Ultrasound Obstet Gynecol, 2009, 33(1): 51-57.
[13] Mäkikallio K, Vuolteenaho O, Jouppila P, et al. Ultrasonographic and biochemical markers of human fetal cardiac dysfunction in placental insufficiency. Circulation, 2002, 105(17): 2058-2063.
[14] 严英榴, 杨秀雄, 沈理. 产前超声诊断学. 第2版. 北京:人民卫生出版社, 2012: 478-479.
(责任编辑 张春辉)
Velocity Vector Imaging of the Fetus Regional Myocardial Function with Pregnancy-induced Hypertension
PurposeTo investigate the clinical value of velocity vector imaging in the assessment of regional left ventricular and right ventricular longitudinal myocardial function in fetuses with pregnancy-induced hypertension (PIH).Materials and MethodsDigital dynamic four-chamber views of 81 fetuses with PIH and 136 normal fetuses were collected and analyzed by using velocity vector imaging technique. Fetuses in PIH were divided into gestational hypertension (GH, n=24), mild preeclampsia (MPE, n=25) and severe preeclampsia (SPE, n=32). The regional tissue systolic peak velocity (Vs), diastolic peak velocity (Vd), peak strain (S), systolic peak strain rate (SRs) and diastolic peak strain rate (SRd) of interventricular septum, right free wall and left lateral wall were measured respectively.Results192 out of 217 cases were collected successfully. Both Vs and Vd gradually decreased from the basal segment to the apical segment in the left ventricle (LV) and right ventricle (RV) (P<0.01), whereas S, SRs and SRd were stable among all segments in each group (differences without statistic significance, P>0.05). Vs, Vd, S, SRs and SRd in LV and RV in GH did not change signifcantly compared with those in normal fetuses (differences without statistic signifcance, P>0.05). S, SRs and SRd in RV were signifcantly lower in MPE than those in normal fetuses (P<0.05). S, SRs and SRd in LV and RV were signifcantly lower in SPE than those in normal fetuses, GH and MPE (P<0.05), and Vd in RV was signifcantly lower in SPE than that in normal fetuses and GH (P<0.05).ConclusionThe fetal regional left ventricular and right ventricular longitudinal myocardial function could be evaluated with velocity vector imaging. Both left ventricular function and right ventricular function would be impaired in fetuses with preeclampsia, yet the deterioration of right ventricular function was earlier than that of LV.
Hypertension, pregnancy-induced; Ultrasonography, prenatal; Echocardiography, Doppler, color; Velocity vector imaging; Ventricular function, left; Ventricular function, right
1. 中南大学湘雅二医院超声科 湖南长沙410011
2. 湖南省人民医院超声科 湖南长沙410005
3. 湖南省人民医院产科 湖南长沙 410005
周启昌
Department of Ultrasound, the Second Xiangya Hospital of Central South University, Changsha 410011, China
Address Correspondence to: ZHOU Qichang
E-mail: hnzqc2013@163.com
国家自然科学基金项目(30970838);湖南省科技厅科技计划项目(2012SK3244)。
R714.252;R445.1
2013-08-27
:2014-01-12
中国医学影像学杂志
2014年 第22卷 第2期:81-86
Chinese Journal of Medical Imaging
2014 Volume 22(2): 81-86
10.3969/j.issn.1005-5185.2014.02.001
