miR-196b慢病毒表达载体的构建和功能鉴定
2014-03-05宋艳斌马文丽
刘 玥,帅 春,尹 虹,宋艳斌*,马文丽*
(1.南方医科大学基因工程研究所,广东广州510515;2.广东省妇幼保健院新生儿科越秀院区,广东广州 510000)
miRNA可通过与靶mRNA特异性碱基互补配对,引起靶mRNA降解或者抑制翻译,进而对基因进行转录后表达调控[1]。miR-196b位于7号染色体短臂(7p15.2),其高表达和许多肿瘤的发生密切相关,如口腔癌[2]、胃癌[3]和鼻咽癌[4]等,也可作为胰腺上皮内瘤变的诊断标志物[5],并可判断成胶质细胞瘤和间变性星形细胞瘤患者的预后[6]。miR-196b和白血病的关系也很密切,其在混合系白血病(Mixed Lineage Leukemia,MLL)[7]、B 细胞急性淋巴细胞白血病(Acute Lymphoblastic Leukemia,ALL)[8]患者中低表达,在 T 细胞 ALL 患者[9]、儿童ALL患者中[10]高表达。miR-196b可调节造血功能,并随时间推移表达逐渐下降[11]。miR-196b在慢性粒细胞白血病(Chronic Myeloid Leukemia,CML)中的研究很少,因此本研究通过构建miR-196过表达载体,并在K562细胞内进行验证,为研究其对慢粒发生发展的调控奠定基础。
1 材料与方法
1.1 材料
人骨髓样本(南方医科大学附属南方医院提供),与受试者签署知情同意书并获得南方医院伦理委员会批准书;质粒 plVTHM、psPAX2、pMD2.G(南方医科大学公共卫生与热带医学学院张宝副教授惠赠);K562细胞(广东省人民医院中心实验室提供);293T细胞(南方医科大学肿瘤研究所提供);大肠杆菌 DH5α(Escherichia coli,E.coli)由本室保存。
Ficoll淋巴细胞分离液(GE公司);QIAamp®DNA Mini and Blood Mini Kit和QIAGEN Plasmid Midi Kit(Qiagen公司);EX Taq DNA聚合酶和SYBR Premix Ex TaqⅡ(大连宝生物工程公司);限制性内切酶和 T4 DNA连接酶(New England Biolabs公司);Wizard® SV琼脂糖胶和PCR产物纯化系统(Promega公司);胎牛血清(Gibco公司);转染试剂Lipofectamine 2000(Invitrogen公司);Hairpin-itTMmicroRNA qPCR Quantitation Kit(上海吉玛公司);引物合成及测序由Invitrogen(广州)公司完成;Cell Counting Kit(CCK-8)(DOJINDO公司)。
1.2 方法
1.2.1 构建慢病毒表达载体plVTHM-miR-196b:查询miRBase数据库获得miR-196b前体pre-miR-196b序列为:5'-ACUGGUCGGUGAUUUAGGUAGUU UCCUGUUGUUGGGAUCCACCUUUCUCUCGACAGC ACGACACUGCCUUCAUUACUUCAGUUG-3',在其上下游各添加100 bp的侧翼序列,采用Primer5.0设计引物。上游引物P1序列为:端引入ClaⅠ和MluⅠ的酶切位点,下划线部分为酶切位点。采用Ficoll法分离正常人骨髓细胞,提取基因组DNA作为模板,扩增pre-miR-196b,反应条件为:94 ℃,3 min;94 ℃,30 s,50 ℃,30 s,72 ℃,30 s共30循环;72℃,7 min。PCR产物切胶回收后和载体plVTHM分别用ClaⅠ和MluⅠ进行双酶切,酶切片段连接后转化大肠杆菌DH5α感受态细胞,在Amp抗性筛选平板上挑取单菌落扩大培养,提取质粒,对质粒进行酶切鉴定并测序。
1.2.2 包装慢病毒颗粒:接种293T细胞到10 cm培养皿中,采用 Lipofectamine 2000,共转染 20 μg plVTHM-miR-196b、15 μg psPAX2 和 6 g pMD2.G。转染48 h后,4℃,1 000×g离心10 min取病毒上清,并用0.45 μm滤器过滤,分装至1.5 mL离心管,-80℃保存病毒液。
1.2.3 病毒滴度测定:接种K562细胞到96孔板中,加入不同浓度的病毒液进行感染。设5个病毒浓度梯度组,每组加入不同量病毒液,分别为40、80、160、320 和 640 μL,设 2 个对照组,1 组加入终浓度5 mg/L的polybrene,1组为阴性对照。培养72 h后,用倒置显微镜观察并纪录每个浓度梯度中绿色荧光蛋白阳性的细胞数。根据病毒上清液体积、稀释倍数、绿色荧光蛋白阳性细胞数,计算出病毒上清液的滴度:滴度={(%绿色荧光蛋白阳性细胞数〕×(第2天细胞数/mL)}/病毒量(mL)。每组设3个复孔,结果取平均值。
1.2.4 感染并分选绿色荧光蛋白阳性细胞:接种K562细胞到6孔板中,加入病毒液感染。24 h后,移去病毒上清稀释液,继续培养72 h后,收集感染的细胞,用流式细胞仪分选绿色荧光蛋白阳性细胞,扩大培养。
1.2.5 荧光定量PCR检测细胞内miR-196b的表达:采用Hairpin-itTMmicroRNA qPCR Quantitation Kit检测miR-196b的表达,Q-miR-196b上下游引物混合物P3为:5'-GCAGCACGCTAGGTAGTTTCCTATCG TTGTTCTCCACTCCTTGAC-3',内参 Q-U6上下游引物混合物P4为:5'-ATTGGAACGATACAGAGAAGA TTGGAACGCTTCACGAATTTG-3',PCR反应条件为:95 ℃,3 min;95 ℃,12 s,62 ℃,40 s,共40 循环。
1.2.6 细胞增殖检测:采用CCK-8细胞增殖及细胞毒性检测试剂盒检测细胞的增殖水平,在96孔板接种K562细胞、plv空病毒细胞、过表达miR-196b细胞,每孔加入10 μL CCK-8溶液,在细胞培养箱内继续孵育4 h后,在450 nm测定吸光度。每个样品设3个复孔,实验重复3次。
2 结果
2.1 慢病毒表达载体plVTHM-miR-196b的构建及鉴定
pre-miR-196b的PCR扩增产物大小预计为284 bp(图1),结果与预期一致。提取的质粒酶切鉴定正确后(图2),进行测序。选择测序正确的重组质粒进行下一步实验,操作结果如下:
2.2 包装病毒,滴度测定,分选绿色荧光蛋白阳性细胞
由plVTHM-miR-196b包装的病毒命名为196b病毒,由plVTHM包装的病毒命名为plv病毒。病毒滴度测定为6×106TU/mL。不同浓度病毒液感染K562细胞的效率不同(图3),最后选择用160 μL病毒液/1 mL培养基感染细胞。感染后的细胞用流式细胞仪分选绿色荧光蛋白阳性细胞,并扩大培养,把196b病毒感染的细胞命名为过表达miR-196b细胞,把plv病毒感染的细胞命名为plv空病毒细胞。

图1 pre-miR-196b的扩增序列Fig 1 Pre-miR-196b amplification products

图2 plVTHM-miR-196b酶切结果Fig 2 plVTHM-miR-196b digestion results
2.3 荧光定量PCR检测细胞内miR-196b的表达水平
plv空病毒细胞和K562细胞中miR-196b的表达水平很低且基本一致,miR-196b细胞中miR-196b的表达水平明显高于其他两组(P<0.05)(图4)。
2.4 细胞增殖检测
K562细胞增殖 >plv空病毒细胞 >过表达miR-196b细胞(表1,图5),过表达 miR-196b细胞的增殖显著慢于K562细胞和plv细胞(P<0.05)。
3 讨论
对于悬浮细胞K562来说,可采用普通分化细胞常用的转染方法,如脂质体转染后抗生素筛选,但该方法时间长、效率低;也可使用电穿孔的方法,虽然效率高但对细胞损伤比较大。慢病毒载体系统具有对细胞毒性小、转染效率高、可长期稳定表达等特点,因此我们选择慢病毒载体系统,成功构建了miR-196b慢病毒表达载体,并进行病毒包装和细胞感染,对感染的细胞检测了miR-196b的表达水平,结果表明miR-196b在慢粒细胞K562中成功稳定表达。

图3 不同浓度病毒感染K562结果Fig 3 Different concentrations of virus infection of K562(×10)
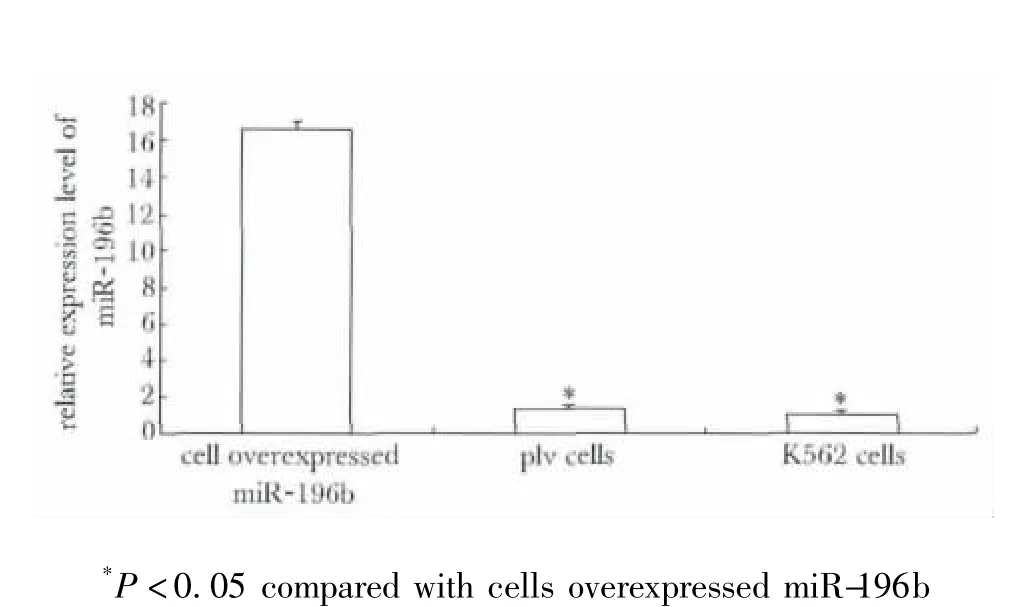
图4 不同细胞中miR-196b的表达水平Fig 4 miR-196b expression levels in different cells
表1 CCK-8法检测不同细胞增殖的结果Table 1 The detection of different cells proliferation by CCK-8(±s,n=3)
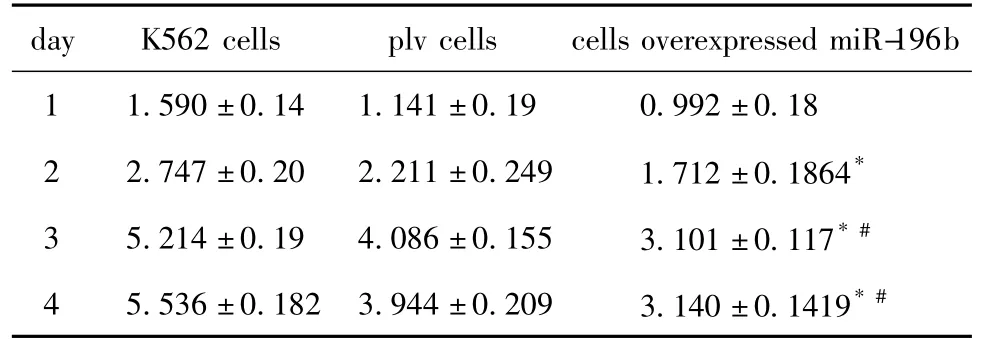
表1 CCK-8法检测不同细胞增殖的结果Table 1 The detection of different cells proliferation by CCK-8(±s,n=3)
*P <0.05 compared with K562;#P<0.05 compared with plv.
day K562 cells plv cells cells overexpressed miR-196b 1 1.590±0.14 1.141±0.19 0.992±0.18 2 2.747±0.20 2.211±0.249 1.712±0.1864*3 5.214±0.19 4.086±0.155 3.101±0.117*#4 5.536±0.182 3.944±0.209 3.140±0.1419*#
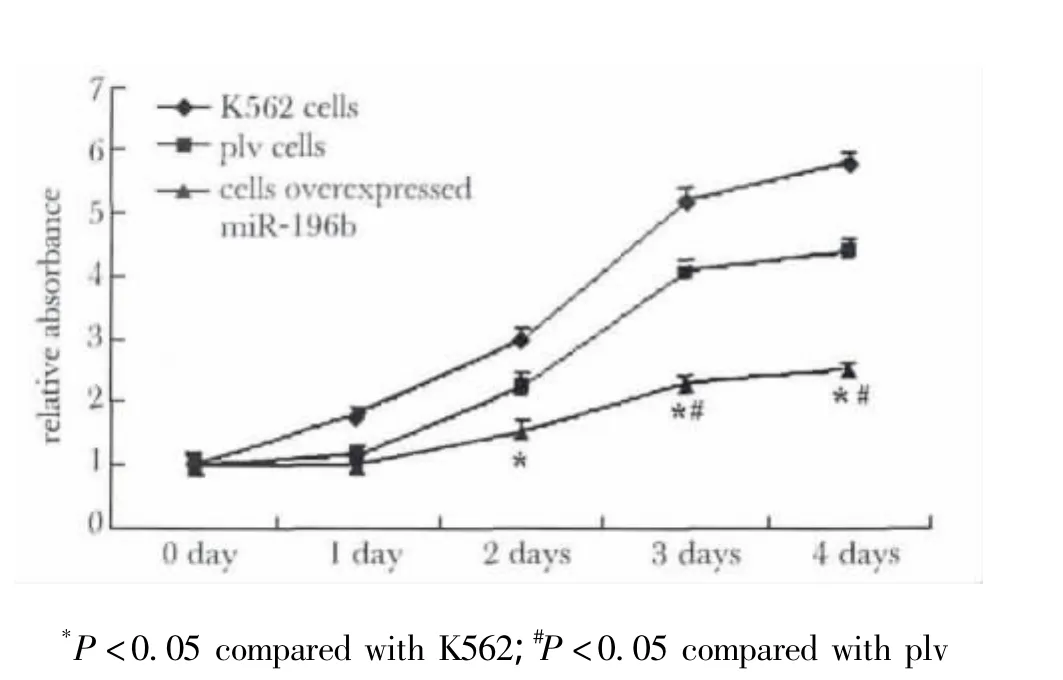
图5 CCK-8法检测不同细胞的增殖结果Fig 5 The detection of different cells proliferation by CCK-8
我们又进一步检测了不同细胞的增殖情况,结果表明K562细胞稳定过表达miR-196b后,增殖水平显著下降,提示miR-196b有抑制K562细胞增殖的作用。miR-196b的其他研究表明,miR-196b在不同的肿瘤细胞中对细胞增殖的作用不同。Suman Bhatia等[8]的研究表明在B细胞急性淋巴细胞白血病细胞EB-3中miR-196b有抑制细胞增殖、促进凋亡的作用;How C等[12]研究表明,在子宫颈癌细胞中过表达miR-196b可以抑制肿瘤细胞的增殖、集落生成,迁移和侵袭;有研究表明[13],miR-196b可以抑制异位内膜间质细胞的增殖、促进凋亡。还有研究表明[14]在胃癌细胞中 miR-196b有促进细胞增殖、提高生存率的作用;研究表明[15]miR-196b可以促进成胶质细胞瘤的增殖,并导致不良预后。因此各细胞系中miR-196b对增殖的作用并不相同,miR-196b在K562中的抑制增殖作用还需进一步研究。
总之,上述结果为今后研究miR-196b在慢粒中的作用机制和功能提供了依据。
[1] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281 -297.
[2]Lu YC,Chen YJ,Wang HM,et al.Oncogenic function and early detection potential of miRNA-10b in oral cancer as identified by microRNA profiling[J].Cancer Prev Res(Phila),2012,5:665 -674.
[3]Liao YL,Hu LY,Tsai KW,et al.Transcriptional regulation of miR-196b by ETS2 in gastric cancer cells[J].Carcinogenesis,2012,33:760 -769.
[4]Ozsait B,Komurcu-Bayrak E,Levula M,et al.Niemann-Pick type C fibroblasts have a distinct microRNA profile related to lipid metabolism and certain cellular components[J].Biochem Biophys Res Commun,2010,403:316-321.
[5]Yu J,Li A,Hong SM,et al.MicroRNA alterations of pancreatic intraepithelial neoplasias[J].Clin Cancer Res,2012,18:981 -992.
[6]Guan Y,Mizoguchi M,Yoshimoto K,et al.MiRNA-196 is upregulated in glioblastoma but not in anaplastic astrocytoma and has prognostic significance[J].Clin Cancer Res,2010,16:4289 -4297.
[7]Li Z,Huang H,Chen P,et al.miR-196b directly targets both HOXA9/MEIS1 oncogenes and FAS tumour suppressor in MLL-rearranged leukaemia[J].Nat Commun,2012,doi:10.1038/ncomms1681.
[8]Bhatia S,Kaul D,Varma N.Potential tumor suppressive function of miR-196b in B-cell lineage acute lymphoblastic leukemia[J].Mol Cell Biochem,2010,340:97 -106.
[9]Schotte D,Chau JC,Sylvester G,et al.Identification of new microRNA genes and aberrant microRNA profiles in childhood acute lymphoblastic leukemia[J].Leukemia,2009,23:313 -322.
[10]de Oliveira JC,Scrideli CA,Brassesco MS,et al.Differential miRNA expression in childhood acute lymphoblastic leukemia and association with clinical and biological features[J].Leuk Res,2012,36:293 -298.
[11]Coskun E,von der Heide EK,Schlee C,et al.The role of microRNA-196a and microRNA-196b as ERG regulators in acute myeloid leukemia and acute T-lymphoblastic leukemia[J].Leuk Res,2011,35:208 -213.
[12]How C,Hui AB,Alajez NM,et al.MicroRNA-196b regulates the homeobox B7-vascular endothelial growth factor axis in cervical cancer[J].PLoS One,2013,8:e67846,doi:10.1371/journal.pone.0067846.
[13]Abe W,Nasu K,Nakada C,et al.miR-196b targets cmyc and Bcl-2 expression,inhibits proliferation and induces apoptosis in endometriotic stromal cells[J].Hum Reprod.2013,28:750 -761.
[14]Tsai KW,Hu LY,Wu CW,et al.Epigenetic regulation of miR-196b expression in gastric cancer[J].Genes Chromosomes Cancer,2010,49:969 -980.
[15]Ma R,Yan W,Zhang G,et al.Upregulation of miR-196b confers a poor prognosis in glioblastoma patients via inducing a proliferative phenotype[J].PLoS One,2012,7:e38096,doi:10.1371/journal.pone.0038096.
