肥胖对初诊2型糖尿病患者血清β抑制素2及胰岛素抵抗的影响
2014-02-28潘佳秋郭晓闻于学静杨玉芝杨玉红谭丽艳
潘佳秋,王 萌,郭晓闻,于学静,杨玉芝,张 超,杨玉红,谭丽艳
β抑制素 (β-arrestin)主要通过网格蛋白介导及MAP激酶途径激活G蛋白耦联受体,实现对机体内细胞信号转导的调节[1]。目前的研究已经证实,β抑制素作为桥接因子或适配体参与了人类抑郁症、多发性硬化症、支气管哮喘、2型糖尿病 (T2DM)等疾病发生、发展的分子机制[2]。本研究通过观察新诊断T2DM患者中肥胖者血清β抑制素2水平的变化,初步探讨肥胖对β抑制素2及胰岛素抵抗的影响。
1 资料与方法
1.1 一般资料 选取2012年6—12月在本院内分泌科就诊的新诊断T2DM肥胖患者30例 (T2DM肥胖组,BMI≥28 kg/m2)和新诊断T2DM非肥胖患者30例(T2DM非肥胖组,BMI<24 kg/m2),均符合1999年世界卫生组织糖尿病诊断标准。病程均<1年,平均2.0个月;入组前患者未使用任何降糖、降脂药物治疗。另选取同期在本院体检的30例健康者为对照组。3组受检者均无心、肝、肾、恶性肿瘤病史及激素药物使用史。
T2DM肥胖组中,男16例,女14例;平均年龄(40.6±8.9)岁。T2DM非肥胖组中,男15例,女15例;平均年龄 (41.6±10.4)岁。对照组中,男16例,女14例;平均年龄 (43.0±10.8)岁。3组受检者的性别构成及年龄间具有均衡性。
1.2 方法
1.2.1 临床资料收集 所有受检者禁食10 h后于次日清晨空腹采集肘静脉血5 ml,离心分离血清,测定血糖、血脂、肝功能、肾功能、胰岛素等生化指标;另取一份血离心后存入-80℃冰箱,用于血清β抑制素2的测定。同时测量身高、体质量,计算BMI。
1.2.2 观察指标及检测方法 空腹血糖 (FPG)、三酰甘油 (TG)、总胆固醇 (TC)采用酶法,在日本OLYMPUS公司AU-2700全自动生化分析仪上检测;糖化血红蛋白 (HbA1c)采用高压液相色谱法检测;空腹胰岛素 (FINS)采用德国罗氏全自动电化学发光检测仪检测〔试剂盒购于德国罗氏公司,批内变异系数(CV)<2.0%,批间CV<2.5%〕;空腹血清β抑制素2采用ELISA法检测 (试剂盒为美国R&D公司生产,由上海江莱生物科技有限公司提供,批内CV<9%,批间CV<15%)。按照HOMA公式计算胰岛素抵抗指数(HOMA-IR)和胰岛β细胞功能指数 (HOMA-β):HOMA-IR=FPG×FINS/22.5,HOMA-β=FINS×20/(FPG-3.5);胰岛素敏感性指数 (ISI)采用定量胰岛素敏感性检测指数 (QUICKI),公式为 ISI=1/〔log(Io)+log(Go)〕,Io为 FPG,Go为 FINS。公式中FPG单位为mmol/L,FINS单位为mU/L。
1.3 统计学方法 采用SPSS 19.0软件进行统计检验。正态分布的计量资料以 ()表示;非正态分布的计量资料经自然对数转换后进行统计学检验。多组间均数比较采用方差分析,组间两两比较采用LSD-t检验。BMI、β抑制素2与其他指标的相关性采用Spearman相关分析。检验水准α=0.05。
2 结果
2.1 3组受检者临床指标比较 3组受检者BMI、FPG、TG、TC、HbA1c、FINS、β抑制素2水平及HOMA-IR、HOMA-β、ISI比较,差异均有统计学意义 (P<0.05);其中,T2DM肥胖组患者BMI、TC水平均高于其他两组,T2DM非肥胖组、T2DM肥胖组HOMA-β均低于对照组,差异有统计学意义 (P<0.05);对照组、T2DM非肥胖组、T2DM肥胖组FPG、TG、HbA1c、FINS水平及HOMA-IR依次升高,β抑制素2水平及ISI依次降低,组间两两比较差异有统计学意义 (P<0.05,见表1)。
2.2 相关分析 Spearman相关分析显示:BMI与HOMA-IR呈正相关,与ISI呈负相关 (P<0.01);β抑制素2与BMI、HOMA-IR呈负相关,与ISI呈正相关(P<0.01,见表2)。
3 讨论
胰岛素抵抗是指生理水平的胰岛素无法产生正常生物学效应的一种状态,即组织细胞对胰岛素的敏感性降低。肥胖者常伴随着高胰岛素血症,是导致胰岛素抵抗的重要因素[3-5]。人体肥胖的发生是遗传基因、饮食生活习惯、代谢紊乱及神经系统调节等因素共同作用的结果。尤其与能量供需失衡及内分泌功能失调密切相关。当机体能量的摄入多于消耗的所需,即形成热量过剩;过剩的能量便以脂肪形式储存于体内,导致脂肪细胞增生及体积肥大,形成肥胖[6-7]。现在认为,脂肪组织是一个活跃的内分泌器官,可以分泌多种激素和细胞因子参与胰岛素抵抗的发生及发展[8-10]。随着过度能量摄入的不断进展,脂肪组织无法通过有效的增生以产生新的脂肪细胞来扩大其容量,便会导致脂肪细胞肥大及过量的脂肪储存于肝脏、心肌、骨骼肌、胰腺等组织细胞中,表现为脂肪的异位沉积[11]。过度肥大的脂肪细胞能够产生大量的胰岛素抵抗相关细胞因子,如肿瘤坏死因子α(TNF-α)、白介素6(IL-6)等,而且异位脂肪会干扰组织细胞的正常分子传导,进一步加剧胰岛素抵抗[12]。
表1 3组受检者临床指标比较 ()Table 1 Comparison of clinical data in three groups
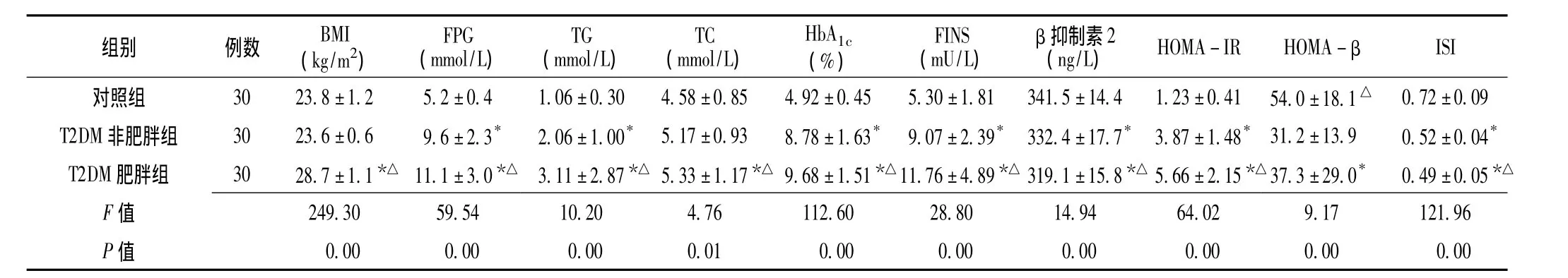
表1 3组受检者临床指标比较 ()Table 1 Comparison of clinical data in three groups
注:FPG=空腹血糖,TG=三酰甘油,TC=总胆固醇,HbA1c=糖化血红蛋白,FINS=空腹胰岛素,HOMA-IR=胰岛素抵抗指数,HOMA-β=胰岛β细胞功能指数,ISI=胰岛素敏感性指数;与对照组比较,*P<0.05;与T2DM非肥胖组比较,△P<0.05
ISI组别 例数 BMI(kg/m2)FPG(mmol/L)TG(mmol/L)TC(mmol/L)HbA1c(%)FINS(mU/L)β抑制素2(ng/L) HOMA-IR HOMA-β 0.72±0.09 T2DM非肥胖组 30 23.6±0.6 9.6±2.3* 2.06±1.00* 5.17±0.93 8.78±1.63* 9.07±2.39* 332.4±17.7* 3.87±1.48* 31.2±13.9 0.52±0.04*T2DM 肥胖组 30 28.7±1.1*△ 11.1±3.0*△ 3.11±2.87*△ 5.33±1.17*△ 9.68±1.51*△11.76±4.89*△ 319.1±15.8*△ 5.66±2.15*△37.3±29.0* 0.49±0.05*△F对照组 30 23.8±1.2 5.2±0.4 1.06±0.30 4.58±0.85 4.92±0.45 5.30±1.81 341.5±14.4 1.23±0.41 54.0±18.1△02 9.17 121.96 P值 0.00 0.00 0.00 0.01 0.00 0.00 0.00 0.00 0.00 0.00值249.30 59.54 10.20 4.76 112.60 28.80 14.94 64.

表2 T2DM肥胖组患者BMI、β抑制素2与其他因素的Spearman相关分析结果Table 2 Spearman's correlation analysis between BMI and β -arrestin 2 with other indicators in obese group
β抑制素在多种组织细胞中均有表达,不仅可以作用于细胞膜上的受体开启信号通路参与某些疾病的发生,而且在细胞质内发挥着核转录信使的功能,可促进目标基因的转录。已有研究证实,β抑制素至少通过两种方式调节转录[13],一方面,其本身由细胞质转运到细胞核内与靶基因启动子构建复合体,从而直接调节转录;此外,能够与细胞质中的转录调节因子结合,通过改变其活性和在各亚细胞单位的分布,完成对核内转录的间接调节。动物实验结果显示:在糖尿病小鼠模型中β抑制素2水平严重下调,并与胰岛素抵抗程度呈负相关,是胰岛素抵抗的独立影响因素[14]。
本研究结果显示,无论是肥胖还是非肥胖的T2DM患者,其血清β抑制素2水平均低于健康者,而且肥胖的T2DM患者血清β抑制素2水平还低于非肥胖的T2DM患者。说明β抑制素2的下降可能与肥胖有关。通过对T2DM肥胖组各因素进行Spearman相关分析,发现BMI、β抑制素2不仅与胰岛素抵抗相关,而且彼此间同样表现出明显的负相关。T2DM患者的主要病理因素为胰岛素抵抗,并且与肥胖有关[3],这种作用可能体现在脂肪组织分泌的各种胰岛素抵抗相关因子下调β抑制素2基因的表达上,但确切的机制尚待研究。本研究发现T2DM患者β抑制素2水平与肥胖有关,为探索与脂肪相关的胰岛素抵抗因素对β抑制素2作用的分子机制及寻求减轻胰岛素抵抗的有效方法提供了一定的理论线索。
1 DeWire SM,Ahn S,Lefkowitz RJ,et al.β -arrestins and cell signaling[J].Annual Review of Physiology,2007,69(2):483 -510.
2 刘毅,向旭东.β-抑制蛋白及其研究进展[J/CD].中华哮喘杂志:电子版,2011,5(3):208-212.
3 黄艳,赵亚萍,王加林.肥胖相关胰岛素抵抗分子机制的研究进展 [J].东南国防医药,2010,12(6):526-529.
4 杨少玲,朱旅云,胡丽叶,等.肥胖类型与2型糖尿病关系的研究 [J].疑难病杂志,2010,9(3):191.
5 胡红蕾,孙中华,从相国.肥胖与非肥胖糖尿病患者下肢血管病变相关影响因素研究[J].中国全科医学,2013,16(5):1784-1788.
6 邓晋芳,方蕾,郭晓东.肥胖发病机制及其治疗靶点 [J].现代生物医学进展,2013,13(10):1997-2000.
7 杨海瑛.脂肪肝与肥胖指数的关系研究[J].实用心脑肺血管病杂志,2011,19(2):304.
8 臧丽,母义明.胰岛素抵抗机制的新认识[J].国际内分泌代谢杂志,2009,29(3):150-153.
9 马世瞻,张爱华,孙文秀,等.饮食和运动治疗对2型糖尿病患者血清抵抗素水平的影响及其与肥胖相关性分析[J].疑难病杂志,2011,10(3):209.
10 郑青,黄娇珍,李国栋,等.单纯性肥胖成人血浆纤维蛋白原与胰岛素抵抗的相关性研究[J].中国全科医学,2013,16(11):3679-3682.
11 邱靖雅,傅晓英,赵红莉.异位脂肪与胰岛素抵抗[J].新医学,2013,44(2):79-81.
12 Morino K,Petersen KF,Shulman GI.Molecular mechanisms of insulin resistance in humans and their potential links with mitochondrial dysfunction [J].Diabetes,2006,55(Suppl 2):S9-S15.
13 Lan Ma,Gang Pei.β - arrestin signaling and regulation of transcription[J].Journal of Cell Science,2007,120:213-218.
14 Luan B,Zhao J,Wu H,et al.Deficiency of a beta-arrestin-2 signal complex contributes to insulin resistance [J].Nature,2009,457(7233):1146-1149.
