AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离
2014-02-27骆党委黄雅燕肖美添
骆党委,叶 静,黄雅燕,肖美添*
(华侨大学化工学院,福建 厦门 361021)
AB-8大孔吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离
骆党委,叶 静,黄雅燕,肖美添*
(华侨大学化工学院,福建 厦门 361021)
目的:研究AB-8大孔吸附树脂精制芦柑皮总黄酮的工艺条件及芦柑皮黄酮类化合物的分离纯化。方法:采用AB-8大孔吸 附树脂动态法精制芦柑皮总黄酮,考察上样液总黄酮质量浓度、pH值、上样流速、洗脱液乙醇体积分数对吸附解吸性能的影响;然后将精制的芦柑皮总黄酮经硅胶柱层析、半制备高效液相等技术进行分离纯化,并根据理化性质和波谱数据鉴定化学结构。结果:AB-8大孔树脂精制芦柑皮总黄酮的最佳工艺条件为上样液总黄酮质量浓度3.03 mg/mL、上样液pH 3.0、上样流速3.0 BV/h、洗脱液乙醇体积分数为90%,最优条件下可使芦柑皮总黄酮的纯度从17.8%提高到63.1%;此外,从精制的芦柑皮黄酮中分离到8 个黄酮类化合物,分别鉴定为:橘皮素、川陈皮素、4’,5,7,8-四甲氧基黄酮、5-去甲基-橘皮素、橙黄酮、橙浸膏、柚皮苷、橙皮苷。结论:AB-8大孔树脂能很好地富集纯化芦柑皮总黄酮,该法简单、可行;从精制的芦柑皮黄酮中分离到8 个黄酮类化合物,其 中,4’,5,7,8-四甲氧基黄酮、5-去甲基-橘皮素、橙浸膏、柚皮苷、橙皮苷首次从芦柑皮中分得。
芦柑皮;总黄酮;AB-8大孔吸附树脂
芦柑(Citrus reticulata Blanco cv. Ponkan)属芸香科柑橘属植物,果肉可食且营养价值高,而芦柑皮绝大部分却被弃掉,造成资源浪费及环境的污染。芦柑皮除水分外,还含有丰富的香精油[1]、果胶[2]、多糖[3]、黄酮类化合物[4]及多种微量元素[5]等。其中,黄酮类化合物是柑橘属植物的主要活性成分之一,而且在果皮中的含量很高[6]。黄烷酮、黄酮、黄酮醇这3 类化合物是柑橘属中主要的黄酮类成分,其中多甲氧基黄酮在抗诱变和抗肿瘤方面有着独特的潜在价值[6]。
大孔吸附树脂是一种应用比较广泛的吸附分离介质,具有稳定性高、吸附选择性独特、富集效果好、解吸条件温和、不受无机物影响、再生简便、使用周期长等优点[7],广泛应用于中药及天然植物中活性成分(如皂苷、黄酮、内脂、生物碱等大分子化合物)的提取分离[8],尤其用于纯化黄酮的报道最多。近年来已有大孔树脂用于纯化柑橘属果皮黄酮的报道[9-12],研究表明D101和AB-8大孔树脂分离纯化柑橘皮黄酮有较好的效果。石磊等[13]用AB-8大孔树脂静态法精制芦柑总皮黄酮使其纯度达到51.6%,但有关动态吸附解吸性能的研究未见报道。本研究选择AB-8大孔吸附树脂,以芦柑皮为原料,研究对总黄酮类化合物的动态吸附和解吸性能,并利用硅胶柱层析、HPLC等技术分离纯化精制的芦柑皮黄酮,为综合开发芦柑皮资源提供参考。
1 材料与方法
1.1 材料与试剂
成熟芦柑产地福建永春,采收期2010年12月,由福建省宏顺食品饮料有限公司(永春)提供。
芦丁(生化试剂) 国药集团化学试剂有限公司;乙醇、亚硝酸钠、硝酸铝、氢氧化钠、石油醚、乙酸乙酯、丙酮(均为分析纯) 西陇化工股份有限公司;AB-8大孔吸附树脂 天津南开大学化工厂;硅胶(100~200、200~300目,化学纯) 青岛海洋化工有限公司。
1.2 仪器与设备
CLF-04中药粉碎机 广州大祥电子机械设备有限公司;752N紫外分光光度计 上海精密科学仪器有限公司;奥利龙酸度计 美国Thermo有限公司;INOVA-500MHz-FT核磁共振仪、6320型ESI质谱仪 美国Agilent公司;1525半制备型高效液相色谱仪(2998光电二极管阵列(photo-diode array,PDA)检测器) 美国Waters公司。
1.3 方法
1.3.1 芦柑皮总黄酮的提取
取芦柑皮70 ℃烘干,粉碎,过30目筛,精密称取100 g,石油醚脱脂,过滤;滤渣加 2 L 90%乙醇溶液80 ℃回流提取3 次,每次2 h。合并滤液,减压浓缩,8 000 r/min离心30 min,取上清液,冷冻干燥,得芦柑皮总黄酮粗提取物。
1.3.2 芦丁标准曲线的绘制及总黄酮含量的测定
标准曲线的绘制及芦柑皮总黄酮含量的测定参照《中国药典》2010版[14]。以吸光度A为纵坐标、芦丁质量浓度ρ(mg/mL)为横坐标,绘制标准曲线方程为:A=12.214ρ-0.004,R2=0.999 5。按式(1)计算总黄酮含量。

式(1)中:ρ为测定样液的质量浓度/(mg/mL);V为原料液的体积/mL;m为原料质量/mg。
1.3.3 大孔树脂的筛选及其预处理
[13],选择AB-8大孔树脂进行动态法精制芦柑皮总黄酮的研究,其预处理方法参照文献[15]。
1.3.4 动态吸附泄漏曲线的研究
准确称取18 g预处理过的AB-8大孔树脂,装柱后,上样条件为:芦柑皮总黄酮质量浓度为2.86 mg/mL,pH 3.5,流速为3.0 BV/h(柱床体积约20 mL);洗脱条件为:洗脱液为90%乙醇,流速为3.0 BV/h;洗脱液每10 mL收集1 管,测其质量浓度,以总黄酮质量浓度(mg/mL)为纵坐标,洗脱体积(BV)为横坐标绘制动态吸附泄漏曲线[16]。
1.3.5 AB-8大孔树脂对芦柑皮总黄酮的动态吸附解吸性能的影响
准确称取18 g预处理过的AB-8大孔树脂,装柱后,在相同条件下研究上样液总黄酮质量浓度(0.95、1.98、3.03、4.09、4.93 mg/mL)、pH(1.0、2.0、3.0、4.0、5.0)、上样流速(1.0、2.0、3.0、4.0、5.0、6.0 BV/h)对AB-8大孔树脂吸附效果的影响;分析解吸液乙醇体积分数(30%、40%、50%、60%、70%、80%、90%)对洗脱效果的影响。根据式(2)~(4)计算总黄酮得率、吸附率、解吸率:
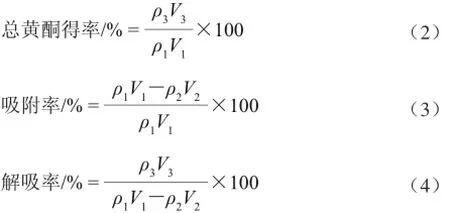
式(2)~(4)中:ρ1、ρ2、ρ3分别表示原料液、流出液和洗脱液的黄酮质量浓 度/(mg/mL);V1、V2、V3表示原料液、流出液和洗脱液的体积/mL。
1.3.6 AB-8大孔树脂动态洗脱特性分析
按确定的最佳吸附和解吸条件上柱洗脱,部分收集洗脱液,每10 mL收集1管,测其质量浓度;以洗脱液体积为横坐标,洗脱液中总黄酮质量浓度为纵坐标,绘制洗脱曲线。
1.3.7 黄酮类化合物的分离纯化
精制的芦柑皮总黄酮,经水溶解,乙酸乙酯萃取,浓缩,冷冻干燥,得15 g粉末状样品。样品经硅胶柱色谱(石油醚-丙酮,20∶1→0∶1梯度洗脱)得17 个组分(Fr1-17),Fr2经硅胶柱色谱(石油醚-乙酸乙酯系统,20∶1→0∶1梯度洗脱)得5 个组分:Fr2-1、Fr2-2、Fr2-3、Fr2-4、Fr2-5,Fr2-1、Fr2-2、Fr2-3分别再经1 次硅胶柱色谱(石油醚-丙酮系统梯度洗脱)和半制备高效液相色谱(甲醇-水)得化合物1(24.5 mg)、化合物2(16.1 mg)、化合物3(8.6 mg)。Fr3经硅胶柱色谱(石油醚-丙酮系统,20∶1→0∶1梯度洗脱)得4 个组分:Fr3-1、Fr3-2、Fr3-3、Fr3-4,前3 个组分分别再经1 次硅胶柱色谱(石油醚-丙酮系统梯度洗脱)和半制备高效液相色谱(甲醇-水)得化合物4(9.5 mg)、化合物5(9.2 mg)、化合物6(7.9 mg)。Fr4经2 次硅胶柱色谱(石油醚-丙酮系统梯度洗脱),再经半制备高效液相色谱(甲醇-水),得化合物7(8.2 mg)、化合物8(9.1 mg)。
液相色谱条件:Agilent C18色谱柱 (250 mm× 9.4 mm,5 μm);流动相:甲醇-水;流速:2.0 mL/min;柱温30 ℃;PDA检测器,检测波长:220、254、280、360 nm。
2 结果与分析
2.1 动态吸附泄漏曲线
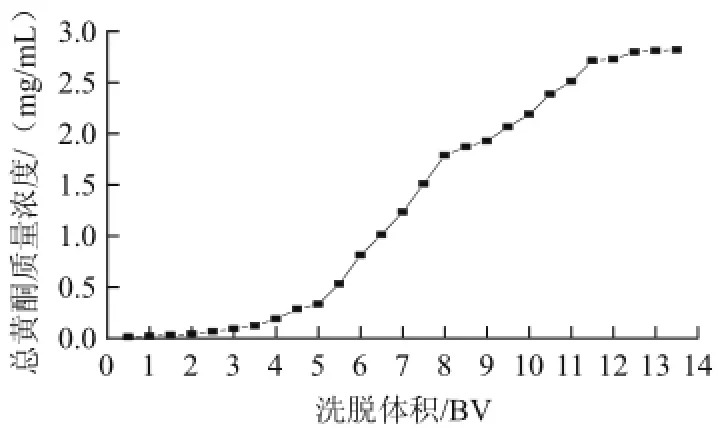
图1 吸附泄漏曲线Fig.1 Breakthrough curve
一般认为,泄漏曲线的泄漏点为流出液中总黄酮质量浓度达到原料液黄酮质量浓度的1/10时所流出的体积。如图1所示,AB-8大孔树脂的动态吸附泄漏曲线的泄漏点为2.0 BV。由图1可知,当流出液体积达到13.5 BV时,芦柑皮总黄酮质量浓度已非常接近原料液中芦柑皮总黄酮的质量浓度,说明此时AB-8大孔树脂已趋于饱和吸附。由于传质阻力的存在,使得吸附泄漏曲线达不到理想中的“S”型曲线。
2.2 上样液总黄酮质量浓度的选择
准确称取18 g预处理过的AB-8大孔树脂装柱,上样条件为:pH 3.5、流速3.0 BV/h;洗脱条件:洗脱液为90%乙醇、流速3.0 BV/h;总黄酮质量浓度对吸附的影响结果如图2所示。
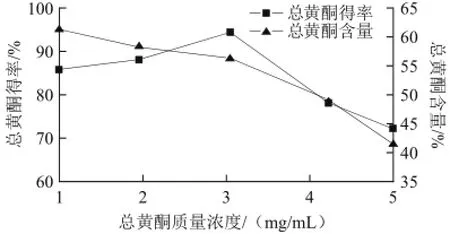
图2 总黄酮质量浓度对总黄酮得率和含量的影响Fig.2 Effect of sample concentration on the recovery and purity of flavonoids
由图2可知,上样液质量浓度在3.03 mg/mL左右时,芦柑皮总黄酮含量和得率都相对较高;当上样液质量浓度低于3.03 mg/mL时,AB-8大孔吸附树脂有足够吸附芦柑皮总黄酮的活性位点,此时总黄酮得率会随着样品质量浓度的增高而上升;随着上柱液总黄酮质量浓度的不断增大,杂质含量增加,杂质会与芦柑皮黄酮竞争吸附活性位点,导致总黄酮得率减小[17];此外,实验过程中发现,原料液质量浓度高于3.03 mg/mL时会有流速减慢的现象;这是因为选用的AB-8树脂的粒径范围较细,为0.3~1.25 mm,随着上样液质量浓度的增加,发生多分子层吸附,容易导致树脂吸附过程中流速减慢[18-19];综合考虑,上样液总黄酮质量浓度在3.03 mg/mL左右为佳。
2.3 上样液pH值的选择
黄酮类化合物含有酚羟基,呈弱酸性,在酸性条件下可使黄酮类化合物保持分子状态,这有利于大孔吸附树脂对其吸附;在碱性条件下,黄酮类化合物会离子化不利于树脂对其吸附[20]。准确称取18 g预处理过的AB-8大孔树脂装柱,上样条件为:芦柑皮总黄酮质量浓度3.0 mg/mL、流速3.0 BV/h;洗脱条件:洗脱液为90%乙醇、流速3.0 BV/h;上样液pH值对吸附的影响结果如图3所示。
由图3可知,当pH 3.0的时候,AB-8的吸附效果最好,吸附率高达80.22%;随着pH值的增大吸附率反而降低,这可能是因为pH值在3.0左右,黄酮分子呈分子状态,有利于吸附。原料液pH值为1和2时有颜色变化,可能形成了盐结构[7],进而导致吸附率偏低。
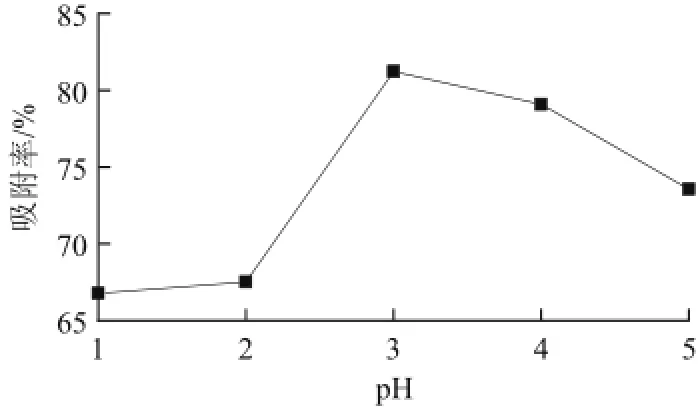
图3 上样液pH值对总黄酮吸附的影响Fig.3 Effect of sample pH on flavonoids adsorption
2.4 上样流速的选择
准确称取18 g预处理过的AB-8大孔树脂装柱,上样条件为:芦柑皮总黄酮质量浓度3.0 mg/mL、pH 3.0;洗脱条件:洗脱液90%乙醇溶液、流速3.0 BV/h;上样流速对吸附的影响结果如图4所示。
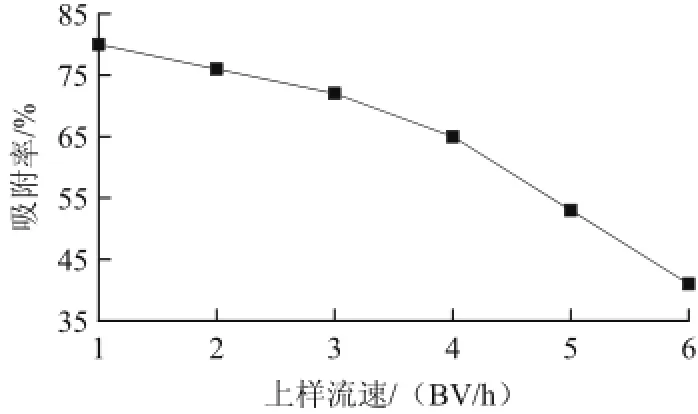
图4 上样流速对总黄酮吸附的影响Fig.4 Effect of sample flow rate on flavonoids adsorption
由图4可知,随着上样流速的增大,AB-8大孔树脂的吸附率呈下降趋势,即流出液的总黄酮的质量浓度逐渐增大。上样流速过快,芦柑皮黄酮溶液与树脂的接触时间短,其分子来不及扩散到树脂的内表面而发生漏吸,导致吸附率降低;上样流速较小时,黄酮分子有足够多的时间与树脂内表面接触,有利于AB-8大孔树脂对芦柑皮黄酮的吸附,从而可以减少黄酮分子的漏出量,有利于提高树脂的吸附量。流速过小,会使实验周期延长,综合考虑吸附率和实验时间,选取上样流速为3.0 BV/h。
2.5 洗脱液体积分数的选择
准确称取18 g预处理过的AB-8大孔 树脂装柱,上样条件为:芦柑皮总黄酮质量浓度3.0 mg/mL、pH 3.0、流速3.0 BV/h;3.0 BV/h的流速洗脱;洗脱液乙醇体积分数对解吸性能的影响结果如图5所示。
由图5可知,随着解吸液乙醇体积分数的增大,解吸率不断上升;这是因为被分离物质与树脂之间具有一定的范德华力,随着两种物质的极性越相近则范德华力越大。AB-8大孔吸附树脂为弱极性的树脂,其吸附的芦柑皮黄酮极性较小,故乙醇体积分数越高即极性越小则洗脱效果越明显。考虑到乙醇体积分数增大到一定程度后,解吸率提高不明显,而大量杂质也会随之洗脱下来,这将使芦柑皮总黄酮纯度下降;综合考虑,解吸液乙醇体积分数选择 90%。
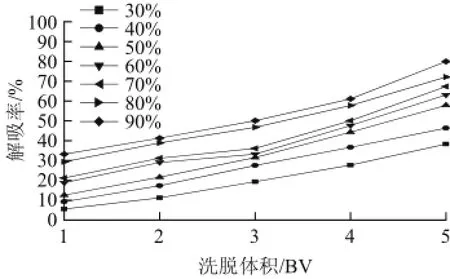
图5 乙醇体积分数对总黄酮解吸的影响Fig.5 Effect of ethanol concentration on flavonids desorption
2.6 动态洗脱特性曲线
准确称取18 g预处理过的AB-8大孔树脂装柱,按照最佳吸附解吸工艺(上样液总黄酮质量浓度3.03 mg/mL、pH 3.0、流速3.0 BV/h、洗脱液乙醇体积分数90%)上样洗脱,AB-8大孔树脂动态洗脱特性曲线如图6所示。
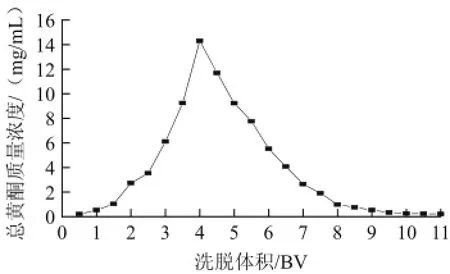
图6 洗脱曲线Fig.6 Elution curve
由图6可知,芦柑皮黄酮的洗脱高峰相对集中,对称性较好,洗脱性能良好。当洗脱液体积为4 BV时,芦柑皮总黄酮质量浓度达到最高值,为14 mg/mL;当洗脱液体积达到10 BV时,基本上能将AB-8大孔吸附树脂吸附的芦柑皮黄酮全部洗脱。
2.7 精制总黄酮含量的测定
按1.3.1节方法提取的芦柑皮总黄酮的纯度为17.8%。按上述优化的工艺以AB-8大孔树脂进行3 次实验,精制的芦柑皮总黄酮纯度分别为60.7%、65.4%、63.2%,取其平均值为63.1%,RSD为3.73%。
2.8 单体化合物的结构鉴定
2.8.1 化合物1
淡黄色针状结晶(甲醇);正离子模式,ESI-MS m/z:373[M+H]+,395[M+Na]+,411[M+K]+。1H-NMR(500 MHz, CD3OD) δ:7.96(2H, d, J=9.0 Hz, H-2’, 6’),7.09(2H, d, J=9.0 Hz, H-3’, 5’),6.65(1H, s, H-3),4.10,4.02,3.92(9 H, s, 3×OCH3),3.89(6H, s, 2×OCH3);13C-NMR(125 MHz, CD3OD) δ:179.8(C-4),164.5(C-4’),164.0(C-2),153.5(C-7),149.5(C-5),149.3(C-9),145.8(C-6),139.8(C-8),129.2(C-2’, 6’),124.7(C-1’),115.8(C-10),115.5(C-3’, 5’),106.9(C-3),62.8,62.3,56.2(5×OCH3)。以上数据与文献[21-22]报道的橘皮素数据基本一致,故化合物1鉴定为橘皮素。
2.8.2 化合物2
无色针晶(甲醇);正离子模式,ESI-MS m/z:403[M+H]+,425[M+Na]+,441[M+K]+。1H-NMR(500 MHz, CDCl3) δ:7.61(1H, dd, J1=2.0 Hz, J2=8.50 Hz, H-6’),7.44(1H, d, J=2.0 Hz, H-2’),7.00(1H, d, J= 8.50 Hz, H-5’),6.84(1H, s, H-3),4.12(3H, s, OCH3-5),4.04(3H, s, OCH3-8),3.99(3H, s, OCH3-6),3.97(3H, s, OCH3-7),3.96(6H, s, OCH3-3’, 4’);13C-NMR(125 MHz, CDCl3) δ:177.4(C-4),161.8(C-2),152.3(C-7),151.8(C-9),149.4(C-5),148.4(C-4’),147.7(C-3’),144.3(C-6), 137.9(C-8),123.7(C-1’),120.08(C-6’),114.3(C-5’),111.3(C-2’),108.7(C-10),106.3(C-3),62.3(5-C),62.0(6-C),61.8(7-C),61.7(8-C),56.1(4’-C),56.0(3’-C)。以上数据与文献[22-23]中川陈皮素一致,故鉴定化合物2为川陈皮素。
2.8.3 化合物3
浅黄色针状结晶(甲醇);正离子模式,ESIMS m/z:343[M+H]+,365[M+Na]+,381[M+K]+。1H-NMR(500 MHz, CDCl3)δ:7.96(2H, d, J=8.0 Hz, H-2’,6’),7.10(2H, d, J=9.0 Hz, H-3’, 5’),6.68(1H, s, H-8),6.61(1H, s, H-3),4.01(3H, s, OCH3-5),3.95(3H, s, OCH3-7 ),3.92(3H, s, OCH3- 8),3.89(3H, s, OCH3-4’);13C-NMR(125 MHz, CDCl3)δ:180.4(C-4),164.4(C-2),163.5(C-4’),159.0(C-7),157.9(C-5),153.2(C-9),132.0(C-6),129.2(C-2’, 6’),124.7(C-1’),115.8(C-3’, 5’),109.1(C-10),106.9(C-3),94.4(C-8),62.1,57.1,56.8,56.2(4×OCH3)。以上数据与文献[24]报道的4’,5,7,8-四甲氧基黄酮数据一致,故化合物3鉴定为4’,5,7,8-四甲氧基黄酮。
2.8.4 化合物4
淡黄色针状结晶(甲醇);正离子模式,ESI-MS m/z:359[M+H]+,381[M+Na]+,397[M+K]+。1H-NMR(500 MHz, CDCl3)δ:12.35(1H, s, 5-OH),7.91(2H, d, J=8.8 Hz, H-2’,6’),7.05(2H, d, J= 8.8 Hz, H-3’, 5’),6.61(1H, s, H-3),4.12,3.99,3.96,3.91(12H, s, 4×OCH3)。13C-NMR (500 MHz, CDCl3)δ:183.5(C-4),164.5(C-4),163.1(C-2), 153.2(C-7),145.0(C-5),146.2(C-9),136.9(C-6),133.4(C-8), 128.4(C-2,6),123.8(C-1),114.9(C-3, 5),107.3(C-10),104.1(C-3),62.4,62.0,61.4,55.8(4×OCH3)。以上数据与文献[6]报道的5-去甲基-橘皮素数据一致,故化合物4鉴定为5-去甲基-橘皮素。
2.8.5 化合物5
无色针状结晶(甲醇);正离子模式,ESI-MS m/z:373[M+H]+,395[M+Na]+。1H-NMR (500 MHz, CDCl3)δ:7.62(1 H, d, J=8.5 Hz, H-6’),7.36(1H, s, H-2’),6.92(1H, d, J=8.5 Hz, H-5’),6.63(1H, s, H-8),6.37(1H, s, H-3),3.95,3.92,3.90(9H, s, 3×OCH3),3.89(6H, s, 2×OCH3);13C NMR(500 MHz, CDCl3)δ:177.7(C-4),161.8(C-2),157.3(C-7),154.4(C-9),152.6(C-5),149.9(C-4’),149.4(C-3’),141.0(C-6),120.9(C-1’),120.3(C-6’),111.8(C-5’),109.4(C-2’),108.1(C-3),107.8(C-10),97.0(C-8),62.8,62.2,57.0,56.9,56.8(5×OCH3)。以上数据与文献[25-26]报道的橙黄酮(5,6,7,3’,4’-pentamethoxyflavone)数据基本一致,故化合物5鉴定为橙黄酮。
2.8.6 化合物6
无色针状结晶(甲醇);正离子模式,ESI-MS m/z:373[M+H]+,395[M+Na]+。1H-NMR(500 MHz, CDCl3)δ:7.91(2H, d, J=8.8 Hz, H-2’,6’),7.01(2H, d, J=8.8 Hz, H-3’,5’),6.58(1H, s, H-5),4.01(3H, s, OCH3),4.00(3H, s, OCH3),3.99(6H, s, 2×OCH3),3.89(3H, s, OCH3)。以上数据与文献[27]报道的橙浸膏数据基本一致,故化合物6鉴定为橙浸膏。
2.8.7 化合物7
白色结晶粉末(氯仿);正离子模式,ESI-MS m/z:581[M+H]+。1H-NMR (500 MHz, DMSO-d6)δ:12.10(1H, s, 5-OH),9.59(1H, s, 4’-OH),7.35(2H, d, J=8.0 Hz, H-2’,6’),6.80(2H, d, J=8.0 Hz, H-3’,5’),6.14(1H, d, J=2.5 Hz, H-8),6.12(1H, d, J=2.0 Hz, H-6),5.50(1H, centred t, J=5.5 Hz, H-2),5.3(1H, d, J=8.2 Hz, 葡萄糖, H-1’),5.2(1H, d, J=2.2 Hz, 鼠李糖, H-1’’),3.8(2H, m, H-6’),3.2-3.7(14H, m, 鼠李糖和葡萄糖, H),1.2(3H, d, J=6.6 Hz 鼠李糖CH3)。以上数据与文献[28]报道的柚皮苷数据基本一致,故化合物7鉴定为柚皮苷。
2.8.8 化合物8
淡黄色结晶粉末(氯仿);正离子模式,ESI-MS m/z:611[M+H]+。1H-NMR(500 MHz, DMSO-d6)δ:12.0(1H, s, 5-OH),9.1(1H, s, 3’-OH),6.95(1H, d, J=2.0 Hz, H-2’),6.93(1H, d, J=8.0 Hz, H-5’),6.91(1H, dd, J=2.0 Hz, 8.0 Hz, H-6’),6.15(1H, d, J=2.0 Hz, H-8),6.12(1H, d, J=2.0 Hz, H-6),4.98(1H, d, J=7.4 Hz, 葡萄糖H-1’),4.52(1H, s, 鼠李糖, H-1’’),3.77(3H, s, OCH3-4’),3.52-3.65(2H, m, H- 6’),3.2-3.6(7H, m, 鼠李糖和葡萄糖, H),3.14(1H, m, H-3b),2.79(1H, m, H-3a),1.08(3H, m, 鼠李糖-CH3);13C NMR(125 MHz, DMSO-d6)δ:196.7(C-4),164.9(C-7),162.6(C-5),162.0(C-9),130.4(C-l’),146.1(C-3’),147.6(C-4’),117.5(C-6’),113.9(C-2’),111.7(C-5’),102.9(C-10),100.2(C-1’’),99.0(C-l’),95.9(C-6),95.2(C-8),78.0(C-2),75.9(C-3’),75.2(C-5’),72.7(C-2’),71.6(C-4’’),69.9(C-3’’),69.8(C-2’’),69.1(C-4’),67.9(C-5’’),65.7(C-6’),55.3(OCH3),41.7(C-3),17.5(C-6’’)。以上数据与文献[28-29]报道的橙皮苷数据基本一致,故化合物8鉴定为橙皮苷。
3 结 论
AB-8大孔树脂能很好地富集纯化芦柑皮总黄酮,其最佳吸附解吸工艺为:上样液总黄酮质量浓度3.03 mg/mL、pH 3.0、流速3.0 BV/h、洗脱液乙醇体积分数90%,最佳工艺可使芦柑皮总黄酮的纯度由粗提物的17.8%提高到63.1%。该法工艺简单,成本低,易操作,适合工业化生产。此外,从精制的芦柑皮黄酮中分离到8 个黄酮类化合物,分别鉴定为:橘皮素、川陈皮素、4’,5,7,8-四甲氧基黄酮、5-去甲基-橘皮素、橙黄酮、橙浸膏、柚皮苷、橙皮苷,其中,4’,5,7,8-四甲氧基黄酮、5-去甲基-橘皮素、橙浸膏、柚皮苷、橙皮苷为首次从芦柑皮中分得。
参考文献:
[1] 李飞, 杨小林, 杨中林. 芦柑皮挥发油等对胡椒碱促透作用研究[J].中医药学报, 2010, 38(2): 97-99.
[2] 吴环. 芦柑皮中果胶提取研究[J]. 安徽农业科学, 2012, 40(7): 3982-3983.
[3] 王丽艳, 荆瑞勇, 阮洪生, 等. 芦柑皮中水溶性多糖提取条件的研究[J].食品科学, 2009, 30(6): 117-119.
[4] 焦士蓉, 王玲, 林玲. 芦柑皮黄酮类物质的微波辅助提取及其抗氧化活性研究[J]. 西华大学学报: 自然科学版, 2007, 26(4): 36-39.
[5] 田芳, 杨毅平, 左玉, 等. 芦柑果皮和果肉中微量元素比较[J]. 山西大学学报: 自然科学版, 2011, 34(2): 281-384.
[6] DU Qizhen, CHEN Hui. The methoxyflavones in Citrus reticulata Blanco cv. Ponkan and their antiproliferative activity against cancer cells[J]. Food Chemistry, 2010, 119(1): 567-572.
[7] 李俶, 倪永年, 李莉. 大孔吸附树脂分离纯化槲寄生中黄酮的研究[J].食品科学, 2008, 29(2): 68-71.
[8] 徐青, 卢莹莹, 辛建美, 等. 大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J]. 食品科学, 2011, 32(2): 115-118.
[9] 陈复生, 左锦静, 姚永志. 大孔树脂吸附和分离陈皮中黄酮类化合物的研究[J]. 食品科技, 2006, 32(7): 121-123.
[10] 汪洋, 吴剑, 曾凡坤. 大孔树脂纯化柑橘皮渣类黄酮的工艺研究[J].食品工业科技, 2011, 33(10): 34-37.
[11] 胡志军, 郝利君, 王南溪, 等. D-101大孔吸附树脂分离纯化橘皮中的黄酮类物质[J]. 食品科学, 2010, 31(8): 65-68.
[12] 李维, 钟世安, 乔蓉, 等. 大孔树脂吸附分离柚皮加工废液中的总黄酮[J]. 北京化工大学学报, 2007, 23(增刊2): 28-31.
[13] 石磊, 肖美, 添叶静, 等. AB-8大孔吸附树脂静态法精制芦柑皮总黄酮[J]. 农业机械, 2012(9): 112-115.
[14] 国家药典委员会. 中华人民共和国药典: 一部[S]. 2010年版. 北京:中国医药科技出版社, 2010: 355.
[15] 唐巧玉, 周毅峰, 阎婷. HPD300大孔树脂纯化金橘皮黄酮类化合物的工艺研究[J]. 食品科学, 2008, 29(8): 355-358.
[16] 袁慧, 周亚球, 光琴. 黄蜀葵花总黄酮的大孔树脂纯化工艺[J]. 安徽医药, 2009, 13(2): 136-138.
[17] ZHANG Ying, LI Shufen, WU Xiwen, et al. Macroporous resin adsorption for purification of flavonoids in Houttuynia cordata Thunb[J]. Chinese Journel of Chemical Engineering, 2007, 15(6): 872-876.
[18] 贾海伦. 芹菜黄酮提取及分离纯化工艺研究[D]. 哈尔滨: 黑龙江大学, 2008.
[19] 王雅, 樊明涛, 赵萍, 等. 大孔树脂对沙枣多酚的动态吸附解析性能研究[J]. 西北农林科技大学学报: 自然科学版, 2010, 38(12): 215-219.
[20] FU B Q, LIU J, LI H, et al. The application of macroporous resin in the separation of licorice flavonoids and glycyrrhizic acid[J]. Chromatography A, 2005, 1089(1/2): 18-24.
[21] 孙印石, 刘政波, 王建华. 等高速逆流色谱分离制备陈皮中的黄酮类化合物[J]. 色谱, 2009, 27(2): 244-247.
[22] 韩金旦, 王奎武, 沈莲清. 枳实中多甲氧基黄酮类化合物的研究[J].时珍国医国药, 2010, 21(10): 2469-2470.
[23] 钱士辉, 陈廉. 陈皮中黄酮类成分的研究[J]. 中药材, 1998, 21(6): 28.
[24] MACHIDA K, OSAWA K. On the Flavonoid constituents from the Peels of Citrus hassaku HORT. ex TANAKA[J]. Chemical and Pharmaceutical Bulletin, 1989, 37(4): 1092-1094.
[25] YAM M F, LIM V, SALMAN I M, et al. HPLC and anti-inflammatory studies of the flavonoid rich chloroform extract fraction of orthosiphon stamineus leaves[J]. Molecules, 2010, 15(6): 4452-4466.
[26] 郅景梅, 张天歌. 胡柚皮中化学成分的研究[J]. 黑龙江医药, 2008, 21(4): 30-31.
[27] CHKHIKVISHVILI I D, GOGIYA N A, SHALASHVILI A G. Composition of polymethoxylated flavones from mandarin orange peel[J]. Prikladnaya Biokhimiya i Mikrobiologiya, 1993, 29(4): 604-609.
[28] DALIA H, MAHMOUD Z R, AHMAD T, et al. Chemical composition and biological activity of Citrus jambhiri Lush[J]. Food Chemistry, 2011, 127(2): 394-403.
[29] TSUYOSHI I, SHUNTARO T, KAZUNORI O, et al. Isolation of hesperidin from peels of thinned Citrus unshiu fruits by microwaveassisted extraction[J]. Food Chemistry, 2010, 123(2): 542-547.
Purification of Total Flavonoids Extracted from Ponkan (Citrus reticulata Blanco cv. Ponkan) Peel by AB-8 Macroporous Adsorption Resin and Separation of Flavonoid Constituents
LUO Dang-wei, YE Jing, HUANG Ya-yan, XIAO Mei-tian*
(College of Chemical Engineering, Huaqiao University, Xiamen 361021, China)
Objective: To propose an optimal purif i cation process for fl avonoids extracted from ponkan (Citrus Reticulata Blanco cv. Ponkan) peel. Methods: The dynamic adsorption and desorption performance of AB-8 macroporous resin towards flavonoids extracted from ponkan peel was investigated. Major process parameters including sample concentration, pH, fl ow rate, and elution ethanol concentration were evaluated. Then the purif i ed fl avonoids were isolated by chromatographic methods with silica gel and semi-preparative HPLC, and the structures were elucidated on the basis of physicochemical pro perties and spectral data analysis. Results: The optimal purif i cation process was determined as follows: samples at pH 3.0 conta ining 3.03 mg/mL ponan peel fl avonoids were loaded onto the column at a fl ow rate of 3.0 BV/h, and then 90% ethanol was passed through the column to elute the bound flavonoids. After the purification, the purity of ponan peel fl avonoids was increased from 17.8% to 63.1%. In addition, eight compounds were isolated from the purif i ed fl avonoids and identif i ed as tangeretin, nobiletin, 4′,5,7,8-tetramethyl-O-isoscutellarein, 5-demethyl-tangeretin, sinetsetin, aurantine, naringin, and hesperidin. Conclusion: AB-8 macroporous resin has a high performance in enriching and purifying fl avonoids from ponkan peel, providing a simple and feasible method. Eight compounds can be isolated from the purif i ed fl avonoids. Moreover, 4′,5,7,8-tetramethyl-O-isoscutellarein, 5-demethyl-tangeretin, aurantine, naringin, and hesperidin are first reported from ponkan peel.
Citrus reticulata Blanco cv. Ponkan peel; flavonoids; AB-8 macroporous adsorption resin
Q946.8;R284
A
1002-6630(2014)06-0030-06
10.7506/spkx1002-6630-201406006
2013-04-12
泉州市重大科技专项(2008ZD17)
骆党委(1985—),男,硕士,研究方向为天然产物化学。E-mail:kukuleleyunyun@126.com
*通信作者:肖美添(1968—),男,教授,博士,研究方向为天然产物化学。E-mail:mtxiao@hqu.edu.cn
