碱性条件下胡敏酸吸附镉的特征研究
2014-02-25曾祥峰王祖伟魏树和于晓曼
曾祥峰,王祖伟,魏树和,于晓曼
1. 中国科学院沈阳应用生态研究所陆地生态过程重点实验室,辽宁 沈阳,110016;2. 天津师范大学城市与环境科学学院,天津,300308;3. 中国科学院大学,北京,100049
碱性条件下胡敏酸吸附镉的特征研究
曾祥峰1,3*,王祖伟2,魏树和1,于晓曼1,3
1. 中国科学院沈阳应用生态研究所陆地生态过程重点实验室,辽宁 沈阳,110016;2. 天津师范大学城市与环境科学学院,天津,300308;3. 中国科学院大学,北京,100049
为了探讨胡敏酸在碱性条件下的吸附镉机理,了解碱性盐化土壤中镉污染机理和生态环境之间的关系,实验研究了胡敏酸在碱性条件吸附镉的特征。采用批吸附试验方法,研究不同Cd初始浓度、反应时间、不同pH和离子强度对胡敏酸吸附镉的影响,结果表明:胡敏酸具有较强吸附镉的能力,可以用Langmuir吸附模型和Temkin吸附模型很好地拟合其等温吸附过程(r分别为0.9809和0.9816);在60 min内的快速反应阶段和60 min至6 h间的慢速反应阶段,胡敏酸对镉的吸附量分别为2.895 mg·g-1和3.342 mg·g-1,吸附反应平衡前6 h的动力学过程可以用Elovich方程进行很好的拟合(r为0.9285);随着pH增加,吸附率表现出逐步增加趋势,并以pH为4.5和8.5为界,呈现两端增加速度快,中间增加慢的规律性;在较低浓度离子强度下,离子强度的增加促进胡敏酸吸附镉;而在高离子强度下,表现出相反的规律性;在相同的条件下,不同离子强度对胡敏酸吸附镉的影响大小为:氯化钙>氯化镁>氯化钾>氯化钠。土壤在盐化的过程中,由于无机盐浓度的增加,增加了重金属离子的生物可利用性,加大了重金属离子的生态风险。
胡敏酸;镉;等温吸附;pH;无机盐
土壤是人类赖以生存的最重要的自然资源之一,但是随着工业的快速发展,土壤的污染特别是重金属污染越来越严重。近年来研究证明,无论是从毒性还是蓄积作用来看,镉都是污染人类环境、威胁人类健康的最重要的金属元素之一(Renella等, 2005; Khan等, 2008; 孙约兵等, 2012; 苏慧等, 2013)。而土壤中镉的各种形态受土壤质地、矿物组成、pH、有机物、氧化还原电位等诸多因素的控制,它们的共同作用决定了镉在土壤中的各种形态分布、镉的地球化学行为和环境效应(徐良将等, 2011; Liu等, 2013; 张晶等, 2013; Zhang等, 2013)。腐殖质是广泛存在于土壤介质中的高分子有机物,能与金属离子形成溶于水和不溶于水的化合物,从而影响它们在土壤环境中的迁移、转化和生物可得性及毒性(邓红梅和陈永亨, 2010; Pauge等, 2011; Silva等, 2013)。胡敏酸作为腐殖质的主要成分之一,具有较高的活性,与重金属有较强的吸附作用,形成难溶的化合物,对固定金属污染物和环境修复有积极意义(范文宏等, 2007; Yang等, 2011)。
以往对胡敏酸吸附镉特征的研究多集中在在酸性或中性条件下进行(李光林等, 2004; 朱丽琚等, 2008a; 朱丽琚等, 2008b),而碱性条件下土壤胡敏酸对镉的吸附特征少见报道。在渤海西岸,广泛分布的海洋和河流相互作用形成的冲积海积平原上,盐渍化土壤发育,并呈碱性(pH在7.2~8.9之间)(王祖伟等, 2005; 曾祥峰等, 2008)。由于污水灌溉和城市污泥使用,渤海西岸的冲积海积平原上广泛分布的碱性盐化湿潮土遭到严重污染,镉是最主要的污染元素(谭科艳等, 2011; Wang等, 2012;张小敏等, 2014)。因此研究胡敏酸在碱性条件下的吸附镉机理,对了解碱性盐化土壤中镉污染机理和生态环境之间的关系有重要的理论和实践意义。
1 实验部分
1.1 试剂和仪器
试剂:胡敏酸购于sigma公司,氯化镉、盐酸、氢氧化钠等均有国药集团提供,以上药品均为分析纯。用蒸馏水配制浓度为10 ppm的胡敏酸溶液,4度冰箱保存备用。
仪器:ELAN900电感耦合等离子体质谱仪(ICP-MS):美国Perkin Elemer公司;PHS-3B型酸度计:上海精密仪器有限公司;CHA-SA型气浴恒温振荡器:江苏省金坛市环宇科学仪器厂;800型离心沉淀器:上海手术器械厂;FA1004型电子分析天平:上海分析仪器总厂。
1.2 实验方法
1.2.1 等温吸附试验
取10 mL胡敏酸储备溶液于50 mL离心管中,再加入初始浓度为8、40、80、120、200、400、800 mg·L-1的硝酸镉溶液10 mL,既最终反应溶液中镉的浓度别为4、20、40、60、100、200、400 mg·L-1,加入NaCl作为支持电解质,初始NaCl的浓度为0.01 mol·L-1。用0.1 mol·L-1的盐酸和氢氧化钠溶液调pH至8.5,放入气浴恒温振荡器中,25摄氏度下避光密封震荡反应6 h后取出,8000 r·min-1下离心10 min,取上清液,用ICP-MS测定溶液中镉离子浓度。
1.2.2 吸附动力学实验
取10 mL胡敏酸储备溶液于50 mL离心管中,再加入初始浓度为80 mg·L-1的硝酸镉溶液10 mL,加入NaCl作为支持电解质,初始NaCl的浓度分别为0.01 mol·L-1。用0.1 mol·L-1的盐酸和氢氧化钠溶液把pH调至8.5,放入气浴恒温振荡器中,25摄氏度下避光密封震荡反应,分别在反应10 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h、16 h、24 h和36 h后取出,8000 r·min-1下离心30 min,取上清液,用ICP-MS测定溶液中镉离子浓度。
1.2.3 pH值的影响实验
取10 mL胡敏酸储备溶液于50 mL离心管中,再加入初始浓度为80 mg·L-1的硝酸镉溶液10 mL,加入NaCl作为支持电解质,初始NaCl的浓度为0.01 mol·L-1。用0.1 mol·L-1的盐酸和氢氧化钠溶液把pH分别调至2.5、3、3.5、4、4.5、5、6、7、8、8.5、9、10,放入气浴恒温振荡器中,25摄氏度下避光密封震荡反应6 h后取出,8000 r·min-1下离心10 min,取上清液,用ICP-MS测定溶液中镉离子浓度。
1.2.4 离子强度的影响
取10 mL胡敏酸储备溶液于50 mL离心管中,再加入初始浓度为80 mg·L-1的硝酸镉溶液10 mL,分别加入NaCl、KCl、CaCl2作为支持电解质,初始浓度分别为0.001、0.005、0.01、0.02、0.05、0.1、0.1 mol·L-1。用0.1 mol·L-1的盐酸和氢氧化钠溶液调pH至8.5,放入气浴恒温振荡器中,25摄氏度下避光密封震荡反应6 h后取出,8000 r·min-1下离心30 min,取上清液,用ICP-MS测定溶液中镉离子浓度。
1.3 数据处理
1.3.1 Cd的吸附量和吸附率
Cd的吸附量由以下公式来表示:
Q=(C0-C)×L/m
Cd的吸附率由以下公式来表示:
ρ=(C0-C)/C0×100%
式中:Q为Cd的吸附量(mg·g-1),C0为Cd的初始浓度(mg·L-1),ρ为吸附率(%),C为反应后上层清液中Cd的质量浓度(mg·L-1),L为溶液体积,m为吸附剂质量(mg)
1.3.2 等温吸附方程拟合模型
胡敏酸在碱性条件下对Cd的热力学吸附行为可以通过以下4种等温吸附方程进行拟合和表征:
Linear吸附模:G=α+K×C
Freundlich吸附模:G= K×Cn
Langmuir吸附模:G=G0×C/(C+K)Temkin吸附模型:G=a+K×lgC
式中:G为Cd在胡敏酸上的吸附量(mg·g-1);G0为Cd在胡敏酸上的最大吸附量(mg·g-1);C为平衡液中Cd质量浓度(mg·L-1);K、a、n为常数项。
1.3.3 动力学方程拟合模型
将计算所得到不同时段胡敏酸对镉的吸附量用如下的动力学方程进行拟合,寻求最优方程,以模型线性化的相关系数r大小判断模型优劣。
一级动力学方程:Log G=a+bt
抛物线方程:G=a+Bt1/2
Elovich方程:G=a+blnt
式中:G为Cd在胡敏酸上的吸附量(mg·g-1);t为反应时间(min);a、b为常数项
2 结果分析与讨论
2.1 等温吸附试验
等温吸附试验结果如图1、图2和表1所示。
从图1和图2可知,在其他条件相同的情况下,随着初始Cd2+质量浓度的增大,胡敏酸的吸附量也有增大的趋势,达到一定浓度后,趋于平衡。但是,吸附率却不与吸附量有相同的趋势。这是由于Cd的初始浓度的增加,吸附量、吸附率都随之增加。但超过一定值时,吸附量增加速度小于Cd的初始浓度的增加,吸附率成下降趋势。在其他条件相同的情况下,而且当初始浓度较低时,随着初始浓度的增加,吸附率增加的趋势也较为明显,当浓度超过一定限度时(40 mg·L-1),吸附率随浓度增加而迅速减小(Nagajyoti,等2010; Li等, 2011)。
胡敏酸对镉的等温吸附规律拟合结果见表1。可以看出Langmuir吸附模和Temkin吸附模型可以很好的拟合Cd初始浓度为40 mg·L-1、离子强度为0.01 mol·L-1、pH为8.5、25摄氏度下胡敏酸对镉的等温吸附,拟合方程分别为G= 10.5738C/(C+18.1534)和G=-1.0170+2.0648 lgC,相关系数r是0.9809和0.9816;Freundlich吸附模型拟合效果次之,拟合方程为G=1.6947C0.32889,相关系数r是0.9187;Linear吸附模型拟合结果是G=3.2692+0.0270C,相关系数r为0.7508,较其它3种模型,效果最差。

图1 镉离子的初始浓度对吸附量的影响Fig. 1 Influence of cadmium initial concentration on the adsorption ratio capacity
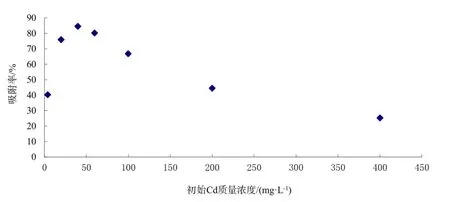
图2 镉离子的初始浓度对吸附率的影响Fig. 2 Influence of cadmium initial concentration on the adsorption ratio

表1 胡敏酸对镉的等温吸附线Table 1 Adsorption isotherms of cadmium on humic acid
2.2 吸附动力学实验
吸附动力学实验结果如图3和表2所示。
由该吸附量随时间的变化图(图3)得知,胡敏酸对镉的吸附过程大概可以分为3个阶段:第1个阶段为快速反应阶段,大概在前60 min就可以完成,在这个过程中,重金属离子很快被胡敏酸吸附,此时的吸附量为2.895 mg·g-1;第2个阶段为慢速反应阶段,随着时间的变化,吸附量的增加量变化很小,直至达到完全平衡,达到平衡的时间约为6 h,此时达到吸附量3.342 mg·g-1;第3个阶段为平衡后反应阶段,此阶段吸附达到平衡,基本维持动态最大吸附平衡。一般而言,在开始吸附时,随吸附时间的增加,吸附量会迅速增加;但当胡敏酸的吸附基本达到饱和时,吸附速度明显减慢;一旦达到吸附饱和,时间再增加,吸附量也不会再增加了,相反有时吸附时间过长反而会出现一定程度的离子“释放”现象,导致吸附量有稍微下降趋势(曾祥峰等, 2008)。
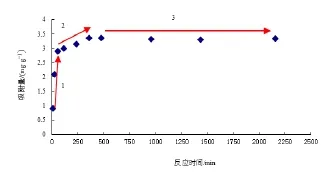
图3 反应时间对吸附量的影响Fig. 3 Influence of reaction time on the adsorption capacity

表2 胡敏酸吸附镉的动力学方程Table 2 Kinetic equations of cadmium adsorption on humic acid
对吸附反应平衡前6 h的动力学过程进行拟合,结果(表3)表明:从相关系数比较各方程对动力学吸附过程的拟合效果看,Elovich方程拟合较好,最终拟合方程为G=42.44376-6.48364 lnt,相关系数r为0.9285,达到较显著水平;而一级动力学方程和抛物线方程都不能很好的拟合胡敏酸对镉的吸附过程,相关系数也只有0.6505和0.5000。
2.3 pH值的影响实验
pH值的影响实验结果如图4所示。

图4 pH对吸附率的影响Fig. 4 Influence of pH on the adsorption ratio
由图4可以看出,pH对胡敏酸吸附重金属镉的影响很大,并呈现出一定的规律性,即随着pH增加,吸附率也逐步增加,这与以往的研究结果相同(李光林等, 2004; 朱丽琚等, 2008a)。但从图中我们也不难看出,吸附率随着pH的增加,有一定的阶段性,既在pH小于4.5时,随着pH的增加,吸附率迅速增加;而在pH处于4.5与8.5之间时,吸附率增加缓慢;当pH大于8.5时,随着pH的增加,吸附率又迅速增加,与以往的研究结果不尽相同。
胡敏酸吸附重金属镉与反应体系的pH和金属离子的价态有关(李光林等, 2004; Wang等, 2010)。随着pH值的增大,H+与金属离子竞争吸附位点能力下降且数目减少,使得原本被H+占据的结合位点被释放出来,胡敏酸对镉的吸附率增加;同时,随着pH值的增大,由于镉离子的表面电荷由二价变为一价,致使二级溶剂活化能大大减弱,从而减小能障,使镉离子更容易被胡敏酸吸附。当pH小于4.5时,随着pH增加,与镉离子竞争吸附位点的H+目减少,胡敏酸吸附镉的量迅速增加;当pH等于4.5时,在胡敏酸中占有主要地位的羧基被电离完全,此时羧基完全与Cd2+配位,此后由于其它少数基团,如酚羟基等被缓慢电离,吸附率增加缓慢;当pH增加到8.5时,Cd2+开始逐步与OH-配合形成一价的Cd(OH)+配合物,吸附率再次迅速增加,直至pH为11时,Cd(OH)+配合物达到峰值,而后形成Cd(OH)2沉淀。
2.4 离子强度的影响
离子强度对胡敏酸吸附镉的影响很大,其结果如图5所示。
从图上我们可以看出,在较低浓度离子强度下(离子强度小于0.01 mol·L-1时),随着离子强度的增加,胡敏酸对镉的吸附量有所增加;而当离子强度大于0.01 mol·L-1时,胡敏酸对镉的吸附量随着离子强度的增加而减小。在整个过程中,不同离子的作用大小不同;在相同的条件下,不同离子强度对胡敏酸吸附镉的影响大小为:氯化钙>氯化镁>氯化钾>氯化钠。
根据胡敏酸特有的大分子结构,以无机盐形式(以钠盐为例)溶解在溶液中可将其看作带负电荷的亲水胶体。外界加入Na+,会依靠静电引力中和电荷,胡敏酸胶体表面双电层厚度被压缩,镉离子更容易扩散进入其表面吸附点位,因此胡敏酸对镉的吸附量增加。然而,随着Na+进一步增加,负电性减弱的胡敏酸胶体发生团聚,导致胡敏酸分子结构空间阻碍镉离子络合,同时较多的Na+可与酚羟基(-OH)及弱酸性羧基(-OOH)形成弱酸性钠盐,占据络合位点,因此进一步增大溶液的离子强度使吸附量降低。
对于不同的阳离子,由于其所带电荷数的多少以及离子半径的大小等因素,影响吸附效果。Na+是一价离子且离子半径较小,影响较小;K+虽然也是一价离子,但其离子半径相对Na+大一些,影响比Na+大。实验结果也证明了这一点,既在较低浓度情况下(离子强度小于0.01 mol·L-1时),相同离子浓度的K+作用下的镉的吸附量较Na+作用下的吸附量要大;在较高离子强度下(离子强度大于0.01 mol·L-1时),相同离子浓度K+作用下的镉的吸附量较Na+作用下的吸附量要小(Kookana等, 1998; Bolan等, 2013)。Mg2+与K+半径大小接近,但具有+2价,因此Mg2+与K+相比,其对胡敏酸吸附镉的影响比K大(Yan等, 2005)。Ca2+与Cd2+半径相近,且都是二价离子,其影响要比Mg2+、K+、Na+都大(Sahai等, 1997; Borah等, 2011)。

图5 离子强度对胡敏酸吸附镉的影响Fig. 5 Influence of ionic concentration on the adsorption capacity
从这里我们不难看出,土壤在盐化的过程中,由于无机盐浓度的增加,离子强度增加,致使土壤胡敏酸等腐殖质吸附重金属的能力下降;另一方面,可溶性无机盐离子可以与重金属离子争夺腐殖质表面结合位点,使一部分被吸附固定的金属离子解吸出来,成为自由离子,增加了金属离子的生物可利用性,从而加大了重金属离子的生态风险。
3 结论
1)在碱性条件下,胡敏酸具有较强吸附镉的能力,吸附量和吸附率表现出不同的规律性。可以用Langmuir吸附模和Temkin吸附模型很好的拟合其等温吸附过程。
2)胡敏酸对镉的吸附过程可分为以分为60 min内的快速反应阶段,60 min至6 h间的慢速反应阶段,以及6 h后的动态吸附平衡阶段。对吸附反应平衡前6 h的动力学过程可以用Elovich方程进行很好的拟合。
3)pH对胡敏酸吸附重金属镉的影响很大,随着pH增加,吸附率表现出逐步增加趋势,并以pH为4.5和8.5为界,呈现两端增加速度快,中间增加慢的规律性。
4)在较低浓度离子强度下,离子强度的增加促进胡敏酸吸附镉;而在高离子强度下,表现出相反的规律性。不同离子的作用大小不同;在相同的条件下,不同离子强度对胡敏酸吸附镉的影响大小为:氯化钙>氯化镁>氯化钾>氯化钠。
5)土壤在盐化的过程中,由于无机盐浓度的增加,增加了重金属离子的生物可利用性,加大了重金属离子的生态风险。
BOLAN N, MAHIMAIRAJA S, KUNHIKRISHNAN A, et al. 2013. Sorption–bioavailability nexus of arsenic and cadmium in variable-charge soils[J]. Journal of hazardous materials, 261: 725-732.
BORAH J M, MAHIUDDIN S, SAERMA N, et al. 2011. Specific Ion Effects on Adsorption at the Solid/Electrolyte Interface: A Probe into the Concentration Limit[J]. Langmuir, 27: 8710-8717.
KHAN S, CAO Q, ZHENG YM, et al. 2008. Health risks of heavy metals in contaminated soils and food crops irrigated with wastewater in Beijing, China. Environmental pollution, 152: 686-692
KOOKAN R S, NAIDU R. 1998. Effect of soil solution composition on cadmium transport through variable charge soils[J]. Geoderma, 84: 235-248.
LI X, ZHOU Q, WEI S, et al. 2011. Adsorption and desorption of carbendazim and cadmium in typical soils in northeastern China as affected by temperature[J]. Geoderma, 160: 347-354.
LIU C C, CHEN G B. 2013. Reclamation of cadmium-contaminated soil using dissolved organic matter solution originating from wine-processing waste sludge[J]. Journal of hazardous materials, 244: 645-653.
NAGAJYOTI P C, LEE K D, SREEKANTH T V M. 2010. Heavy metals, occurrence and toxicity for plants: a review[J]. Environmental Chemistry Letters, 8(3): 199-216.
PAUGET B, GIMBERT F, COEURDASSIER M, et al. 2011. Use of chemical methods to assess Cd and Pb bioavailability to the snail Cantareus asperses: A first attempt taking into account soil characteristics[J]. Journal of hazardous materials, 192: 1804-1811.
RENELLA G, MENCH M, LANDI L, et al. 2005. Microbial activity and hydrolase synthesis in long-term Cd-contaminated soils[J]. Soil Biology and Biochemistry, 37: 133-139.
SAHAI N, SERJENSKY D A. 1997. Solution and electrostatic model for specific electrolyte adsorption[J]. Geochimica Cosmochimica Acta, 61: 2827-2848.
SILVA M E F, DE LEMOS L T, NUNES O C, et al. 2013. Correlation Between Humic-Like Substances and Heavy Metals in Composts. In Functions of Natural Organic Matter in Changing Environment [J]. Springer Netherlands: 511-516
WANG Y, QIAO M, LIU Y, et al. 2012. Health risk assessment of heavy metals in soils and vegetables from wastewater irrigated area, Beijing-Tianjin city cluster, China[J]. Journal of Environmental Sciences, 24: 690-698.
WANG Z, ZENG X, YU X, et al. 2010. Adsorption behaviors of Cd2+on Fe2O3/MnO2and the effects of coexisting ions under alkaline conditions[J]. Chinese Journal of Geochemistry, 29: 197-203.
YAN C, XUE D, ZOU L, et al. 2005. Preparation of magnesium hydroxide nanoflowers[J]. Journal of Crystal Growth, 282: 448-454.
YANG S, HU J, CHEN C, et al. 2011. Mutual effects of Pb (II) and humic acid adsorption on multiwalled carbon nanotubes/polyacrylamide composites from aqueous solutions[J]. Environmental science & technology, 45: 3621-3627.
ZHANG S, LI T, ZHANG X, et al. 2013. Changes in pH, dissolved organic matter and Cd species in the rhizosphere soils of Cd phytostabilizer Athyrium wardii (Hook.) Makino involved in Cd tolerance and accumulation[J]. Environmental Science and Pollution Research: 1-9.
邓红梅, 陈永亨. 2010. 腐殖酸对污染土壤中铊赋存形态的影响[J]. 环境化学, (1): 35-38.
范文宏, 陈俊, 王琼. 2007. 胡敏酸对沉积物中重金属形态分布的影响[J]. 环境化学, 26(2): 224-227.
李光林, 魏世强, 青长乐. 2004. 镉在胡敏酸上的吸附动力学和热力学研究[J]. 土壤学报, 41(1): 74-80.
苏慧, 魏树和, 周启星. 2013. 镉污染土壤的植物修复研究进展与展望[J]. 世界科技研究与发展, 35(3): 315-319.
孙约兵, 徐应明, 史新, 等. 2012. 污灌区镉污染土壤钝化修复及其生态效应研究[J]. 中国环境科学, 32(8): 1467-1473.
谭科艳, 刘晓端, 汤奇峰, 等. 2011. 华北平原土壤环境重金属元素分布规律及其意义[J]. 地球学报, 32(6): 732-738.
王祖伟, 张辉. 2005. 天津污灌区土壤重金属污染环境质量与环境效应[J]. 生态环境, 14(2): 211-213.
徐良将, 张明礼, 杨浩. 2011. 土壤重金属镉污染的生物修复技术研究进展[J]. 南京师大学报: 自然科学版, 34(1): 102-106.
曾祥峰,张凯,于晓曼,等. 2008. 碱性盐化条件下伊利石和蒙脱石对镉的吸附解析特征研究[J]. 农业环境科学学报, 27: 2251-2257
张晶, 于玲玲, 辛术贞, 等. 2013. 根茬连续还田对镉污染农田土壤中镉赋存形态和生物有效性的影响[J]. 环境科学, 34(2): 685-691.
张小敏, 张秀英, 钟太洋, 等. 2014. 中国农田土壤重金属富集状况及其空间分布研究[J]. 环境科学, 35(2): 692-703.
朱丽琚, 张金池, 俞元春, 等. 2008a. 胡敏酸吸附重金属Pb2+、Cu2+、Cd2+的特征及影响因素[J]. 农业环境科学学报, 27(6): 2240-2245.
朱丽琚, 张金池, 胡书燕, 等. 2008b. Pb2+、Cu2+、Cd2+在胡敏酸上的吸附和竞争吸附[J]. 安全与环境学报, 8(6): 22-26.
Adsorption Features of Cadmium by Humic Acid in Alkaline Conditions
ZENG Xiangfeng1,3*, WANG Zuwei2, Wei Shuhe1, YU Xiaoman1,3
1. Key Lab on Pollution Ecology and Environmental Engineering, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China; 2. College of Urban and Environment Science, Tianjin Normal University, Tianjin 300384, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China
In order to investigate the adsorption mechanism of cadmium on humic acid in alkaline condition and understand cadmium contamination mechanisms and its relationship with the ecological environment in alkaline saline soil, the adsorptions of cadmium on humic acid were studied by experiment in alkaline conditions. The different effect of initial concentration, reaction time, different pH and ionic strength on the adsorption of cadmium by humic acid were investigated though batch adsorption test methods. The results indicated that, humic acid had strong cadmium adsorption ability. Langmuir and Temkin adsorption models were well fitted isotherm adsorption process (r are 0.9809 and 0.9816). The adsorption capacities at the rapid response period within 60 minutes and the slow reaction within 60 minutes to 6 hours, are 2.895 mg·g-1and 3.342 mg·g-1, respectively. The process before the adsorption reaction reached equilibrium state can be well described by the Elovich equation (r = 0.9285). As the pH increased, the adsorption rate showed a gradual increasing trend, and had two boundaries at pH 4.5 and 8.5, respectively. In low ionic concentration, ionic strength can be increased to promote cadmium adsorption on humic acid. However, the opposite regularity was represented in high ionic concentration. Under the same test conditions, the different ionic strengths affect the abilities of humic acid adsorption of cadmium as follow: calcium chloride>magnesium chloride>potassium chloride> sodium chloride. The bioavailability and the ecological risk of heavy metals are increased during the soil salinization process, due to the increase in salt concentration.
humic acid; cadmium; isotherm adsorption; pH; inorganic salts
X53
A
1674-5906(2014)10-1691-06
曾祥峰,王祖伟,魏树和,于晓曼. 碱性条件下胡敏酸吸附镉的特征研究[J]. 生态环境学报, 2014, 23(10): 1691-1696.
ZENG Xiangfeng, WANG Zuwei, Wei Shuhe, YU Xiaoman. Adsorption features of cadmium by humic acid in alkaline conditions [J]. Ecology and Environmental Sciences, 2014, 23(10): 1691-1696.
国家自然科学基金项目(40930739;41071304;21277150);沈阳市科技计划项目(F13-067-2-00);中华环境保护基金会格平绿色行动辽宁环境科研教育“123工程”项目(CEPF2011-123-1-1)
曾祥峰(1984年生),男,博士,主要从事污染物迁移转化规律研究。E-mail:shidalvwo@126.com。*通信作者
2014-07-30
