微囊藻毒素对真菌和哺乳动物细胞毒害效应的研究
2014-02-25陈惠苑张郅灏黄艺
陈惠苑,张郅灏,黄艺
1. 北京大学环境科学与工程学院,北京 100871;2. 北京大学深圳研究生院,广东 深圳 518055
微囊藻毒素对真菌和哺乳动物细胞毒害效应的研究
陈惠苑2,张郅灏2,黄艺1,2
1. 北京大学环境科学与工程学院,北京 100871;2. 北京大学深圳研究生院,广东 深圳 518055
主要探讨微囊藻毒素对真菌和哺乳动物细胞的毒害效果,以及其作为水体生理毒害评价模式细胞的可能。通过毒性试验和单细胞凝胶电泳实验,利用栗酒裂殖酵母细胞(S.pombe),人肝癌细胞(HepG2)和人脑星形胶质母细胞癌细胞(U87)3种生物模型评估MC对细胞DNA的损伤以及对细胞内氧化自由基水平的影响。并利用栗酒裂殖酵母的基因缺失体,判断MC所诱导的酵母细胞氧化应激路径。研究表明MC通过氧化路径诱导DNA损伤;缺失wis1△和pap1△基因的S.pombe细胞无法诱导ROS生产,wis1△和pap1△缺失型S.pombe细胞在40 mg·L-1-1MC暴露24 h下细胞增殖率仅下降7.3%、7.7%;氧化损伤是MC损伤S.pombe的主要方式;HepG2细胞和U87细胞较S.pombe细胞适于研究、评估MC的毒性。
MC;栗酒裂殖酵母;肝细胞;神经细胞;细胞毒性;基因损伤
微囊藻毒素(Microcystin,MC)是自然水体中存在最普遍的对人体健康危害最大的一类藻毒素。MC为7个氨基酸组成的环状多肽,因多肽中可变氨基酸组成的不同,又分为MC-LR、MC-RR、MC-YR等。其中,MC-LR和MC-RR是我国天然水体中检出率最多和含量最高的MC类型(宋立荣等,1999;闫海等,2002)。MC对生物细胞毒害的毒害主要有:直接破坏细胞结构,引发细胞溶解;诱导细胞凋亡(Dietrich和Hoeger,2005);诱导细胞癌变(张萍等,2009);诱导基因突变和DNA损伤等(Gaudin等,2008)。
现在制定的水质标准,一般以水体中污染物的浓度作为基础,如OECD给出的饮用水标准中,微囊藻毒素的标准是不大于0.001 mg·mL-1。然而,许多研究显示,实验室内溶于水的微囊藻毒素和在自然水体中的微囊藻毒素对于生物和人体的毒性强度有很大的不同(王伟琴,2010)。这就使得以浓度为基础制定的水质标准,在水体的健康风险控制和管理方面,具有一定的局限性。如果能找到直接对水体中的微囊藻毒素有明显和容易观察的毒性反应,且容易培养易于操作的指示生物,用于检测和评价水体微囊藻毒素的生物毒害,对于自然水体的健康风险评估和管理,具有重要的理论意义和应用价值。
栗酒裂殖酵母细胞拥有已知最小的真核生物基因组,且没有大范围基因重复,其中有约145个基因在后生动物中有同源基因,50个基因与人类致病基因显著相似,其中25个基因和致癌因子相关,与人类在进化上相似。可见其适合作为真菌毒害效应实验的代表细胞(Wood V等,2003)。人体肝癌细胞来源于肝细胞,表型与肝细胞极为相似并保留了肝细胞大部分生物学特性(陈秋等,2005)。人脑星形胶质母细胞癌细胞是神经胶质瘤细胞中常用的动物模式细胞之一(Marie T等,2014)。因此,该论文选择与人体细胞同源性较高的栗酒裂殖酵母细胞,以及微囊藻毒素直接作用的人体神经和肝细胞,通过彗星实验观察细胞受损程度,研究其对不同浓度微囊藻毒素MC的毒性反应,并对这3种生物细胞的DNA损伤和氧化应激效应进行初步研究,探讨其成为快速检测和评价水体微囊藻毒素生物毒害指示生物的可能性。
1 材料与方法
1.1 实验材料
人体肝癌细胞(HepG2)和人脑星形胶质母细胞癌细胞(U87),由陕西师范大学夏海滨教授馈赠;野生型栗酒裂殖酵母菌株(Schizosaccharomyces pombe,简称S. pombe)以及缺失型spc1△、atf1△、pmk1△、wis1△和pap1△ S.pombe细胞均由美国加州大学戴维斯分校Kazshiozaki教授馈赠。微囊藻毒素标准品(Microcystin-LR,Microcystin-RR),购于瑞士Alexis公司。
细胞培养:HepG2和U87细胞,按Kataoka等(2010)陈述的条件进行培养。S. pombe细胞按Methods in Enzymology(1991)中介绍的方法培养。3种细胞暴露在MC-LR中培养24 h后,进行凝胶电泳实验;
S. pombe细胞去壁:使用Zymolyase 20T生物酶将细胞壁消化溶解,获得S. pombe原生质体。具体方法参照Lantermann等(2009)的S.pombe破壁方法。
1.2 单细胞凝胶电泳(彗星实验)
将110 μL的0.8%正常熔点琼脂糖凝胶(Normal Melting Point Agarose Gel, NMP)滴于全磨砂载波片上,其后用盖玻片平铺盖上。于4 ℃固定5 min后,轻轻移走盖玻片;取10 μL经破壁的细胞悬浊液和65 μL 1.0%低熔点琼脂糖凝胶(Low Melting Point Agarose Gel, LMP),在37 ℃水浴中进行混合后,滴于第一层NMP上,盖上盖玻片,于4 ℃固定5 min,其后移走盖玻片。将覆有2层胶的载玻片放入细胞裂解液中,静置2 h后,再移入4 ℃电泳缓冲液中,浸泡20 min;将载玻片移出,再放入装有电泳缓冲液的电泳槽中,通过调节液面,使电流为300 mA,电压为30V(0.86Vcm),4 ℃电泳20 min;电泳后,将载玻片放入TE缓冲液,浸泡15 min;e.取出载玻片,在每块凝胶上加入40 μL的20 μg·mL-1EB染液,晾干;正置荧光显微镜观察并拍照。
1.3 实验过程
以终浓度为0、1、2、5、10、20、40 mg·L-1的MC-LR分别处理96孔板内的对数期S. pombe细胞、HepG2细胞和U87细胞。然后将细胞置于30 ℃,200 rmp的恒温震荡培养箱中培养。于0、 2、4、6、8、10、12、14 h测定S. pombe的OD600值;于0、24、48、72 h测定以MTT法测定HepG2细胞和U87细胞的细胞活性,试验重复5次。以上操作均在无菌环境下进行。
将分S.pombe细胞、HepG2细胞和U87细胞分别暴露于浓度为5 mg·L-1和40 mg·L-1的MC-LR 6 h,然后通过单细胞凝胶电泳分别测定和计算3种细胞的DNA尾长、尾DNA百分比、尾距及Oliver尾矩,研究MC-LR对DNA对损伤。
将野生型S.pombe细胞和缺失型spc1△、atf1△、pmk1△、wis1△和pap1△ S.pombe细胞分别暴露于浓度为5 mg·L-1与40 mg·L-1的MC-LR下24 h,观察增殖率和ROS荧光强度,分析MC-LR对细胞内氧化自由基的诱导程度。
2 结果
前期实验表明,MC-LR与MC-RR对栗酒裂殖酵母细胞、人体神经和肝细胞的毒性基本一致,生长率差在24 h内低于0.5%。MC-LR与MC-RR浓度越高,对细胞生长差异越大。当暴露浓度为40 mg·L-1,暴露时间达到14 h时,MC-LR与RR对3种细胞的生长抑制的差异低于2.5%。因此,在后续生物毒性和毒性机理研究中,只对MC-LR一种物质做暴露实验。
2.1 MC-LR对细胞活性的影响
不同浓度的MC-LR对S.pombe细胞的生长影响不同,见图1、表1。当S.pombe暴露于浓度低于5 mg·L-1的MC-LR时,抑制效果在8 h处达到顶点,随后缓慢回落。浓度为10 mg·L-1的MC-LR对S.pombe生长抑制效果顶点为暴露后8 h,最大抑制率11%,随后抑制率则迅速回落,在14 h时降至1%。20 mg·L-1、40 mg·L-1的MC-LR对S.pombe细胞在14 h内持续被抑制,最终抑制率分别达到21%和16%。不同浓度MC-LR作用下的S.pombe细胞生长率在各时间段p值均小于0.05,说明数据具有统计学意义。
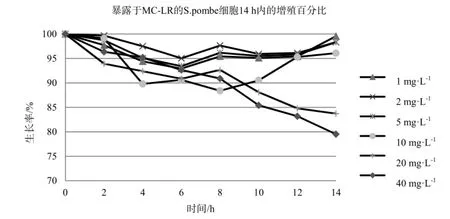
图1 暴露于MC-LR的S.pombe细胞14 h内的增殖百分比Fig. 1 Growth rate of S. pombe treated with MC-LR in 14 h

表1 S.pombe细胞在不同浓度MC-LR作用2、4、6、8、10、12、14 h的方差分析结果Table 1 Variance analysis of S.pombe cell treated with MC-LR in 2, 4, 6, 8, 10, 12, 14 h
不同浓度的MC-LR能促进HepG2细胞的增值,且呈时间剂量反应关系,不同浓度MC-LR作用下的HepG2细胞生长率在各时间段p值均小于0.05,说明数据具有统计学意义。如图2、表2。HepG2细胞在暴露于40 mg·L-1的MC-LR72 h后,细胞活性增涨了15%,20 mg·L-1及10 mg·L-1处理组的增长率也分别达到5%和8%。低剂量组MC-LR对HepG2细胞生长的影响基本一致,在72 h内都未出现显著的抑制或促进作用。

图2 暴露于MC-LR的HepG2细胞72 h内的增殖百分比Fig. 2 Growth rate of HepG2 treated with MC-LR in 72 h
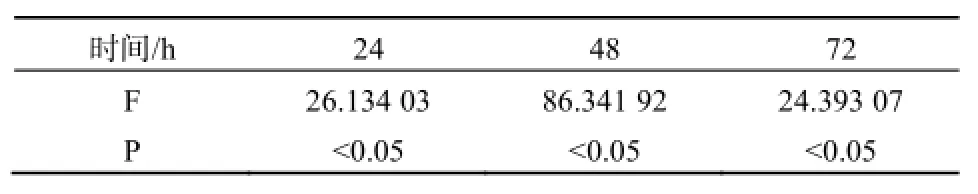
表2 HepG2细胞在不同浓度MC-LR作用24、48、72 h的方差分析结果Table 2 Variance analysis of HepG2 cell treated with MC-LR in 24, 48, 72 h
不同浓度的MC-LR能抑制U87细胞的增值,且呈剂量反应关系,不同浓度MC-LR作用下的HepG2细胞生长率在各时间段p值均小于0.05,数据具有统计学意义,如图3、表3。暴露于40 mg·L-1的MC-LR 24 h,U87细胞活性明显降低,抑制率为20%,随后抑制率则随时间延长而不断下降,72 h暴露终点处的抑制率为16%。20 mg·L-1MC-LR处理组的抑制率也在24 h达到顶点,为12%,随后不断下降。其余低剂量组抑制现象并不明显,最高抑制率均在10%以内。显微镜下观察暴露72 h后的U87细胞,随处理浓度的增加,活细胞数与活细胞数占总细胞的百分比均明显下降。死亡细胞形态由纤维状变为规则球体,其形态特征与凋亡一致,因此MC-LR是通过诱导U87凋亡而导致其死亡的。经MC-LR处理后72 h后的U87细胞计数结果显示見表4,随着MC-LR处理浓度的提升,同视野内的U87总细胞数和活细胞数都呈下降趋势,细胞存活率也不断降低。
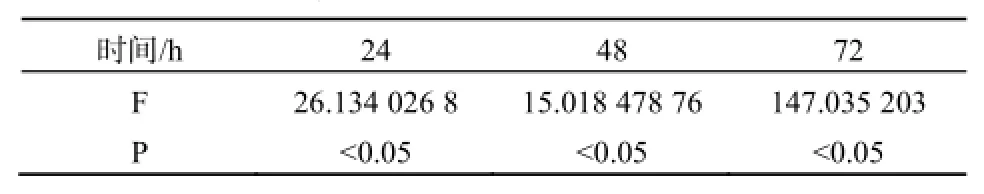
表3 U87细胞在不同浓度MC-LR作用24、48、72 h的方差分析结果Table 3 Variance analysis of U87 cell treated with MC-LR in 24, 48, 72 h
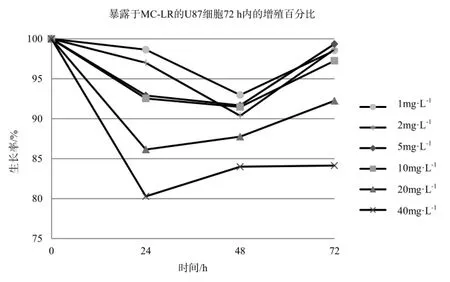
图3 暴露于MC-LR的U87细胞72 h内的增殖百分比Fig. 3 Growth rate of U87 treated with MC-LR in 72 h

表4 MC-LR处理U87细胞24 h后活细胞及凋亡细胞计数Table 4 Number of live and apoptotic U87 cell treated with MC-LR after 24 h
2.2 MC-LR对DNA的损伤
通过单细胞凝胶电泳实验又称为彗星实验,是一种在单细胞水平上检测真核细胞DNA损伤的方法(蔡丽敏和李雪峰,2011)。该方法将待检测细胞埋于LMP,通过细胞裂解液破坏细胞膜和细胞核膜,使得细胞内的蛋白质、脂质和细胞质等成分经由凝胶扩散进入裂解液中,胞内DNA仍附着在原位的核骨架上。若检测细胞DNA未受损伤,经电泳后无拖尾现象;若细胞DNA受损,断裂的DNA片段便会扩散进入凝胶,经电泳后向阳极定向迁移,形成形似彗星的拖尾,且受损程度越高,拖尾越长,比例也越高。正置荧光显微镜以红光波长范围535 nm下检测经过处理的细胞,照相。使用CASP软件分析受损DNA,对DNA尾长、尾DNA百分比、尾距及Oliver尾矩4个指标进行图像分析(朱志良等,2011)来评价细胞DNA的损伤。因为该方法观察了DNA的受损情况,是检测化学物质“三致”效应的有效方法。
在前期生长实验结果显示,3种细胞在低剂量(1、2、5 mg·L-1)和高剂量(20、40 mg·L-1)MC-LR暴露下,抑制情况有明显差异。故选取暴露于5 mg·L-1、40 mg·L-1的MC-LR 6时后,分别检测S.pombe细胞、HepG2细胞和U87细胞的DNA尾长、尾DNA百分比、尾距及Oliver尾矩变化,并列于表5。
经MC-LR暴露后,3种细胞的DNA尾长、尾DNA百分比、尾距及Oliver尾矩都有一定增大。如当MC-LR浓度增加8倍的时候,S.pombe细胞的尾长增加一倍。这些结果表明,彗星实验能明确显示出MC-LR对3种细胞所产生的DNA损伤,由Olive尾矩和尾距所表达的损伤作用随剂量的增加而增加,有明显的剂量响应关系。其中,HepG2细胞和U87细胞所表达的剂量响应关系更加明确。
ROS荧光检测探针DHE方法是利用可自由通过活细胞膜进入细胞的二氢乙啶,被活细胞摄入后,可在细胞内的ROS作用下脱氢,产生溴化乙锭。溴化乙锭可以和RNA或DNA结合产生红色荧光。当细胞内ROS水平较高时,产生的溴化乙锭较多,红色荧光就较强,表示细胞氧化损伤较大,反之则较弱。利用荧光显微镜观察活细胞中红色荧光可以判断细胞内ROS生成的多少。利用ROS荧光检测探针DHE观察暴露于浓度为5 mg·L-1、40 mg·L-1的MC-LR 24 h后,S.pombe细胞、HepG2和U87细胞内ROS的变化趋势结果见图4。
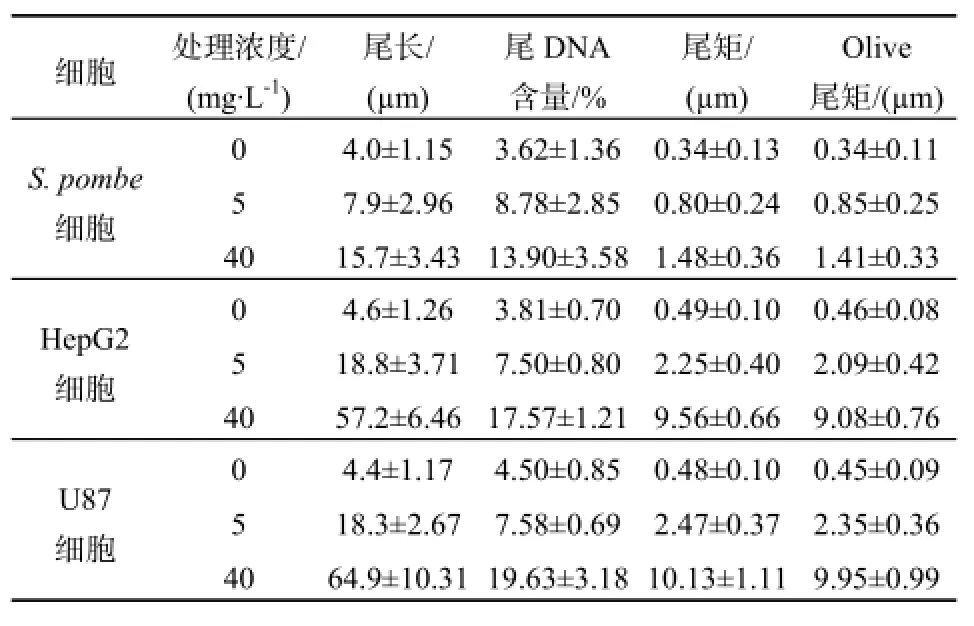
表5 MC-LR对S. pombe细胞、HepG2细胞和U87细胞的DNA损伤Table 5 DNA damage induced by MC-LR on S. pombe, HepG2 and U87

图4 S.pombe、HepG2及U87细胞经MC暴露24 h后的ROS表征Fig. 4 ROS characterization in S.pombe, HepG2 and U87 treated with MC-LR after 24 h
MC-LR处理24 h后,S.pombe细胞内荧光强度增强,ROS水平增加,但不同剂量的MC暴露对细胞内荧光强度影响不显著;HepG2细胞荧光强度明显高于对照组,且高剂量暴露细胞荧光强度显著高于低剂量MC暴露细胞,可见细胞内ROS量随MC剂量增加而增大,MC对HepG2细胞的损害随剂量增加而增大;低剂量暴露的U87细胞内荧光面积大于对照组,高剂量暴露的U87细胞内荧光面积更为集中,荧光强度更强,可见MC对U87细胞DNA的损害作用显著。
3种细胞内ROS均高于空白对照,随着暴露剂量增加,荧光强度明显增强,具有一定的剂量响应关系。其中HepG2细胞与U87细胞对MC诱导细胞内ROS较S.pombe细胞敏感。
2.3 MC-LR对细胞内氧化自由基的诱导
自由氧化剂是机体氧化反应中产生的具有强氧化性,可损伤机体组织和细胞,引起慢性疾病和衰老的有害化合物。该实验通过对缺失spc1△、atf1△、pmk1△、wis1△和pap1△的S.pombe细胞暴露在MC-LR下的增殖率以观察MC-LR诱导S.pombe细胞中生成ROS过程中是否涉及蛋白激酶或者氧化应激响。
5 mg·L-1与40 mg·L-1的MC-LR作用于S.pombe细胞及其缺失性突变体24 h后的细胞增殖率如图5所示。

图5 缺失型S.pombe突变体细胞经MC-LR暴露后的增殖率(p<0.05)Fig. 5 Cell viability of S.pombe treated with different sizes of MC-LR compared with the control group (p<0.05)
在40 mg·L-1MC暴露24 h下,野生型S.pombe、缺失型spc1△、atf1△、pmk1△、wis1△和pap1△的细胞增殖率均受到显著性抑制(p<0.05),分别为未暴露环境下S.pombe细胞的80.4%、78.2%、81.3%、78.8%、92.7%、92.3%。其中,缺失型wis1△和pap1△的细胞增殖率差异较少,说明S. pombe缺失型wis1△和pap1△较野生型及其他S. pombe缺失型对MC-LR的耐受性更强,而S.pombe缺失型spc1△和pmk1△较野生型及其他S.pombe缺失型对MC-LR更为敏感。
经DHE染色的结果见图6。
野生型和缺失型spc1△、atf1△、pmk1△的ROS荧光水平均有明显差异,表明细胞受到氧化损伤。同时,在MC-LR暴露下,wis1△和pap1△的ROS荧光水平并不明显。与生长实验结果一致。
3 讨论
3.1 MC-LR对3种细胞的损伤作用
本实验通过单细胞凝胶电泳实验观察暴露在MC-LR的S.pombe细胞、HepG2细胞和U87细胞的损伤。经MC-LR暴露后,40 mg·L-1组较空白对照DNA的尾长、尾矩以及Oliver尾矩,S.pombe细胞分别增加11.7像素,1.14像素和1.07像素;HepG2细胞分别增加52.6像素,9.07像素及8.62像素;U87细胞分别增加60.5像素,10.65像素及9.50像素。其中,S.pombe细胞的尾长变化对细胞内ROS增量较其他指标敏感。HepG2细胞和U87胞的DNA损伤程度较S.pombe细胞显著,主要体现在在尾距和Olive尾距的显著增值。经过浓度为40 mg·L-1的MC-LR暴露处理后的S.pombe细胞尾距、Olive尾距分别是空白组的19.5倍、19.7倍,低剂量暴露组的4.2倍、4.3倍;U87细胞尾距、Olive尾距分别是空白组的21.1倍、22.1倍,低剂量暴露组的4.1倍、4.2倍。可见彗星实验中的尾距和Olive尾距2项指标可以较为敏感的指示细胞中DNA,并能明显表达MC损害与剂量的关系,随MC暴露剂量的增加细胞损伤更严重。

图6 S.pombe突变体经MC-LR暴露后的ROS表征Fig. 6 ROS characterization of S.pombe mutants incubated with MC-LR after 24 h
3.2 MC造成细胞损伤的途径
经MC-LR处理的3种细胞内荧光强度均明显增强,细胞内ROS增加,说明MC可以诱导ROS生成。暴露于MC-LR的细胞内都有大量氧化自由基,可以认为MC-LR是通过氧化路径诱导DNA损伤的。HepG2较S.pombe细胞与U87细胞对MC诱导细胞内ROS敏感。Yan2012年关于MC-LR对大鼠睾丸支持细胞的研究结论表明,暴露在MC-LR环境下能增加大鼠睾丸支持细胞内ROS,直接导致大鼠的生殖毒性(Li和Han,2012)。Ding和Ong(2003)研究活体小鼠在暴露于MC后,肝组织细胞的变化,结果显示,小鼠肝细胞内有ROS生成,并引发线粒体通透性转化(MPT),最终导致肝细胞凋亡。可见,HepG2细胞是研究MC诱导ROS能力的理想模式细胞。而进一步研究U87细胞对MC诱导ROS的敏感性,可以深入研究U87在研究MC毒效的适用性,并深入MC对人体健康的威胁,明确其对人体神经组织的毒害效果,因此U87细胞也适用于研究MC诱导ROS的能力。
3.3 MC-LR诱导细胞内氧化自由基路径初探
大量研究证实,当S. pombe受到外界环境的氧化压力时,为响应环境压力,细胞会激活细胞中2种主要的氧化应激响应途径来调控分裂素原活化蛋白激酶(MAPK)。S. pombe主要有2种涉及氧化应激调控的促分裂素原活化蛋白激酶(MAPK),包括与人类MAPK p38具有同源性的Spc1与为细胞外调节蛋白激酶(ERK)相关的Pmk1,其编码基因分别为参与Sty1p-Atf1p MAP激酶路径spc1(又称sty1或phh1)和参与Mkh1p-Pek1p-Spm1p MAP激酶路径pmk1(又称spm1)(Wang,Gulis,Buckner等,2010)。atf1基因是编码蛋白Spc1/Sty1的转录因子,参与氧化应激响应中的Sty1p-Atf1p MAP激酶路径(Lawrence,Caroline,Wilkinson,2009);pap1基因是通过由半胱氨酸残基修饰细胞核定位因子来激活的转录因子(Mutoh,Nakagawa,Ando,1991),参与细胞Sty1p-Atf1p MAP激酶路径的调控;wis1基因能编码丝裂原活化蛋白激酶Spc1激酶MAPKK,在细胞的环境压力响应中常被激活。DHE染色结果显示缺失型spc1△、pmk1△的ROS荧光水平差异最明显。同时,在MC-LR暴露下,wis1△和pap1△的ROS荧光水平并不明显。MC暴露下,基因缺失型细胞wis1△和pap1△的生长率高于野生型S. pombe,且ROS水平明显下降。与生长实验的结果相符。可以认为MC-LR对缺失wis1△和pap1△基因的S.pombe细胞毒性较弱,无法在细胞内诱导产生氧化自由基,这也进一步说明了氧化损伤是MC损伤S.pombe的主要方式。因此,wis1△和pap1△路径极可能是MC-LR诱导S.pombe细胞内产生ROS的路径。
3.4 水体中MC生物毒性的模式细胞的挑选
从对细胞角度活性角度看,S. pombe细胞经暴露8 h内,生长情况一致,8 h后各浓度MC-LR对其生长抑制情况产生分化。从细胞活性的角度来看,S.pombe细胞的生长对MC比较敏感,适合作为研究MC细胞毒性的模式细胞。MC-LR暴露72 h后的HepG2细胞,各浓度处理的死亡细胞均较少,且MC-LR浓度越高,HepG2的最终细胞数越多。这与施玮(2002)以原代肝细胞为基础的研究结果相似,施玮认为HepG2细胞生长加快的原因极可能是因为MC-LR促进了细胞的去分化,使细胞提前启动进入增殖阶段。MC-LR能促进HepG2细胞的增值,因此HepG2细胞不适于以抑制细胞生长为指标的MC毒害作用研究。MC-LR能抑制U87细胞增值同时诱导U87细胞凋亡,0~24时变化最为明显。处理U87细胞24 h后细胞凋亡率随MC浓度增加而增加,有一定的剂量关系,U87细胞的生长对MC敏感,适合作为研究MC细胞毒性的模式细胞,实验的最佳暴露时间为24 h。
由于S.pombe细胞的细胞壁对EB染料进入细胞有阻碍作用,在荧光条件下难以观察到DNA,经单细胞凝胶电泳后,S.pombe细胞的DNA荧光信号极弱,每1000个细胞只有将近20个有荧光反应。虽然实验中有去除细胞壁的过程,但现有技术难以有效反映S.pombe细胞DNA受损的真实情况。另外,S.pombe细胞的DNA量较小,这也使它的彗星拖尾难以观察。因此S.pombe细胞不适于研究MC损伤DNA的能力。而HepG2细胞和U87细胞的DNA对MC十分敏感,低剂量的暴露条件下也呈现出较为明显的彗星现象。随着暴露剂量的提高,彗星现象也越为明显,4项表征DNA受损程度的指标都表现出剂量反应关系,其中尾距和Olive尾距两项指标更为显著。因此,利用HepG2细胞与U87的彗星实验,可能是理想的评估水体中MC生物毒性的模式细胞。
4 实验主要结论
(1)MC通过诱导ROS生成导致细胞损伤。
(2)MC-LR诱导S.pombe细胞内产生ROS的路径极可能是wis1△和pap1△路径。
(3)HepG2细胞与U87细胞适合作为水体中MC生物毒性评估的模式细胞。
参考文献:
A KLAR, P NURSE. 1991. Methods in Enzymology [56] Molecular genetic analysis of fission yeast Schizosaccharomyces pombe S. Moreno [J]. Methods Enzymol, 194: 795-823.
ALEXANDRA L, ANNELIE S, FREDRIK F, et al. 2009. Genome-wide mapping of nucleosome positions in Schizosaccharomyces pombe [J]. Methods, 48(3): 218-225
CLARE L. L, NIC J, CAROLINE R.M. W. 2009. Stress-Induced Phosphorylation of S. pombe Atf1 Abrogates Its Interaction with F Box Protein Fbh1 [J]. Current Biology, 19(22): 1907-1911.
DANIEL D, STEFAN H. 2005. ISSN 0041-008X. Guidance values for microcystins in water and cyanobacterial supplement products (blue-green algal supplements): a reasonable or misguided approach?, Toxicology and Applied Pharmacology [M]. 203(3): 273-289.
DING W X, ONG C N. 2003. Role of oxidative stress and mitochondrial changes in cyanobacteria induced apoptosis and hepatotoxicity [J]. FEMS Microbiology Letters, 20: 1-7.
JULIEN G, SYLVIE H, GÉRARD J, et al. 2008. In vivo DNA damage induced by the cyanotoxin microcystin-LR: Comparison of intra-peritoneal and oral administrations by use of the comet assay [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 652(1): 65-71.
MARIE T, MAXIMILIEN V, et al. 2014. Experimental use of photodynamic therapy in high grade gliomas: A review focused on 5-aminolevulinic acid [J]. Photodiagnosis and Photodynamic Therapy, 11(3): 319-330.
NORIHIRO M, CHIAKI W. N, SHOJI A, et al. 1991. Cloning and sequencing of the gene encoding the large subunit of glutathione synthetase of Schizosaccharomyces pombe, Biochemical and Biophysical Research Communications [J]. 181(1): 430-436.
WOOD V, GWILLIAM R, RAJANDREAM M A, et al. 2003. The genome sequence of Schizosaccharomyces pombe [J]. Nature, 421(6918): 94.
YAN L, XIAODONG H. 2012. Microcystin–LR causes cytotoxicity effects in rat testicular Sertoli cells, Environmental Toxicology and Pharmacology [J]. 33(2): 318-326.
YASUSHI K, JEFFREY S, NIKOLAI N, et al. 2002. Activation of the nuclear transcription factor κB (NFκB) and differential gene expression in U87 glioma cells after exposure to the cytoprotector amifostine [J]. International Journal of Radiation Oncology Biology Physics, 53(1): 180-189.
YIWEI W, GALINA G, SCOTT B, et al. 2010. The MAP kinase Pmk1 and protein kinase A are required for rotenone resistance in the fission yeast, Schizosaccharomyces pombe [J]. Biochemical and Biophysical Research Communications, 399(2): 123-128.
陈秋, 夏永鹏, 邱宗荫. 2005. 胰岛素耐受的HepG2细胞模型建立[J].细胞生物学杂志, 03:334-338.
蔡丽敏, 李雪峰. 2011. 单细胞凝胶电泳技术在DNA损伤和细胞凋亡检测中的应用[J]. 华南师范大学学报(自然科学版), 3: 113-117.
施玮, 朱惠刚, 晏晓蓉, 等. 2002. 微囊藻毒素MC-LR对原代肝细胞的影响[J]. 环境与职业医学, 03: 129-131.
宋立荣, 雷腊梅, 何振荣, 等. 1999. 滇池水华蓝藻铜锈微囊藻和绿色微囊藻的生长生理特性及毒素分析[J]. 水生生物学报, 05: 402-408.
王伟琴. 2010. 饮用水源水中微囊藻毒素的遗传毒性与健康风险评价[D]. 浙江大学.
闫海, 潘纲, 张明明. 2002. 微囊藻毒素研究进展[J]. 生态学报, 11: 1968-1975.
张萍, 钟儒刚, 崔海信, 等. 2009. 微囊藻毒素诱发癌症的作用机制研究进展[J]. 癌变. 畸变. 突变, 01: 70-73.
朱志良, 庄志雄, 黄钰, 等. 2001. 单细胞凝胶电泳图像分析系统的研制及应用[J]. 中华劳动卫生职业病杂志, 04: 62-64.
Toxic Effects of Two Kinds of Microcystin to Fungus and Mammalian Cells
CHEN Huiyuan2, ZHANG ZhiHao2, HUANG Yi1,2
1. College of Environmental Sciences and Engineering, Peking University, Beijing 100871, China; 2. Peking University Shenzhen Graduate School, Shenzhen 518055, China
s: To research the toxic effect of microcystin exerting to fungus and mammalian cells, and to explore the potential model cell for biological toxicity assessment of eutrophication water body, several biological indicators are defined in this study to test the influence of MC on DNA damage and oxyradical concentrations including S.pombe cells, HepG2 cells and U87 cells by toxicity tests and single cell gel electrophoresis. Moreover, application of genetically depleted S.pombe is efficient for determining the oxidative stress path induced by MC in/between yeast cells. Through the observation, we can see DNA damage by MC-LR was supposed to happen in oxidative path. The experiment shows that S.pombe cells without gene wis1△ and pap1△ can not induce ROS. Treated with 40 mg·L-1MC for 24 h, the growth rate of gene wis1△ and pap1△ deletion mutant merely decline by 7.3%, 7.7%. Oxidative injury is the main MC damage exerting to S.pome cells. The HepG2 cells and U87 cells were more suitable for risk assessment than S.pombe cells.
microcystin; S.pombe; HepG2; U87; cytotoxicity; gene damage
X17
A
1674-5906(2014)10-1650-07
陈惠苑,张郅灏,黄艺. 微囊藻毒素对真菌和哺乳动物细胞毒害效应的研究[J]. 生态环境学报, 2014, 23(10): 1650-1656.
CHEN Huiyuan, ZHANG ZhiHao, HUANG Yi. Toxic effects of two kinds of microcystin to fungus and mammalian cells [J]. Ecology and Environmental Sciences, 2014, 23(10): 1650-1656.
国家水体污染控制与治理科技重大专项(2012ZX07501002-006)
陈惠苑(1991年生),女,硕士研究生,研究方向为水污染治理。E-mail:chhyuan@pku.edu.cn
2014-06-10
