LAMP快速检测犬传染性肝炎方法的建立及应用
2014-02-23,,
,,
(1.济南出入境检验检疫局,山东济南 250014;2.山东正邦养殖有限公司,山东济南 250010)
LAMP快速检测犬传染性肝炎方法的建立及应用
曹丙蕾1,凌宗帅1,邱洪凯2
(1.济南出入境检验检疫局,山东济南 250014;2.山东正邦养殖有限公司,山东济南 250010)
根据GenBank上公布的犬腺病毒I型(CAV-I)E3基因序列,设计了3对特异性环介导等温扩增(LAMP)引物,以CAV-I DNA为模板,通过条件优化建立了犬传染性肝炎LAMP快速检测方法,该方法能够在63℃恒温下30min内实现目的核酸的大量扩增,在可见光下即可直接观察扩增产物荧光颜色变化来判定结果。特异性和灵敏度试验表明,该LAMP检测方法只对CAV-I有特异性扩增,对其他无关核酸无扩增。与常规PCR检测相比,LAMP的检测灵敏度较好,最低检出限为10-7TCID50,是PCR检测方法的100倍。临床样品检测结果表明,LAMP阳性检出率为36%,与病毒分离鉴定的结果符合率达96.8%,与PCR检测的结果符合率达100%,且快速简便,成本低,适用于基层实验室的快速疾病诊断。
LAMP;犬传染性肝炎;犬腺病毒I型
犬传染性肝炎(infectious canine hepatitis,ICH)是由犬腺病毒I型(canine adenovirus I,CAV-I)感染引发的犬的一种急性败血性传染病。该病于1925年首次被发现[1],1984年,我国首次分离到该病毒,CAV-I在临床上可导致犬传染性肝炎、狐狸和熊脑炎等疾病的发生[2]。临床上以肝小叶中心坏死、肝实质细胞和皮质细胞核内出现包涵体以及出血为特征,常引起急性坏死性肝炎和角膜混浊(即蓝眼病)[3-4]。该病以刚断乳到一岁以内的幼犬感染率和死亡率为最高,死亡率可高达40%[2]。本病在世界范围内流行,既严重威胁着家养宠物的身体健康,又对我国养犬业、皮毛动物养殖业等危害较大,给养犬业和宠物爱好者带来巨大的经济损失。
突然发病和出血时间延长是犬传染性肝炎的暗示,重症病例初期与犬瘟热极为相似,仅靠临床症状和病理变化难以进行鉴别诊断,确诊尚需依赖于实验室特异性诊断,如病毒分离、血凝抑制试验及皮内变态反应等检测方法,而且还要与犬瘟热进行鉴别诊断[4-6]。针对病毒核酸的检测,无论从特异性、灵敏度还是检测效率角度考虑都可视为最佳方法。
目前,PCR、荧光定量PCR、分子杂交等技术已经逐渐应用于各类疾病的快速诊断当中,较高的检测成本以及昂贵的检测仪器都限制了技术的推广应用。LAMP检测方法是Notomi等报道的一种新颖核酸扩增技术,即核酸环介导等温扩增技术,利用4条或6条特异性引物,在恒温条件60~65℃下1h内其扩增效率可达到109~1010个数量级,结果易判定[7]。本文利用快速、高效、简便的环介导等温扩增(loop-mediated isothermal amplifcation assay,LAMP)技术对犬传染性肝炎进行检测应用,选取保守序列片段,优化反应条件,建立了直观、可视化的一步法LAMP方法,大大提高了结果准确率,降低检测成本,缩短检测周期,为基层现场检验检疫提供了技术支持。
1 材料与方法
1.1材料
1.1.1 生物材料。
犬传染性肝炎病毒、犬细小病毒病、鸭瘟病毒等病毒样品及临床样品由山东农业大学动物医学院谢之景教授提供。
1.1.2 试剂及耗材。
Bst DNA聚合酶购自NEB公司;2000bp DNA Marker、dNTPs、病毒DNA/RNA提取试剂盒、组织DNA提取试剂盒、Taq DNA酶等购自Takara公司;恒温扩增试剂、荧光染料(钙黄绿素与氯化锰)均为广州迪澳(DEAOU)公司产品;引物和探针送交上海生工生物工程技术服务有限公司合成;其他试剂均为国产分析纯。
1.2 方法
1.2.1 LAMP引物的设计。
根据GenBank上发表的序列,通过MegAline找出CAV-I的相对保守序列E3,利用Primer Explorer V4在线软件(http://primerexplorer.jp/)设计LAMP引物,其中包括2条外引物(F3/ B3)、2条内引物(FIP/BIP)和2条环引物(LF/ LB)(表1)[7-9]及犬腺病毒PCR检测的2条检测引物(表2)[6,9]。

表1 犬腺病毒I型LAMP的引物序列
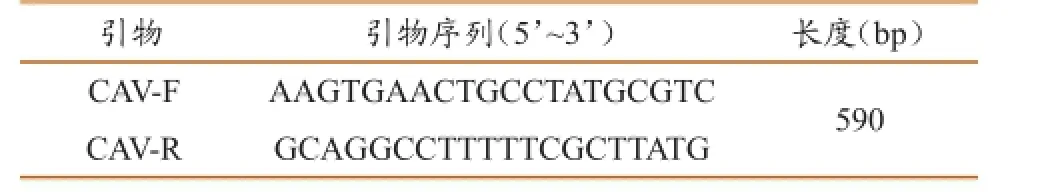
表2 犬腺病毒I型E3基因的PCR检测引物序列
1.2.2 反应模板的制备。
根据病毒DNA/RNA提取试剂盒的说明书进行病毒核酸的提取,提取产物于-80℃冰箱保存备用。
1.2.3 LAMP反应体系的建立。
参照Nagamine等[7-8]方法,制备LAMP的反应体系,在25μL的反应体系中,添加荧光染料钙黄绿素作为荧光指示剂,并对Mg2+、dNTP、Betaine、内外引物的浓度和反应温度、反应时间等条件进行优化,反应混合物置于恒温金属浴中在59,60,61,62,63,64,65℃恒温下分别作用30min、45min、50min和55min,80℃孵育2min终止反应,通过交叉试验进行条件优化,反应结束后根据扩增产物的荧光颜色来判定结果,最终确立最佳反应体系与反应条件,建立LAMP检测方法[8,10-11]。
1.2.4 PCR检测CAV方法与LAMP方法的比较。
以提取的CAV-I病毒基因组DNA为模板,CAV-F、CAV-R为引物,进行PCR扩增,设置PCR反 应 体 系:10×PCR buffer 2.5μL,Mg2+(25mM)1μL,dNTP Mixture(2.5mM)2μL,Taq DNA酶(1U/μL)0.5μL,上下游引物(10μM)各1μL,模板1μL,ddH2O补充至25μL。
PCR反应条件:95℃ 5min;95℃ 1min,55℃30s,72℃ 30s,共35个循环;72℃ 7min,4℃保存。反应产物进行1%琼脂糖凝胶电泳分析。将PCR检测结果与LAMP检测方法进行比较,来分析LAMP方法的检测优势。
1.2.5 LAMP特异性检测。
以CAV-I、犬瘟热病毒(CDV)、犬细小病毒(CPV)、鸭瘟病毒(DPV)和蓝耳病病毒(PRRSV)的核酸作为待测样品模板,设立阴性对照进行LAMP,观察结果,检验LAMP方法的特异性 [8,12]。
1.2.6 LAMP的灵敏性检测。
对CAV-I病 毒(TCID50为10-4.12/0.1mL) 进行10倍梯度稀释,分别为10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8TCID50,提取模板DNA进行LAMP试验,观察结果检测LAMP方法的灵敏度[8,12]。
1.2.7 LAMP检测方法的应用。
对28份临床检验疑似患病的待检病料,核酸提取后进行LAMP检测,观察扩增产物的荧光颜色变化来判定检测结果。
2 结果
2.1 LAMP检测方法的建立
通过对Mg2+、dNTP、Betaine、内外引物的浓度等条件的优化,确立最优反应体系,即10×Thermo Pol Buffer 2.5μL,Mg2+(25mM)2.5μL,dNTP(10mM each)4μL,FIP和 BIP(均为50 μM)1μL,F3和B3(均为50 μM)0.25μL,LF和LB( 均 为50μM)0.5μL, 荧光 染 料 2μL,Betaine(5 M)4μL,Bst DNA polymerase(8U/μl)1μL,模板DNA 2μL,补水至总体积25μL。
通过ABI 7500进行熔解曲线分析,63℃时反应出现的荧光值最高,说明LAMP在此温度下扩增效率最高,重复进行3次同样的试验,均取得相似的结果。
在30min、45min、50min和55min的作用时间下观察发现扩增结果差异不明显,均获得较好的结果,且效率较高,故确定30min为最佳反应时间。因此,本文建立的LAMP反应优化后的反应条件为:最佳反应温度为63℃,最佳反应时间为30min,80℃作用2min终止反应。结果判定直接用肉眼进行直观观察,阳性反应管呈现明显的翠绿色,而阴性对照则为淡橙色。
CAV-I进行PCR对比检测结果如图1所示,目的片段大小与预期大小相符。
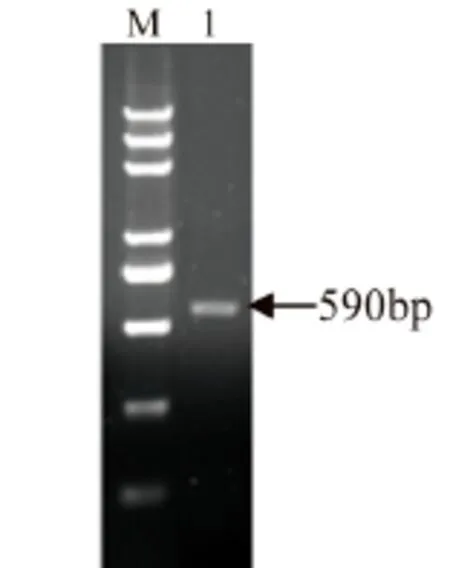
图1 CAV-I的PCR检测扩增出590bp的片段
2.2 LAMP检测方法的灵敏性
对CAV-I病毒作10倍系列稀释后进行LAMP检测,结果表明,LAMP的最低检测限为10-7TCID50(图2)。与PCR反应扩增后的电泳结果进行比较,LAMP方法的最低检测限比普通PCR灵敏度高100倍(数据图略)。

图2 LAMP的灵敏度检测
2.3 LAMP检测方法的特异性
特异性试验结果表明,CAV-I阳性反应扩增结果特异性好,肉眼观察荧光颜色清晰可见,呈翠绿色,CDV、CPV、DPV和PRRSV的非目的性扩增和阴性反应无任何明显颜色变化,无特异性扩增(图3)。与PCR反应扩增后的电泳结果一致。
图3 LAMP的特异性检测
2.5 临床检验
应用本试验建立的LAMP检测方法检测,对收集的28份临床样品,结果发现,CAV-I阳性样品10份,阴性样品18份;与病料分离鉴定结果相比,符合率为96.8%;与PCR检测结果相比,符合率为100%。
3 讨论
目前,对于许多传染性疾病的诊断常常需要进行实验室检测,以便能够进一步进行确诊,保证检测结果的准确性。传统方法主要依赖病毒分离、病理学及血清学方法等,但这些方法不仅繁琐耗时,且敏感性和特异性较差,不能及时确诊。近年来,由于核酸杂交、PCR等技术的应用,使CAV-I感染的诊断进入到分子生物学阶段,建立的PCR和real-time PCR方法需要昂贵的仪器,要求一定的实验室条件和经过技能培训的技术人员[2,4-5]。
LAMP方法是在恒温条件下反应,只需要一台恒温水浴锅或培养箱即可,无需进行电泳检测,简便快捷,这使得LAMP方法可以很容易在基层或者现场查验中开展检测。而且,由于LAMP采用4或6条引物共识别6个特异性的目的区域[7-8,11],这使得LAMP检测方法比PCR方法等具有更好的灵敏度和特异性。
本研究建立的犬传染性肝炎病毒(CAV-I)的LAMP检测方法,可在63℃等温条件下1h内完成扩增检测,由于在LAMP引物设计中引入了一对环引物,可以在30min左右的时间完成反应,使得LAMP的扩增效率大幅提高。同时,在结果判定中,为防止出现假阳性结果,反应前在反应体系中添加了钙黄绿素与氯化锰组成的一种荧光染料,呈淡橙色,不发荧光,随着特异性扩增反应的发生,反应中产生的焦磷酸根离子与锰离子结合,释放的钙黄绿素可以自发荧光,扩增效率越高,激发的荧光越强。反应结束后可在可见光或紫外线下直接观察反应液的颜色变化来判定结果,既避免了开盖污染环境造成的假阳性,又实现了反应结果的可视化,解决了LAMP技术的临床应用问题[12]。
与传统的PCR检测方法相比,LAMP检测方法具有更高的特异性,利用本试验建立的LAMP检测方法对CDV、CPV、DPV、PRRSV等病原进行特异性检测证明,建立的LAMP方法能够特异性的检测CAV-I,对其他病毒无扩增。同时,LAMP检测方法灵敏度较好,是PCR检测反应的100倍,结果一致性也较好,对28份可疑样本的检测证实,LAMP阳性检出率高于PCR方法,能有效防止假阴性结果的出现,这一快速简便的LAMP检测方法在基层检疫或现场查验中具有很高的实用价值,能够对疾病更好的作出精确判断,应用前景较为广阔。
[1] Hu R L,Huang G,Qiu W,et al.,Detection and differentiation of CAV-1 and CAV-2 by polymerase chain reaction[J].Vet Res Communications,2001,25(1):77-84.
[2] 王 雷,夏咸柱,卫广森,等. 用PCR技术鉴定犬传染性肝炎病毒强、弱毒株的研究[J].畜牧与兽医,2002,34(2):10-12.
[3] 耿庆华,林 颖,裴程程,等. 犬瘟热病毒和犬腺病毒2型双重PCR方法的建立及应用[J].中国动物检疫,2012,29(5):38-41.
[4] 凌宗帅,温书坤,刘友清,等. 犬I型腺病毒的分子生物学研究进展[J].中国兽医杂志,2005,41(8):34-35.
[5] 汪 琳,赖平安,邢佑尚,等. 基因芯片在犬病病原体检测中的应用[J].检验检疫学刊,2011,21(4):23-25,48.
[6] 刘大飞,姜一曈,戚 亭,等. 同时检测犬瘟热病毒、犬细小病毒I型和II型犬腺病毒多重PCR方法的建立[J].中国预防兽医学报,2012,34(11):911-914.
[7] Nagamine K,Hase T,Notomi T. Accelerated reaction by loop-mediated isothermal amplifcation using loop primers [J]. Mol Cell Probes,2002,16(3):223-229.
[8] 胡嘉欣,温永俊,霍志云,等. 犬瘟热病毒RT-LAMP检测方法的建立及初步应用[J]. 中国畜牧兽医,2012,39(8): 45-49.
[9] Linne T. Differences in the E3 regions of the canine adenovirus type 1 and type 2[J]. Virus Res,1992,23(1/2):119-133.
[10] 何 媛,罗宝正,邵建宏,等. 狂犬病病毒RT-LAMP检测方法的建立[J]. 动物医学进展,2013,34(5):1-5.
[11] 赵光远,谢芝勋,谢丽基,等. 鸭圆环病毒LAMP可视化检测方法的建立[J]. 中国动物检疫,2012,29(3): 24-26.
[12] 谢志勤,谢芝勋,邓显文,等. 环介导等温可视扩增(LAMP)检测禽肺炎病毒方法的建立[J].中国动物检疫,2013,30 (3): 48-51.
Establishment and Application of LAMP for the Rapid Detection of Infectious Canine Hepatitis
Cao Binglei1,Ling Zongshuai1,Qiu Hongkai2
(1. Jinan Entry-Exit Inspection and Quarantine Bureau,Jinan,Shandong 250014;2. Shandong Zhengbang Breeding Group CO.,LTD.,Jinan,Shandong 250010)
To develop a rapid method for the detection of infectious canine hepatitis,LAMP was established using three pairs of specifc primers for the E3 gene of CAV-I according to the sequences in GenBank. The assay was optimized to obtain a big amount of amplifcation products at 63℃ for 30min and the amplifcation products could be observed by the naked eyes. It was shown that the LAMP was able to specifcally amplify CAV-I DNA,without cross-reaction with other irrelevant nucleotides and it was 100 times more sensitive than PCR assay with a lowest detection limit value of 10-7TCID50/0.1mL. The detection of clinical samples showed that the positive rate of LAMP was 43%. In addition,the agreement rate between LAMP and the virus isolation was 96.8% but between LAMP and PCR was up to 100%.LAMP was more sensitive and simple and could be applied to rapid diagnosis of CAV-I.
LAMP;infectious canine hepatitis;canine adenovirus I
S855.3
:A
:1005-944X(2014)06-0073-04
国家质检总局项目科技计划项目(2012IK015)
曹丙蕾,E-mail:caobinglei8079@163.com
