影响荔枝酒甲醇含量的因素
2014-02-21张钟陈海蓉
张钟,陈海蓉
(广东石油化工学院化学与生命科学学院,广东茂名525000)
影响荔枝酒甲醇含量的因素
张钟,陈海蓉
(广东石油化工学院化学与生命科学学院,广东茂名525000)
以荔枝肉为原料,采用传统酿酒的方法制备荔枝酒,通过正交试验分析方法优化了影响荔枝酒甲醇含量的主要因素。采用气相色谱法测定其甲醇含量。试验结果表明,影响荔枝酒甲醇含量的因素排序为:温度>pH>果胶酶量,荔枝酒酿造过程的甲醇含量最少的最佳工艺参数:温度为25℃,pH为5.0,果胶酶0.6g/100mL。
荔枝酒;甲醇;气相色谱法
甲醇(methanol或methyl alcohol,MeOH)又名木醇,是脂肪簇醇类中最简单的醇类[1]。它是食用酒中的有害成分[2],也是最重要的卫生指标之一[3]。为确保食用者生命安全,国家对食用酒中甲醇含量进行了严格控制。国标规定,60度酒中甲醇最高允许含量不超过0.04g/100mL[4]。
关于甲醇含量的测定,国外报道可用高效液相色谱法(high performance liquid chromatography,HPLC)、气相色谱法(gas chromatography,GC)分析和化学分析法[5-6]。化学分析法中有醇氧化酶法与高锰酸盐氧化法[7]。国标GB5009.48—2003《蒸馏酒与配制酒》规定,蒸馏酒和配制酒中甲醇的测定方法为碱性品红亚硫酸比色法和GC法(GDX-102柱)[4]。碱性品红亚硫酸比色法为甲醇测定的经典方法,但操作繁琐、费时[8-9],不便于快速分析,但是对于有颜色的酒样不能直接采用比色法测定,因为酒样的颜色会严重干扰测定结果,必须进行预处理。因此GC法在我国白酒成分分析中的应用越来越广泛[10]。
荔枝压榨出汁率很高,总糖含量和总酸含量都非常适合发酵成果酒。荔枝酒多数为发酵酒,其营养丰富、果香馥郁、醇香可口,并具有一定的保健作用,但其在发酵过程中甲醇含量极易超标。
本研究对荔枝酒发酵过程中温度、起始酸度以及添加果胶酶量对甲醇产生的影响进行了研究,并用GC法对荔枝酒中甲醇的含量进行了测定。
1 材料与方法
1.1 材料与试剂
荔枝干,白糖,50 000U/g果胶酶:四川省山野生物科技有限公司;食品级柠檬酸、活性干酵母、氢氧化钠溶液、甲醇、乙醇、4-甲基-2-戊醇,以上试剂为色谱纯。
1.2 仪器与设备
FA-1640电子天平:上海天平仪器厂;GXZ280D发光培养箱:嘉兴市中新医疗仪器有限公司;101A-2B电热鼓风干燥箱:上海实验仪器厂有限公司;7820A气相色谱仪:美国安捷伦公司;毛细管柱:PEG20M毛细血管色谱仪(柱长35~50m,内径0.25mm,涂层0.2μm)。
1.3 试验方法
1.3.1 荔枝酒制作工艺流程
荔枝→清选→去壳、去核、榨汁→荔枝汁→澄清过滤→控温发酵→发酵终止→陈酿→精滤→成品[11]
1.3.2 影响荔枝酒甲醇含量的因素分析[12-15]
(1)温度对荔枝酒甲醇含量的影响
在荔枝酒pH值4.0,果胶酶量0.6g/100mL条件下,设置20℃、25℃、30℃、35℃、40℃等不同温度,进行发酵6d,测定甲醇含量最低时的温度作为最佳温度。
(2)pH值对荔枝酒甲醇含量的影响
在上一试验结果的基础上,果胶酶量0.6g/100mL条件下,设置2.0、3.0、4.0、5.0、6.0等不同pH值,进行发酵6d,测定甲醇含量最低时的pH值作为最佳pH值。
(3)果胶酶量对荔枝酒甲醇含量的影响
在以上2个试验结果的基础上,设置0、0.3g/100mL、0.6g/100mL、0.9g/100mL、1.2g/100mL不同的果胶酶量,进行发酵6d,测定甲醇含量最低的果胶酶量作为最佳果胶酶量。
(4)发酵工艺优化正交试验设计
从众多影响甲醇含量的因素中选择发酵温度、发酵pH值和果胶酶用量3因素进行条件优化,在单因素试验的基础上,正交试验因素水平见表1。
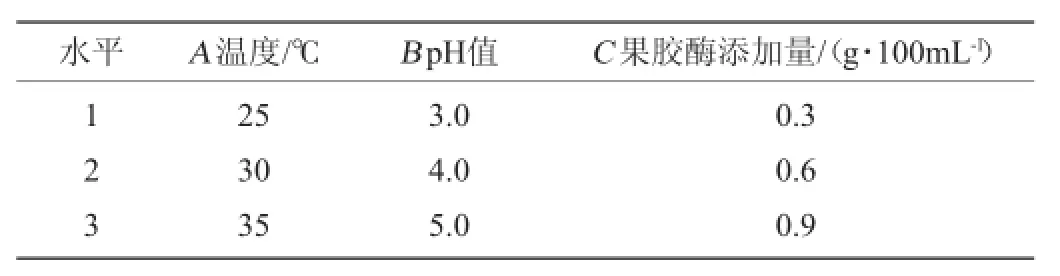
表1 影响荔枝酒甲醇含量的正交试验设计因素水平Table 1 Factors and levels of the orthogonal experiment for litchi wine methanol content optimization
1.3.3 荔枝酒甲醇含量测定方法—气相色谱法
(1)色谱条件
载气(高纯氮):流速为0.5~1.0mL/min,分流比约50∶1,尾吹约20~30mL/min;氢气:流速为40mL/min;空气:流速为400mL/min;检测器温度220℃;注样器温度220℃;柱温:起始温度40℃,恒温4min,以3.5℃/min程序升温至200℃,继续恒温10min。
(2)校正因子(f值)的测定
吸取甲醇溶液1.00mL,移入100mL容量瓶中,然后加入上述4-甲基-2-戊醇溶液1.00mL,用乙醇溶液稀释至刻度。上述溶液中甲醇和内标的体积分数均为0.02%。待色谱仪基线稳定后,用微量注射器进样,进样量随仪器的灵敏度而定。记录甲醇和内标峰的保留时间及其峰面积(或峰高),用其比值计算出甲醇的相对校正因子。
(3)试样的制备
用洁净、干燥的100mL容量瓶准确量取100mL样品(液温20℃)于500mL蒸馏瓶中,用50mL水分3次冲洗容量瓶,洗液并入蒸馏瓶中,再加几颗玻璃珠,连接冷凝器,以取样用的原容量瓶作接收器(外加冰浴)。开启冷却水,缓慢加热蒸馏。收集馏出液接近刻度,取下容量瓶,盖塞。于20℃水浴中保温30min,补加水至刻度,混匀,备用。
(4)分析步骤
吸取制备的试样10.0mL于10mL容量瓶中,加入4-甲基-2-戊醇溶液0.10mL,混匀后,在与f值测定相同的条件下进样,根据保留时间确定甲醇峰的位置,并测定甲醇与内标峰面积(或峰高),求出峰面积(或峰高)之比,计算出酒样中甲醇的含量。
1.3.4 甲醇含量结果计算
甲醇的相对校正因子按式(1)计算,样品中甲醇的含量按式(2)计算。

式中:X1为样品中甲醇的含量,g/100mL;f为甲醇的相对校正因子;A1为标样f值测定时内标的峰面积(或峰高);A2为标样f值测定时甲醇的峰面积(或峰高);A3为试样中甲醇的峰面积(或峰高);A4为添加于酒样中内标的峰面积(或峰高);d2为甲醇的相对密度;d1为内标物的相对密度;I为内标物含量(添加在酒样中),g/100mL。
2 试验结果与分析
2.1 影响荔枝酒甲醇含量的因素分析结果
2.1.1 温度对荔枝酒甲醇含量的影响

表2 温度对荔枝酒甲醇含量的影响Table 2 Effect of temperature on methanol content in litchi wine
从表2可以看出,甲醇含量随温度的升高而增加,综合产酒量和甲醇含量,选择30℃作为最佳发酵温度。
2.1.2 pH值对荔枝酒甲醇含量的影响

表3pH值对荔枝酒甲醇含量的影响Table 3 Effect of pH on methanol content in litchi wine
从表3可以看出,pH值为4.0时甲醇含量最低,选择pH值4.0作为最佳发酵pH值。
2.1.3 果胶酶添加量对荔枝酒甲醇含量的影响

表4 果胶酶量对荔枝酒甲醇含量的影响Table 4 Effect of pectinase addition on methanol content in litchi wine
从表4可以看出,不加果胶酶时甲醇含量最高,添加果胶酶后甲醇含量有所降低,果胶酶添加量为0.6g/100mL时甲醇含量最低,所以选择0.6g/100mL作为最佳发酵果胶酶量。
2.2 发酵工艺优化正交试验结果分析
运用正交设计助手Ⅱv3.1.1,对试验结果分析如表5所示。

表5 影响荔枝酒甲醇含量的正交试验结果Table 5 Factors and levels of the orthogonal experiment for litchi wine methanol content optimization
在荔枝酒酿造过程中,影响其甲醇含量的主要因素为温度、pH值和果胶酶量。从表5的极差分析结果可以看出,影响荔枝酒甲醇含量的因素中排序为温度>pH值>果胶酶量。因此,温度是荔枝酒甲醇含量的决定性因素。
由表5可知,荔枝酒酿造过程甲醇生成量最少的最佳工艺参数为A1B3C2,即温度为25℃,pH值为5.0,果胶酶0.6g/100mL。由于该工艺参数在表5中未出现,正交表中甲醇含量最低的组合A1B3C3及最佳组合进行验证试验,重复3次,结果见表6。

表6 正交试验验证试验Table 6 Verification test of orthogonal experiment
从表6可看出,工艺参数为A1B3C2条件下甲醇含量最低。因此最终确定最佳组合为A1B3C2。
2.3 方差分析结果
从表7的结果可看出,3个因素都不显著。但A因素的F值最大,为主要影响因素。
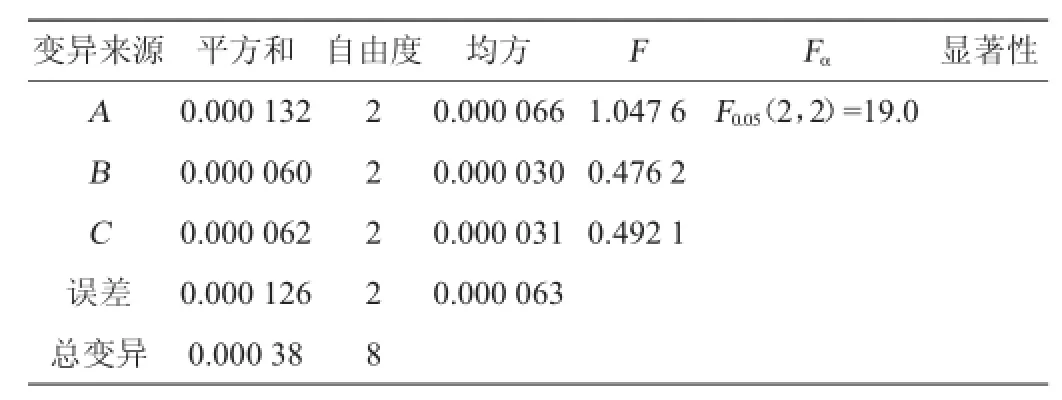
表7 正交试验方差分析Table 7 Variance analysis of orthogonal experiment
3 结论
从试验中可以总结出,影响荔枝酒甲醇含量的因素中排序为温度>pH值>果胶酶量。因此,温度是荔枝酒甲醇含量的决定性因素。荔枝酒酿造过程的甲醇含量最少的最佳工艺参数为温度25℃,pH为5.0,果胶酶0.6g/100mL。在此优化条件下,荔枝酒甲醇含量为0.036 0g/100mL。
[1]陈声.发酵工业辞典[M].北京:中国轻工业出版社,1991.
[2]陆寿鹏.白酒工艺学[M].北京:中国轻工业出版社,1996.
[3]邓锦霞,曾祖训.色谱分析白酒醇、酯的误差剖析[J].酿酒科技,1994(2):30-32.
[4]宋顺达.食品标准大全[M].沈阳:辽宁大学出版社,1992.
[5]CARUSO R,GAMBINO G L,SCORDINO M,et al.Gas chromatographic quantitative analysis of methanol in wine:operative conditions,optimization and calibration model choice[J].Natl Prod Commun,2011,6 (12):1939-1943.
[6]曾游,丁怡.顶空-毛细管气相色谱法测定葡萄酒中的甲醇[J].现代食品科技,2013,29(2):405-408.
[7]KLAVONS J A,BENNET R D.Determination of methanol using alcohol oxidase and its application to methyle ester content of pections[J].Agr Food Chem,1986,34:597-383.
[8]王兰英.对白酒甲醇检测中获得准确结果的探讨[J].辽宁食品与发酵,1991(4):53-54.
[9]李文奇.标准曲线法在食用酒中甲醇含量测定上的运用[J].酿酒科技,1995(6):37-39.
[10]沈尧绅,曹桂英.关于白酒中醇酯等主成分气相色谱法分析方法的探讨[J].酿酒,1994,7(2):32-33.
[11]罗富英,王宏,李再峰.荔枝全汁发酵果酒工艺研究[J].食品工业科技,2006,27(4):147-149.
[12]全国食品工业标准化技术委员会酿酒分技术委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[13]马超,曾霞,刘杰凤,等.荔枝酒发酵工艺的初步优化研究[J].广州化工,2013(15):68-70.
[14]高敏,曾新安,于淑娟.荔枝酒中杂醇油含量的测定[J].食品工业科技,2010(5):356-358.
[15]郝菊芳.荔枝汁加工中营养和典型香气成分的变化研究[D].武汉:华中农业大学硕士论文,2008.
Influence factors of methanol content in litchi wine
ZHANG Zhong,CHEN Hairong
(College of Chemistry and Life Science,Guangdong University of Petrochemical Technology,Maoming 525000,China)
The litchi wine was made by the traditional brewing method,taking litchi fruit as raw material.The main factors affecting the methanol content of litchi wine was optimized with the orthogonal experiment and the content of methanol was determined by gas chromatography.Results showed that influence factors of methanol content in fruit wine in order were temperature,pH and pectinase addition.The optimum process parameters for least methanol producing was temperature 25℃,pH 5.0,pectinase 0.6g/100 ml.
litchi wine;methanol;gas chromatography
TS261
A
0254-5071(2014)03-0125-03
10.3969/j.issn.0254-5071.2014.03.030
2014-01-11
茂名市科技计划项目(2011B01019)
张钟(1962-),男,教授,本科,研究方向为农产品贮藏与加工。
