环境条件对sua41 突变体表型的影响
2014-01-24黄国文
黄国文
(湖南科技学院 生命科学和化学工程学院,湖南 永州 425199)
环境条件对sua41突变体表型的影响
黄国文
(湖南科技学院 生命科学和化学工程学院,湖南 永州 425199)
突变体表型分析是基因功能研究的重要组成部分,通过对突变体的分析可以预见突变序列的未知功能。本文研究了sua41突变体的表型特征和可塑性变化。结果表明,与Col-0相对照,sua41的莲座叶和茎生叶片较小,植株的茎细小,花序轴顶端的花蕾较少,在果枝上有聚合果现象;sua41突变体的早花表型与光照强度和光质无关;不同光照条件下sua41根长与野生型相比有差异;不同光质条件下sua41下胚轴长度比野生型的稍长;低温条件下sua41突变体根长比野生型的短,下胚轴长度比野生型的稍微长些。说明,SUA41基因除了调节开花时间之外,还调节茎、叶、上胚轴和根的生长以及花芽的形成。SUA41基因是一个多功能的基因。
sua41突变体;表型;光照;温度
表型(phenotype)是生物体的遗传性状,是基因与环境相互作用的结果,对植物在不同环境中生存和繁殖是很重要的[1,2]。植物的表型具有可塑性,生物受到环境影响后同一基因型能够做出相应改变而产生不同表型,来适应其生存的时空异质环境
[3,4]。植物在光照、温度、水分、养料等变化的环境中,能够发生遗传变异,接受自然选择,表现出可塑性响应。可塑性使植物的形态、生理或发育性状发生改变,使其能够适应生存环境,有利于植物在不同环境中生存和繁殖。所以,研究植物的表型变化能够反映出基因型的变化,表型是基因型变化的指示者。在以基因敲除或RNA干涉[5,6]为目的产生突变体中,表型可以作为一种工具解释遗传成分在分子水平的作用过程并且理解其生物学过程。通过对突变体的分析可以预见序列的未知功能。拟南芥sua41突变体是一个T—DNA标签插入来敲除基因的突变体。目前研究表明,SUA41基因参与调节拟南芥开花时间,并且在开花自主途径和温敏途径中起调节作用[7],参与生长素的信号转导途径的调节[8],并能够调节基础免疫和系统获得性抗性[9]。SUA41基因启动子与GUS融合表达载体在拟南芥中的表达特性和qPCR分析野生型Col-0中SUA41基因的表达水平,表明SUA41基因在植株的根、下胚轴、子叶、芽、茎、叶、花和角果中都有表达,且表达量无显著区别[7]。SUA41基因的表达模式反映出这种基因可以参与了植株各个器官的生命活动或者生长发育。本文研究sua41突变体的表型特征,用以揭示SUA41基因的调节功能。
1 材料和方法
1.1 植物材料
实验中所使用的植物材料为拟南芥 (Arabidopsis thaliana)野生型Columbia (Col-0) 生态型。sua41突变体(SALK-109959)杂合体为T-DNA插入突变体,其种子来自美国Ohio州立大学ABRC(ArabidopsisBiological Resource Center)。
1.2 植物开花时间的统计方法
把Col-0和sua41种子放在湿润的滤纸上或者用酒精消毒的种子放在MS培养基上。在4℃处理3天,然后种在特定光照:长日照(16h光照/8h黑暗)不同光照强度、蓝光(2.0μmol/m2.s)、红光(66μmol/m2.s)等条件下,让植物生长,当材料开花时,记录植物产生第一朵花时植株的总叶片数(莲座叶和茎生叶)作为植物的开花时间指标,统计的每种植物数目不低于25株。进行了三次生物学重复实验。将数据统计在Excel表中进行分析。
1.3 测定sua41突变体的下胚轴长度和根长度的方法
把sua41突变体和Col-0野生型种子播在含MS培养基的培养皿中,经过4℃低温处理3天以及光诱导处理4小时以后,放在不同的光照:长日(16h光照/8h黑暗)、短日(8h光照/16h黑暗)、连续红光(66μmol/m2.s)、连续蓝光(2.0μmol/m2.s),黑暗等条件处理7天后,测定其下胚轴的长度;对在各种条件下生长14天幼苗,测定其根的长度。进行三次生物学重复实验。将数据统计在Excel表中进行分析。
2 结果和分析
2.1 sua41突变体的表型特征观察
与野生型比较,sua41突变体除了具有早花表型以外,还有其它的一些特征(图1)。植株的莲座叶和茎生叶片较小,植株的茎细小。主枝花序轴上角果的数目较少且单位长度上角果的数量也较少,角果有聚合在同一节上的现象。花序轴顶端的花蕾较少。在各个发育阶段植株都很弱小。在盛花期,莲座叶开始变黄,在果实成熟后期,莲座叶枯死。但是在株型上与野生型Col-0没有明显区别,主茎上也有分枝。这些结果表明,SUA41基因突变导致植株的茎和叶片的大小以及花朵和角果的数目改变;SUA41基因影响植株茎叶的生长和花的发育,暗示SUA41基因可能影响茎节间细胞分裂和花分生组织特征基因的作用。

图1. sua41突变体的表型特征
2.2 不同光照条件对sua41根和下胚轴生长以及开花时间的影响
为了了解不同光照条件对sua41突变体的下胚轴和根生长的影响,测定了sua41突变体幼苗根的长度。结果(图2A)所示,在不同光照条件下,突变体和野生型都是以连续红光和连续远红光的根最长,分别为2.6,2.9和2.8,2.6cm;而以连续白光照的根最短,分别为1.0和1.4cm;连续蓝光下分别为1.9和1.9 cm;在长日和短日条件下,分别为1.4,1.9和1.8,2.0 cm。说明,在同一光照条件下,与野生型比较,sua41突变体的根长有一定变化,但是变化不大;与白光相比在连续蓝光、连续红光和远红光条件下,sua41突变体根长有较大变化。所以SUA41突变对根的生长有一定影响,并且与光照强度和光质有一定关系,但是这种影响是比较弱的。(A) 不同光照条件下的sua41的根长度 (cm)。 (B) 不同光照条件下的sua41的下胚轴长度(cm)。 A, 黑暗. B, 长日照. C,短日照. D, 连续白光照. E, 连续蓝光照 F, 连续红光照 G, 连续远红光照. (C) 不同光照度下sua41的开花时间(天数)。(D) 不同光照度下sua41的开花时间(叶片数)。1 (184.62μmolm-2s-1), 2 (133.04μmolm-2s-1), 3 (109.40μmolm-2s-1) 和 4 (98.94μmolm-2s-1) 。 数值显示平均值± SE。

图2. 不同光照条件下sua41突变体的根长度(cm)、下胚轴长度(cm)和开花时间
在多种光照条件下,测定了Col-0和sua41的下胚轴的长度(图2B)。表明,在黑暗条件下,sua41的下胚轴长度比Col-0的稍微短1cm左右,但是在红光、蓝光、长日照和短日照条件下,sua41突变体的下胚轴长度比野生型的稍长1cm左右,但变化程度不明显。与黑暗比较,光照条件下Col-0和sua41的下胚轴较短。说明,sua41突变体下胚轴对各种光照有反应;SUA41基因能够参与光照条件下抑制植株下胚轴的伸长,但是与光照种类无关。
在长日条件和四个光照强度处理下,sua41突变体开花时所需要的天数不同(图2C)。Col-0的天数依次为24.6,24.9,30.8和34天。sua41的天数依次为19.7,20.6,24.9和26.8天。同一光强下,sua41的开花天数与Col-0的开花天数的比值都为0.8,所以它们变化的值相同。四种光照强度下,野生型和sua41突变体的开花叶片数如下(图2D)所示。野生型的开花叶片数分别为14.2片,14.2片,15.9片和15.6片,sua41突变体的开花叶片数分别为8.6片,8.4片,8.7片和8.4片。表明,在不同光照强度下Col-0和sua41的开花叶片数都相差不是很大。光照强度能够影响拟南芥的生长发育,较高光照强度能够使拟南芥Col-0和sua41生长发育较快,开花较早,而较低光照强度能使拟南芥Col-0和sua41突变体生长发育较慢,开花较迟。SUA41基因影响开花天数与光强无关,影响开花时叶片数与光强无关。SUA41基因参与的开花反应不受光照强度的影响。
2.3 光质对sua41下胚轴生长和开花时间的影响
为了更好地理解光质对sua41下胚轴生长的影响,有必要对不同强度的红光和蓝光进行实验。PHYB是一种红光受体,主要调节植物对红光的反应,促进幼苗的下胚轴缩短,其过表达使幼苗矮化,其突变导致幼苗的下胚轴伸长[10]。在不同红光强度下,测定了sua41突变体的下胚轴的长度,结果如下(图3A)。在不同红光强度下,与Col-0相比,phyB的下胚轴有一定的变化,但是,随着光强增强,sua41突变体的下胚轴有一定程度的增加。说明,sua41突变体的下胚轴对红光有一定反应,SUA41基因能够参与红光调节植株下胚轴的生长。
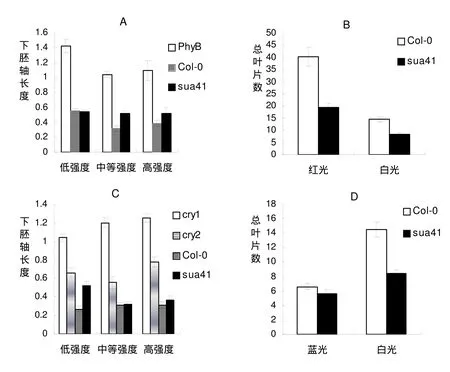
图3. 不同光照条件下sua41突变体的下胚轴长度(cm)和开花时间
(A) 不同红光强度下sua41的下胚轴长度。低强度、中等强度和高强度红光分别是 31μmol/m2.s, 66μmol /m2.s, 88μmol/m2.s。 (B) 不同连续的光照条件下sua41的开花时间。红光强度是21μmol. m-2. s-1,白光强度是70 μmol. m-2. s-1。 (C)不同蓝光条件下sua41的下胚轴长度。低等强度、中等强度和高强度的蓝光分别是0.5μmol/m2.s, 2.0μmol/m2.s 和4.15μmol/m2.s. (D) 不同连续光照条件下sua41的开花时间。蓝光强度是25 μmol. m-2. s-1,白光强度是70μmol. m-2. s-1. 资料显示平均值(n =50) ±SD.
CRY1和CRY2是两种蓝光受体,主要调节植物向光性运动和其他蓝光反应(包括抑制下胚轴伸长、刺激子叶张开、调节开花时间等),其突变导致幼苗的下胚轴伸长[11]。在不同蓝光强度下,以cry1、cry2和Col-0为对照,测定了sua41突变体的下胚轴的长度,结果如下(图3C)。在不同蓝光强度下的下胚轴以cry1的最长,cry2的次之,说明各种强度蓝光在调节下胚轴生长时有作用。在低光强下sua41突变体的下胚轴比Col-0的较长,但在高光强下,Col-0和sua41突变体的下胚轴长度几乎一样长,说明在中等和高蓝光下sua41突变体的下胚轴长度受蓝光的影响较小,SUA41基因能够参与低强度蓝光调节植株下胚轴的伸长。
光质影响植物的开花时间。蓝光是促进拟南芥开花的环境因素之一。将拟南芥Col-0和sua41播种在含有MS的培养瓶中,放入蓝光和白光培养箱(光照强度为 25μmolm-2s-1)中进行光照培养。开花时计算叶片数(图3D)。在蓝光培养条件下,Col-0和sua41的叶片数分别为6.6片和5.5片。比较白光条件下,Col-0和sua41的叶片数分别为14.5片和8.5片,蓝光条件下Col-0和sua41开花时的叶片数都减少了。在蓝光和白光光照条件下,sua41突变体的叶片数与Col-0的叶片数的比值分别为0.8和0.6,虽然比值有变化,但是变化的幅度不大,说明sua41突变体仍然能够响应蓝光信号早开花。即SUA41突变虽然影响开花时间,但不影响植物对蓝光信号的感受,SUA41基因不在蓝光促进开花途径中起作用。
红光是抑制拟南芥开花的因素。将拟南芥Col-0和sua41播种在土壤中,放入红光和白光培养箱中进行光照培养。开花时计算叶片数(图3C)。在红光培养条件下,Col-0和sua41的叶片数分别为40.3片和19.6片。比较白光条件下,Col-0和sua41的叶片数分别为14.5片和8.5片,红光条件下Col-0和sua41开花时的叶片数都增加了。在红光和白光光照条件下,sua41的叶片数与Col-0的叶片数的比值分别为0.5和0.6,比值虽然有变化,但是变化的幅度不大。说明,红光抑制了sua41突变体的开花,同样也抑制了Col-0的开花,但是抑制的程度相似。说明SUA41基因不参与红光抑制植物开花的过程。
2.4 低温对sua41突变体下胚轴和根长的影响
把Col-0和sua41播种在MS培养基上,在4℃黑暗处理3天,放在16℃和长日条件下,让其生长12天,测定它们的下胚轴和根的长度(图4)。表明,在常温条件下,

图4. 在低温条件下sua41突变体的下胚轴和根的长度(cm)
(A) 在22℃ 和16℃ 条件下Col-0 和sua41幼苗的下胚轴长度. (B) 在22℃ 和 16℃ 条件下Col-0 和sua41根长度. 资料显示平均值 (n =50) ±SD.
sua41突变体的下胚轴长度0.36cm比Col-0的0.31cm多0.05cm;在16℃条件下,sua41突变体的下胚轴长度0.10cm比Col-0的0.16cm少0.05cm,所以低温条件抑制sua41突变体的下胚轴的伸长。在常温条件下,sua41突变体的根长度0.95cm比Col-0的1.34cm少0.39cm;在16℃条件下,sua41突变体的根长0.53cm比Col-0的0.88cm少0.35cm,所以低温条件抑制sua41突变体根的伸长。说明SUA41突变影响植株下胚轴的生长,并且与温度有关。SUA41突变抑制植株根的生长,但是与温度无关。
3 讨论
植物表型及其可塑性分析是理解植物适应异质环境的一种研究方法[12],也是阐明基因功能的重要手段。本文对sua41突变体的表型及可塑性分析表明,sua41突变体植株叶片小、茎细,花序轴顶端的花蕾较少,有角果聚合现象。sua41突变体的早花表型与白光照强度和光质无关,说明,SUA41基因独立于光质途径来调节植株的开花时间。sua41突变体的下胚轴比野生型的长些,与光照、光照强度和温度有关,说明SUA41基因能够调节下胚轴的生长,但是作用较弱;特别是在低强度蓝光下sua41突变体的下胚轴明显地比野生型长,说明有一种与SUA41蛋白相互作用的感受低强度蓝光的蛋白存在[13]。sua41突变体的根长比野生型的短些,与光质有关,但是变化不明显,与光照强度和温度无关,说明其调节根的生长作用较弱。sua41突变体的开花时间与光质无关,但是其根和下胚轴的伸长与光质有关,说明SUA41基因调节各个器官的生长发育机制是不一样的。因此,SUA41基因是一个多功能的基因,不仅影响植株叶片细胞分裂和花分生组织特征基因的活动,而且影响植株下胚轴和根的细胞分裂和生长。SUA41基因调节各个器官的生长的机制有待于进一步研究。
[1] Bradshaw A D.Evolutionary significance of phenotypic plasticity in plants[J].Advanced in Genetics,1965,13:115-155.
[2] Pintado A,Valladares F,Sancho L G.Exploring phenotypic plasticity in the lichenRamallina capitata:morphology,water relations and chlorophyll content in north and south facing populations[J],Annals of Botany,1997,80:345-353.
[3]Sultan S E. Evolutionary implications of phenotypic plasticity in plants[J].Journal of Evolutionary Biology,1987,21:127-178.
[4]Bradshaw A D.Unravelling phenotypic plasticity- why should we bother?[J].New Phytologist,2006,170:644-648.
[5]Hannon G J. RNA interference[J].Nature,2002,418(6894):244-251.
[6]Shi Y. Mammalian RNAi for the masses[J].Trends in Genetics,2003,19(1):9-12.
[7]黄国文,韩玉珍,傅永福.拟南芥SUA41基因的表达和功能分析[J].遗传,2013,35(1):93-100.
[8]Parry G, Ward S, Cernac A, et al. TheArabidopsisSUPPRESSOR OF AUXIN RESISTANCE proteins are nucleoporins with an important role in hormone signaling and development[J]. Plant Cell, 2006,18(7):1590-1603.
[9]Zhang Y L, Li X. A putative nucleoporin 96 is required for both basal defense and constitutive resistance responses mediated bysuppressor of npr1-1, constitutive 1[J].Plant Cell,2005,17(4):1306-1316.
[10]Zheng X,Wu S, Zhai H, et al. Arabidopsis Phytochrome B Promotes SPA1 Nuclear Accumulation to Repress Photomorphosgenesis under Far-Red Light[J].Plant Cell,2013,25(1):115-33.
[11]Lin C, Yang H, Guo H, et al. Enhancement of blue-light sensitivity ofArabidopsisseedings by a blue light receptor cryptochrome 2 [J].Proceedings of the National Academy of Sciences of USA,1998,95:2686-2690.
[12]胡启鹏,郭志华, 李春燕,等. 植物表型可塑性对非生物环境因子的响应研究进展[J].林业科学.2008,44(5):135-142.
[13]Lin C. Plant blue-light receptors[J].Trends in Plant Science,2000,5:337-342.
Q7
A
1673-2219(2014)05-0092-05
2013-03-20
黄国文(1965-),湖南郴州人,博士,从事细胞工程技术教学和科研工作。
(责任编校:何俊华)
