以两亲性葡聚糖为表面活性剂的反胶团溶胀体系制备超大孔聚合物微球
2014-01-22王启宝
丁 然,王启宝
(1.中国矿业大学(北京)化学与环境工程学院,北京100083;2.中国科学院过程工程研究所生化工程国家重点实验室,北京100190)
随着生物技术的迅速发展,越来越多的生物大分子如蛋白质和多肽等需要进行分析、分离和纯化[1]。常用的传统生物大分子分离方法有沉淀、透析、超滤和溶剂萃取等。它们都是一些较早就建立起来的分离方法,至今仍然被广泛应用[2]。
1903年俄国植物学家Tswett,在一填有碳酸钙的玻璃柱中注入用石油醚萃取的植物色素,在室温下展层,得到不同的色素区带,后来称之为色谱[3]。开始时,色谱技术并未得到广泛关注,直至20世纪60年代,由于开发出适用于生物物质分离纯化的层析固定相,层析技术才被用于生物物质的分离纯化并得到迅速发展[4]。至今,已有丰富的色谱技术被用于生物大分子的分离。填充在层析柱内的多孔分离介质在分离过程中起到关键作用,是决定生物分子的活性、收率和成本的关键因素。一般的合成多孔介质是利用交联聚合物和液体的贫溶剂或非溶剂(称为稀释剂或致孔剂)之间的相分离而形成孔道,这种机理必然造成孔径是在纳米级(10~30 nm)。由于孔径较小,流动相在孔道内的传质过程主要依靠分子扩散完成,导致生物大分子的传质速度慢、分离时间长[5]。为了克服传质缓慢问题,研究人员提出了超大孔灌注色谱介质的定义。这种介质由于拥有贯穿孔和扩散孔结构,增强了颗粒的可渗透性[6],应用于蛋白质等生物大分子的分离纯化中,显示了分离速度快,柱容量高和产率高的优点[7-8]。商品化的 poros灌注色谱介质是采用纳米级颗粒粘结成簇聚集成团,进而形成微米级颗粒的方法来制备的,因此,通过控制纳米颗粒间的不规则聚集状态来控制孔径比较困难,造成产品批次间重复性差,收率低等问题,致使poros介质的应用停止不前[9]。
针对这一问题,本实验室开发了一种新型制备超大孔微球方法-表面活性剂反胶团溶胀法,已成功制备出超大孔聚苯乙烯微球(Polystyrene,PST)和超大孔甲基丙烯酸缩水甘油酯聚合物微球[Poly(glycidylmethaerylate),PGMA],孔径可达500 nm以上[10-11]。.这种制备方法与常规悬浮聚合类似,区别在于油相内加入较高含量的表面活性剂,表面活性剂在油相内形成大量反胶团聚集体,油相分散到水相中后,油相液滴内的反胶团可自发从外水相中吸水溶胀,此时液滴形成的是水/表/油的乳液,聚合后,水合聚合物的相分离进一步增强,水相形成大孔。
聚苯乙烯微球表面的强疏水性限制了它在生物大分子分离方面的应用[12],常规方法是用多糖进行物理吸附或化学交联对微球表面进行修饰,但是这种方法很不稳定易脱落。本研究用两亲性葡聚糖替代原聚合体系中的油相表面活性剂Span80制备超大孔聚苯乙烯微球,用电导率仪和冷场扫描电镜考察了油溶性表面活性剂在反应体系中对聚合物微球孔结构的影响规律,绘制了双连续相乳液三相图,从机理分析体系复乳液的形成过程。
1 实验
1.1 实验材料
苯乙烯(ST,北京化学试剂公司)为单体,化学纯;聚乙烯醇[Poly(vinyl alcohol),PVA -217,聚合度1700,水解度88.5%,由东京化工株式会社提供]用作水相;交联剂二乙烯基苯(DVB,北京化学试剂公司)为工业纯;过氧化苯甲酰(Benzoyl Peroxide,BPO,北京化学试剂公司,含水量25%)用作聚合引发剂,分析纯;十六烷(Hexadecane,HD,Wako Pure Chemical Industries,Japan)为疏水性稀释剂,阻止单体扩散到水相,为分析纯;Span80(北京邦德科技贸易公司)起到稳定界面的作用,化学纯;葡聚糖(Dextran,北京华力德科技有限公司,分子量5000)为亲水基团;甲基丙烯酸缩水甘油酯(GMA,Fluka,北京化学试剂公司)为疏水基团,化学纯;二甲基亚砜,4-二甲基氨基吡啶(DAMP),无水硫酸钠,无水乙醇,丙酮等均购于北京化学试剂公司。
1.2 微球制备
在烧杯中加入一定配比的单体、交联剂、稀释剂、表面活性剂和引发剂(BPO),配成油相,搅拌至BPO完全溶解.将一定量稳定剂(PVA)、无水硫酸钠溶解于去离子水中配成水相,在搅拌(300 r/min)条件下将油相分散于水相制成O/W乳液。常温反应1 h后,将温度升至65℃,65℃反应1 h,升温至75℃,75℃反应2 h,升温至85℃,85℃反应6 h。所得聚合物微球分别用水和乙醇清洗数次。微球内未聚合的物质如表面活性剂、稀释剂等再用丙酮去除。室温真空干燥后,即得成品。
1.3 两亲性葡聚糖制备
称量20.0 g相对分子质量为5000的葡聚糖,100 mL二甲基亚砜,20 mL GMA,3.2 g 4-二甲基氨基吡啶(16%),20 g葡聚糖和3.2 g 4-二甲基氨基吡啶磁力搅拌溶解于二甲基亚砜,再将溶液置于三口烧瓶,在烧瓶中加入20 mL GMA,搅拌进行水浴,桨转速 160 r/min,水浴温度37℃,反应72 h。
1.4 双连续相微乳液电导率的测定
在容量15 ml的小烧杯中加入4.5 g苯乙烯、1.5 g DVB、0.6 g十六烷、0.45 g BPO和一定比例的Span80,烧杯置于磁力搅拌器上,在搅拌的过程中每滴加0.1 mL两亲性葡聚糖水溶液(葡聚糖水溶液质量分数为20%)即测定一次溶液的电导率值,观察读数变化并绘制电导率曲线。
1.5 双连续相微乳液三相图的绘制
取一洁净的试管将单体和水按照 1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1 的比例加入试管中,加入按比例配置好的乳化剂(葡聚糖-GMA水溶液)和助乳化剂(SDS)的混合物,通过目视观察体系的相转变点,初步确定相界限[相转变点见图3]。
2 实验结果与讨论
2.1 双连续相乳液电导率测定结果
图1为不同含量Span80的双连续相乳液体系的电导率曲线,Span80在该体系中起到稳定界面的作用,表面活性剂是两亲性葡聚糖。从图可见,Span80质量分数对电导率曲线的趋势有着显著影响。当Span80质量分数为1%,5%和10%时,由于含量过低,故不能起到稳定界面的作用,乳液分层现象严重,电导率曲线的规律性也比较差,这与前期实验所制备的微球从电镜图片上观察到的现象是一致的。而当Span80质量分数达到20%以上时,其浓度能够起到稳定界面的作用,电导率也呈现出规律性,40%的曲线电导率值出现了急剧增大的区域,20%,30%和50%的曲线电导率值则均平缓上升。通过电导率-吸水量曲线的测定研究了表面活性剂用量对油包水微乳液结构的影响,确定了乳液由小液滴相互碰撞、随吸水量增大形成双连续结构的过程,连续水通道的大小和数量主要由表面活性剂用量决定。随两亲性葡聚糖用量增加,反胶团数增多,进而从外水相吸收的水分增多,形成的孔道也会增大。
2.2 表面活性剂含量对微球孔结构的影响
分别选取 Span80质量分数 20%,30%和40%电导率曲线的转折点制备聚合物微球,如图2。20%的情况由于Span80质量分数仍然偏低,体系不够稳定,所以造成球表面不均匀,球形比较圆,但是孔道很小。30%的微球孔道较20%的略大,可能是由于span80质量分数增高的原因,微球表面也明显均匀,但是孔道仍与我们的预期有差距。当Span80质量分数为40%时,制备出的微球孔道比较理想,但是由于Span80含量较高已经能够替代两亲性葡聚糖起到表面活性剂的作用,所以修饰上的亲水基含量较低。

图2 Span80用量对微球形貌和孔径的影响
2.3 双连续相乳液三相图
从三相图中笔者分析由于葡聚糖相对分子质量(5000)比较大,所以很难高浓度的加入到体系中,这给我们的启示是需要寻求一种分子量比较小的糖类来替代现有的葡聚糖进行新的尝试。
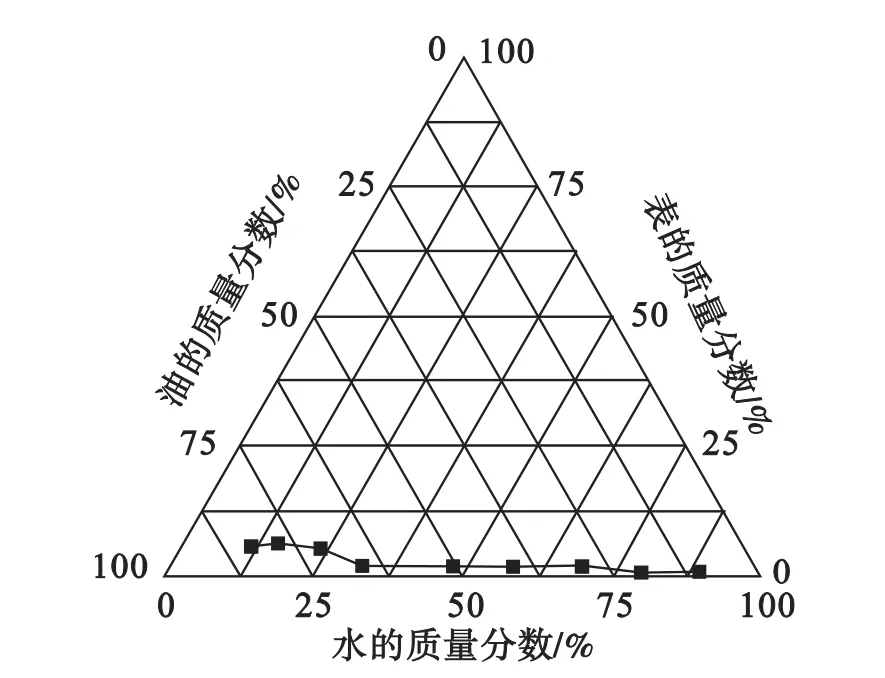
图3 表面活性剂为两亲性葡聚糖水溶液体系的三元相图
3 结论
利用表面活性剂反胶团溶胀法合成了不同孔径的PST共聚物微球,考察了Span80质量分数对复乳液体系稳定性和微球孔结构的影响,得出如下结论:
(1)油相表面活性剂Span80用量对微球大孔径有很重要的影响,与微球孔径呈正相关。Span80质量分数在40%时,微球孔径与理想情况最为接近。
(2)油相表面活性剂Span80用量对聚合体系稳定性有很重要的影响,Span80质量分数越高,体系越稳定,质量分数20%以上时电导率曲线呈现规律性。
(3)葡聚糖分子量比较大,很难高浓度的加入聚合体系内,这应该是微球亲水性不能得到良好改善的原因之一。
[1]李燕,周炜清,马光辉.超大孔聚(苯乙烯-甲基丙烯酸缩水甘油酯)共聚微球的制备及结构的调控[J].过程工程学报,2010,10(3):608 -612.
[2]李洁,何德.生物大分子分离技术:过去、现状和未来[J].生物技术通报,2006,3:49 -53.
[3]严希康.生化分离技术[M].上海:华东理工大学出版社,1996,80:109 -122.
[4]鲍时翔,姚汝华.蛋白质分离纯化与层析技术进展[J].华南理工大学学报,1996,24(12):98 -103.
[5]周炜清.新型表面活性剂反胶团溶胀法制备超大孔聚合物微球的研究[D].北京:中国科学院研究生院,2007.
[6]McCoy M,Kalghatgi K,Regnier F E,et al.Perfusion chromatography-characterization of column packings for chromatography[J].J.Chromatogr.A,1996,743(1):221-229.
[7]Rodrigues A E.Permeable packings and perfusive chromatography in protein separation[J].J.Chromatogr.B,699(1 -2):47 -61.
[8]Zhang M L,Sun Y.Cooperation of solid granule and solvent as porogenic agents novel porogenic mode of biporous media for protein chromatography[J].J.Chromatogr.A,2001,922(1 -2):77 -86.
[9]Wu L,Bai S,Sun Y.Development of rigid bidisperse porous microspheres for high-speed protein chromatography[J].Biotechnol.Prog.,2003,19:1300 -1306.
[10]Zhou W Q,Gu T Y,Ma G H,et a1.Synthesis of macroporous poly(glycidyl methacrylate)mierospheres by surfactant revue micelles swelling method[J].Eur.Polym.J,2007,43(10):4493 -4502.
[11]Zhou W Q,Gu T Y,Ma G H,et a1.Synthesis of macropomus poly(styrene-divinyl benzene)microspheres by suffactant reverse micelles swelling method[J].Polymer,2007,48(7):1981 -1988.
[12]周炜清,李娟,苏志国,等.超大孔聚合物微球的制备、表面修饰和应用[C]//2010年全国高分子材料科学与工程研讨会论文集.南昌,2010.
