婴儿配方乳粉中阪崎克罗诺杆菌解旋酶恒温基因扩增检测方法的建立
2014-01-18李永波张志胜
周 巍,张 薇,刘 亮,刘 东,李永波,田 浩,张 岩,*,张志胜*
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北省食品质量监督检验研究院,河北 石家庄 050091)
婴儿配方乳粉中阪崎克罗诺杆菌解旋酶恒温基因扩增检测方法的建立
周 巍1,2,张 薇2,刘 亮2,刘 东2,李永波2,田 浩2,张 岩2,*,张志胜1,*
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北省食品质量监督检验研究院,河北 石家庄 050091)
目的:建立一种检测婴儿配方乳粉中阪崎克罗诺杆菌的解旋酶恒温基因扩增方法。方法:根据阪崎克罗诺杆菌ITS基因设计特异性引物,优化解旋酶恒温基因扩增法反应条件UvrD helicase、T4 gp32的浓度,人工添加阪崎克罗诺杆菌确定检出限,多种致病菌在建立的解旋酶恒温基因扩增体系中扩增验证特异性,电泳检测扩增产物。结果:解旋酶恒温基因扩增法检测婴儿配方乳粉中阪崎克罗诺杆菌得到与设计序列长度一致的100 bp基因片段,检出限为10 CFU/g,优化反应条件UvrD helicase、T4 gp32的终浓度分别为0.1、5.0 μg。结论:解旋酶恒温基因扩增法用于检测婴儿配方乳粉中阪崎克罗诺杆菌的特异性强、灵敏度高、耗时短,为婴儿配方乳粉中阪崎克罗诺杆菌的快速检测提供了新的方法。
解旋酶恒温基因扩增法;婴儿配方乳粉;阪崎克罗诺杆菌;检测
食品安全问题是关系到人民大众切身利益的敏感话题。婴儿配方乳粉是针对于新生儿的特定食品,营养丰富,能够满足婴儿生长发育的日常需要,其安全性尤为重要。阪崎克罗诺杆菌是婴儿配方乳粉主要的微生物安全指标,其条件致病性和婴儿免疫系统发育的不完全性易对婴儿身体健康造成伤害,因此阪崎克罗诺杆菌的检测与控制已经成为影响婴儿食品安全的重要因素。
分子生物学技术的飞速发展,越来越多的技术已经应用于致病菌检测领域[1-10],主要有:聚合酶链式反应(polymerase chain reaction,PCR)技术、实时荧光PCR技术、荧光探针检测技术、基因芯片技术。依赖解旋酶恒温基因扩增(helicase-dependent isothermal DNAamplification,HDA)方法是近年来以PCR法为基础发展起来的体外恒温基因扩增方法,具有所需仪器设备简单、反应时间短、特异性强、假阳性低等优点,能够满足食品中致病菌快速检测的需求。
本研究拟将HDA方法应用于婴儿配方乳粉中阪崎克罗诺杆菌的检测中,利用HDA法自身的优势,开发婴儿配方乳粉中阪崎克罗诺杆菌的HDA快速检测方法,以期为检验检疫部门提供更多的方法,为HDA法在其他致病菌检测上的推广提供一定参考。
1 材料与方法
1.1 材料
1.1.1 实验菌株
本实验中所采用的菌株详见表1。

表1 实验用菌株Table 1 The strains tested in this study
1.1.2 样品
市购婴儿配方乳粉,经GB 4789.40—2010《食品微生物学检验:阪崎肠杆菌检验》检验证实不含有阪崎克罗诺杆菌。
1.1.3 试剂
DNA Marker、腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、dNTPs、引物(正向引物、反向引物) 大连宝生物工程公司;海藻糖 美国Sigma公司;大肠杆菌UvrD解旋酶 上海富众生物科学有限公司;Bst polymerase、MutL protein、T4 gp32 New England公司;Ezup柱式细菌基因组DNA抽提试剂盒生物工程(上海)有限公司。
1.1.4 仪器与设备
DXY-33A型电泳仪 北京市六一厂;UVIpro凝胶成像系统 华粤企业集团有限公司;6400型恒温金属浴上海东升仪器有限公司。
1.2 方法
1.2.1 阪崎克罗诺杆菌基因组DNA的提取[11-12]
取已经预热至44 ℃、灭菌的缓冲蛋白胨水培养基100 mL接种阪崎克罗诺杆菌(CICC21560),(36±1) ℃培养(18±2)h。取1 mL缓冲蛋白胨水培养液与10 mL改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素混合,于(44±0.5) ℃培养(24±2)h,然后取1 mL增菌液用Ezup柱式细菌基因组DNA抽提试剂盒提取阪崎克罗诺杆菌基因组DNA,-20 ℃保存备用。
1.2.2 引物设计
通过分析阪崎克罗诺杆菌基因序列,确定以16S rDNA和23S rDNA之间的ITS基因序列为靶标序列,利用Primer Premier 5.0设计引物,并通过Oligo 6.0进行验证,再进行BLAST在线比对后,经实验验证,最终确定引物。

表2 引物序列与目的扩增产物大小Table 2 The primer sequences and the size of the PCR products
1.2.3 HDA反应体系的优化及建立
采用一步法HDA反应体系:反应体系为:5 μL 10×buffer(100 mmol/L二硫苏糖醇、350 mmol/L Tris-HAc、100 mmol/L MgSO4、1 mg/mL BSA),0.04 μmol dNTPs,0.16 μmol ATP,10U Bst ploymerase,0.1 μg UvrD helicase,5.0 μg T4 gp32,25 μmol/L海藻糖,2 μL模板DNA,20 pmol引物,用ddH2O补至50 μL。其中对反应体系中UvrD helicase(0.05、0.10、0.15、0.20、0.25、0.30 μg)、T4 gp32(1.0、2.0、3.0、4.0、5.0、6.0 μg)的终浓度进行优化,最终建立HDA法检测阪崎克罗诺杆菌的反应体系。
将反应体系放入金属浴中65 ℃恒温2 h。2%的琼脂糖凝胶电泳(100 V)45 min检测产物。
1.2.4 HDA法检测阪崎克罗诺杆菌的检出限
婴儿配方乳粉购自当地超市,在人工添加阪崎克罗诺杆菌前,该乳粉按标准方法检测证实不含有阪崎克罗诺杆菌。将阪崎克罗诺杆菌人工添加到乳粉中,使样品中阪崎克罗诺杆菌浓度依次为100~108CFU/g,直接提取人工添加的乳粉中阪崎克罗诺杆菌的基因组DNA进行HDA法检测。
1.2.5 HDA法检测阪崎克罗诺杆菌的特异性
将表1中所涉及的菌种按照试剂盒法进行提取基因组DNA,按照1.2.3节建立的方法同时进行HDA检测,2%的琼脂糖凝胶电泳(100 V、45 min)检测产物。
2 2 结果与分析
2.1 HDA反应体系的优化结果

图1 阪崎克罗诺杆菌HDA法UvrD helicase优化结果Fig.1 Optimization results of final UvrD helicase concentration by Cronobacter sakazakii by HDA
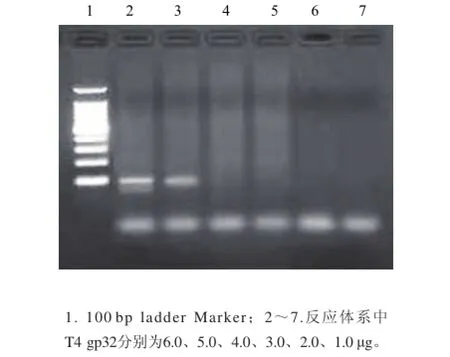
图2 阪崎克罗诺杆菌HDA法T4 gp32优化结果Fig.2 Optimization results of final T4 gp32 concentration by Cronobacter sakazakii by HDA
由图1、2可见,针对建立的阪崎克罗诺杆菌HDA检测体系,对反应体系中UvrD helicase(0.05、0.10、0.15、0.20、0.25、0.30 μg)、T4 gp32(1.0、2.0、3.0、4.0、5.0、6.0 μg)的终浓度进行优化,最终确定UvrD helicase、T4 gp32的终浓度分别为0.1、5.0 μg。
2.2 HDA法检测阪崎克罗诺杆菌的检出限
通过对婴儿配方乳粉人工添加阪崎克罗诺杆菌,浓度梯度为100~106CFU/g,进行HDA法检测。由图3可以看出,101~106CFU/g均能够获得100 bp的电泳条带,且清晰无非特异性条带,100CFU/g则没有电泳条带,可以得出,HDA法检测阪崎克罗诺杆菌的检出限为101CFU/g。
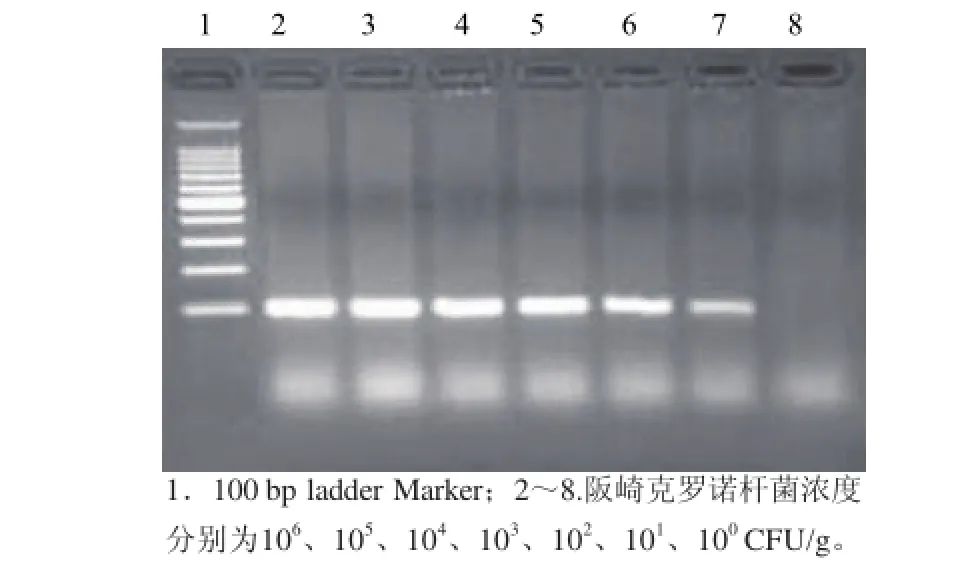
图3 阪崎克罗诺杆菌HDA法检出限Fig.3 Sensitivity of detection of Cronobacter sakazakii by HDA
2.3 HDA法检测阪崎克罗诺杆菌的特异性结果
对表1中所有菌种按照HDA法进行检测,验证该方法的特异性,通过图4可以看出,表1中4种阪崎克罗诺杆菌均能被有效地扩增出100 bp长度的目的片段,而且电泳条带清晰,无非特异性扩增;表1中其他11种菌种均未产生电泳条带,说明没有基因扩增。因此,可以证明该方法检测阪崎克罗诺杆菌的特异性较好。

图4 阪崎肠杆菌HDA法特异性Fig.4 Specificity of HDA system in detection of Cronobacter sakazakii
3 讨 论
阪崎克罗诺杆菌作为婴儿配方乳粉中主要的致病菌已经引起了高度的重视,但是检测时间长成为制约其检测效率的重要因素,目前,基于PCR技术的检测方法被广泛的开发出来,范宏英等[1]建立阪崎克罗诺杆菌环介导等温扩增快速检测技术,并与PCR检测方法进行比较,最终确定LAMP检测限为10 CFU/mL,PCR检测限为102CFU/mL,同时对36株近源菌进行特异性检测,LAMP和PCR两种方法均有很好的特异性。
阪崎克罗诺杆菌的ITS序列是其基因检测技术的主要目的序列[13-14],Baron等[15]通过分析阪崎克罗诺杆菌的基因序列,采用了ITS序列和其他的表征序列完成的阪崎克罗诺杆菌的筛选和分型工作。Roy等[16]利用ITS间区序列完成了病毒和致病菌的同体系检测,实现了阪崎克罗诺杆菌和侵染病毒的快速检测工作。
HDA方法即赖HDA方法在致病菌检测的应用已有相关报道,王建广等[17]利用HDA法对沙门氏菌进行了检测,最低检测限为460 pg/tube,与普通PCR相当;石琰璟等[18]通过HDA法对副溶血性弧菌进行了检测,最低检测限为19.9 ng/mL,与普通PCR相当。因此,HDA法对于致病菌检测是有一定的应用前景的。同时,HDA法有其自身的优势和劣势,首先,相比较普通PCR和荧光PCR,该方法不需要昂贵的设备,一般实验室就能够满足实验要求,但是HDA法不具备定量检测的能力;其次,相比环介导等温扩增技术,虽然两者均不需要昂贵的仪器设备,在等温的条件下就能够完成实验,但是环介导等温扩增技术对实验设计的要求较高,引物的灵敏度较高,这就很容易造成实验结果的假阳性,而HDA法不存在这一现象,但是昂贵的UvrD helicase、T4 gp32确实是制约该方法推广的主要因素,但随着现代化工业生产的推进,HDA法的应用前景还是非常广泛的,可成为现代化检测技术中的重要组成部分。
[1] 范宏英, 吴清平, 刘欢, 等. LAMP法和PCR法快速检测阪崎肠杆菌的比较[J]. 现代预防医学, 2012, 39(2): 383-386.
[2] IVERSEN C, FORSYTHE S. Risk profile of Enterobacter sakazakii, anemergent pathogen associated with infant milk and related products[J]. Food Microbiology, 2003, 21(11): 771-777.
[3] MANOJ K, MOHAN N, KUMAR S. Cloningand sequencing of the ompA gene of Enterobacter sakazakii and development of an ompA-targeted PCR for rapid detection of Enterobacter sakazakii in infant formula[J]. Applied and Environmental Microbiology, 2006, 72(4): 2539-2546.
[4] NOTOMI T, OKAYAMA H, MASUBCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): 631-637.
[5] BLOCK O, PELEG N, MINSTER B, et al. Cluster of neonatal infections in jerusalem due to unusual biochemical variant of Enterobacter sakazakii[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2002, 21(8): 613-616.
[6] 刘秀峰, 潘珍瑜, 齐文岚, 等. 阪崎肠杆菌荧光PCR检测方法的研究[J].中国公共卫生管理, 2012, 28(3): 373-374.
[7] 祝儒刚, 李拖平, 宋立峰. 应用基因芯片技术检测肉及肉制品中5种致病菌[J]. 食品科学, 2012, 33(14): 211-215.
[8] 封莉, 黄继超, 刘欣, 等. 食源性致病菌快速检测技术研究进展[J].食品科学, 2012, 33(21): 332-339.
[9] 曹玮, 王明忠, 王晓英, 等. 核酸检测及相关技术在食源性致病菌快速检测中的研究[J]. 卫生研究, 2008, 37(2): 245-249.
[10] 吴清平, 董晓晖, 张菊梅, 等. 阪崎肠杆菌分类与致病机制[J]. 微生物学报, 2010, 50(7): 841-846.
[11] 陈伟伟, 洪锦春, 李闽真, 等. 奶粉中阪崎肠杆菌的污染及快速检测方法的研究[J]. 食品科学, 2009, 30(4): 182-184.
[12] 王翔, 徐幸莲, 祝长青, 等. 食品中克罗诺杆菌(原阪崎肠杆菌)双重PCR检测方法研究[J]. 南京农业大学学报, 2012(1): 113-118.
[13] 高虹, 张霞, 高旗利. 奶粉中阪崎肠杆菌PCR和荧光PCR检测方法的研究[J]. 食品科学, 2006, 27(9): 203-207.
[14] GOODING C M, CHOUDARY P V. Rapid and sensitive immunomagnetic sepa-ration-PCR method for the detection of Escherichial coli O157:H7 in raw milk and ice cream[J]. Diary Research, 1997, 64(1): 87-93.
[15] BARON E, FARMER J. Enterobacteriacae: introduction and identification[J]. Manual of Clinical Microbiology, 2004, 26(6): 438-449.
[16] ROY A, FAYAD A, BARTHE G, et al. A multiplex polymerase chain reaction method for reliable sensitive and simultaneous detection of multiple viruses in citrus trees[J]. Journal of Virological Methods, 2005, 129(12): 47-55.
[17] 王建广, 姜英辉, 雷质文, 等. 应用依赖解旋酶DNA恒温扩增技术检测沙门氏菌的研究[J]. 中国卫生检验杂志, 2010, 20(12): 3289-3231.
[18] 石琰璟, 王建广, 房保海, 等. 应用依赖解旋酶DNA恒温扩增技术检测副溶血性弧菌[J]. 青岛科技大学学报, 2011, 32(1): 42-45.
Detection of Cronobacter sakazakii in Infant Formula Powder by Helicase-Dependent Isothermal DNA Amplification Assay
ZHOU Wei1,2, ZHANG Wei2, LIU Liang2, LIU Dong2, LI Yong-bo2, TIAN Hao2, ZHANG Yan2,*, ZHANG Zhi-sheng1,*
(1. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China; 2. Hebei Institute of Food Quality Supervision Inspection and Research, Shijiazhuang 050091, China)
Objective: The aim of this study was to establish a helicase-dependent isothermal DNA amplification (HAD) method for rapid and accurate detection of Cronobacter sakazakii in infant formula powder. Methods: A pair of oligonucleotide primers exclusively targeting the internal transcribed spacer (ITS) gene of Cronobacter sakazakii was designed, and the final concentration of UvrD helicase and T4 gp32 were optimized. Cronobacter sakazakii in infant formula powder was then directly detected by this method and amplification products were separated and detected by agarose gel electrophoresis. Results: An amplicon of 100 bp in length was obtained, which was the same as the designed gene fragment by HDA. The sensitivity of HDA was 101CFU/g, the optimized concentration of UvrD helicase was 0.1 μg, and T4 gp32 was 5.0 μg. Conclusion: The helicase-dependent isothermal DNA amplification assay provides a new, specific, sensitive and fast for the detection of Cronobacter sakazakii in infant formula powder.
helicase-dependent isothermal DNA amplification (HDA); infant formula powder; Cronobacter sakazakii; detection
TS201.3
A
1002-6630(2014)04-0155-04
10.7506/spkx1002-6630-201404032
2013-08-01
河北省质量技术监督局科技计划项目(100108)
周巍(1983—),男,工程师,博士研究生,研究方向为农产品加工及贮藏工程。E-mail:zhouwei0311@163.com
*通信作者:张岩(1979—),男,教授级高级工程师,博士,研究方向为食品安全。E-mail:snowwinglv@126.com
张志胜(1970—),男,教授,博士,研究方向为畜产品加工原理及技术。E-mail:13833035679@139.com
