PCR技术在小鼠CAR杆菌检测中的初步应用
2014-01-04冯育芳岳秉飞
冯育芳, 邢 进, 岳秉飞
(中国食品药品检定研究院实验动物资源研究所, 北京 100050)
PCR技术在小鼠CAR杆菌检测中的初步应用
冯育芳, 邢 进, 岳秉飞
(中国食品药品检定研究院实验动物资源研究所, 北京 100050)
目的 建立有效的CAR杆菌(Cilia-associated respiratory bacillus)PCR检测方法,并进行初步应用。方法 针对NCBI公布的CAR杆菌序列,选取大小合适的序列,合成质粒,并设计特异性引物,对实际样品进行检测,扩增出的阳性片段进行测序,验证该方法的可靠性。结果 成功建立了CAR杆菌的PCR检测方法,初步应用验证了该方法的可靠性。结论 该方法的建立为实验动物CAR杆菌的检测奠定基础。
CAR 杆菌; PCR; 应用
CAR杆菌(Cilia-associated respiratory bacillus)是由Van Zwieten于1980年分离于肺炎大鼠的肺组织,该菌可引起多种动物的呼吸系统疾病[1]。啮齿类CAR杆菌病以体质量减轻, 被毛凌乱, 咬牙或喷气声为特征[2], 几乎所有患病动物都出现黏液性支气管炎和慢性支气管扩张。目前美国、日本、意大利、澳大利亚等国家均发现并分离到该细菌, 并将其列为检测项目。虽然我国实验动物微生物国家标准中没有要求检测该菌,鉴于该细菌的危害和广泛分布,作者认为我国也有必要建立相应的检测方法。
CAR杆菌生长条件要求高, 这种生长特性给CAR杆菌的检测带来一定困难[3]; 目前常用的血清学[4]、免疫组织化学[5]和组织病理学方法均存在特异性差和灵敏度低等问题。本研究拟建立CAR杆菌PCR检测方法, 为实验动物CAR杆菌的检测奠定基础。
1 材料与方法
1.1 质粒合成
根据GenBank上CAR杆菌的两个16SRNA序列U09452.1和L11886.1进行比对分析, 筛选相对保守和特异性的序列(450 bp), 由Takara公司合成该特异性序列, 并连接到质粒, 作为后续试验的阳性对照。
1.2 引物设计
通过primer 5软件对该段保守序列进行分析,设计3对引物(表1),委托Takara公司合成。
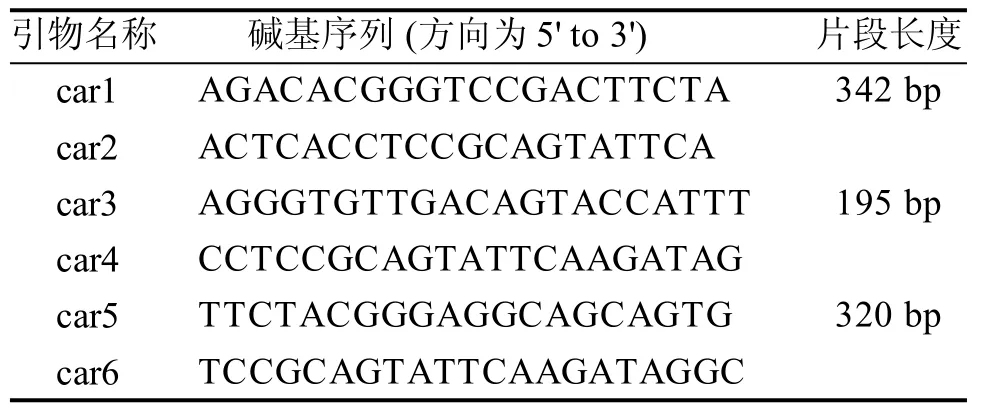
表 1 引物名称、序列及扩增片段
1.3 样本采集及DNA提取
无菌分离大、小鼠气管于气管浸液中,充分震荡,吸取200 μl液体,用Qiagen的Dneasy Blood& Tissue Kit (Cat. No.69504)提取气管浸液中的DNA,详细操作根据产品说明书。
1.4 PCR扩增体系
PCR 反应体系为 50 μl, 包括: 10 × buffer 5 μl,dNTP 4 μl, DEPC 水 29.75 μl,引物各 2.5 μl,Hs Taq 酶 2.5 μl,DNA 5 μl。通过实验对 PCR 反应条件进行优化,PCR产物进行琼脂糖电泳检测,并送Takara公司进行序列测定。
1.5 特异性测定
将该理论扩增序列以及双向引物与GeneBank上的序列进行blast比对,确定是否为特异性片段。另取本室保存的菌种(肺支原体、金黄色葡萄球菌、嗜肺巴斯德杆菌、多杀巴斯德杆菌、支气管鲍特杆菌、泰泽菌、肺炎克雷伯杆菌、肺炎链球菌、乙型溶血性链球菌、念珠状链杆菌)按上述方法提取DNA,进行PCR扩增,检测不同细菌种间PCR扩增的特异性。
1.6 敏感性测定
将所合成的质粒倍比稀释为20 μl/ml、2 μl/ml、2.0 × 10-1μl/ml、2.0 × 10-2μl/ml、2.0 × 10-3μl/ml、2.0 × 10-4μl/ml、2.0 × 10-5μl/ml、2.0 × 10-6μl/ml、2.0 × 10-7μl/ml、2.0`× 10-8μl/ml、2.0 ×10-9μl/ml、2.0×10-10μl/ml,用上述PCR方法进行测定,以确定其检测阈值。
2 结果
2.1 检测体系建立
2.1.1 检测条件确定 以合成的质粒为阳性对照模板,通过实验对CAR杆菌检测的引物进行筛选,最后确定检测引物为第3对引物(即Car5, Car6),并对PCR反应条件进行优化,最后确定最适反应条件为 94℃ 5 min; 94℃ 30 s,60℃ 30 s,72℃ 30 s,重复35个循环; 72℃ 5 min(图1)。
2.1.2 特异性测定 图2为特异性测定结果,1~8分别为肺支原体、肺炎支原体、嗜肺巴斯德杆菌、支气管鲍特杆菌、肺炎链球菌、金黄色葡萄球菌、绿脓杆菌、单核细胞增生性李斯特菌, 9为阳性对照(质粒),10为阴性对照。结果表明,只有阳性对照出现阳性条带。
2.1.3 敏感性测定 用上述方法做12个稀释度,1~12为10倍系列稀释结果,13为阴性对照。从图3可见本实验方法最高可检测2.0×10-7μg/ml。
2.2 初步应用
将所收集的小鼠、沙鼠的气管组织样本, 均按上述方法提取DNA, 并用Car5、Car6引物扩增特异性片段, 以检测是否存在Car杆菌的感染, 共检测沙鼠的气管样本65份, 小鼠的气管样本60份; 沙鼠气管中未检出CAR杆菌(图4), 小鼠检出数例CAR杆菌(图5), 并送Takara公司进行测序, 测序结果(图6)上ncbi进行比对, 结果证实为CAR杆菌上特异性序列。
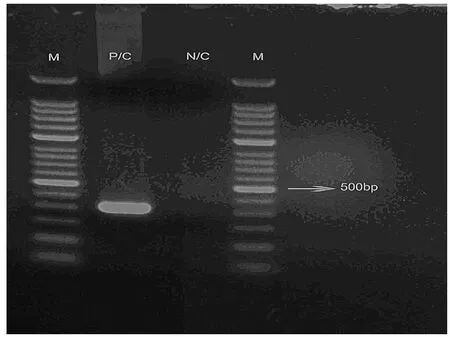
M: Marker, P/C: 阳性对照, N/C: 阴性对照图 1 合成质粒扩增结果M: Marker, P/C: Positive contorl, N/C: Negative contorlFigure 1 The Result of the plasmid

图 2 特异性试验Figure 2 The specificity test
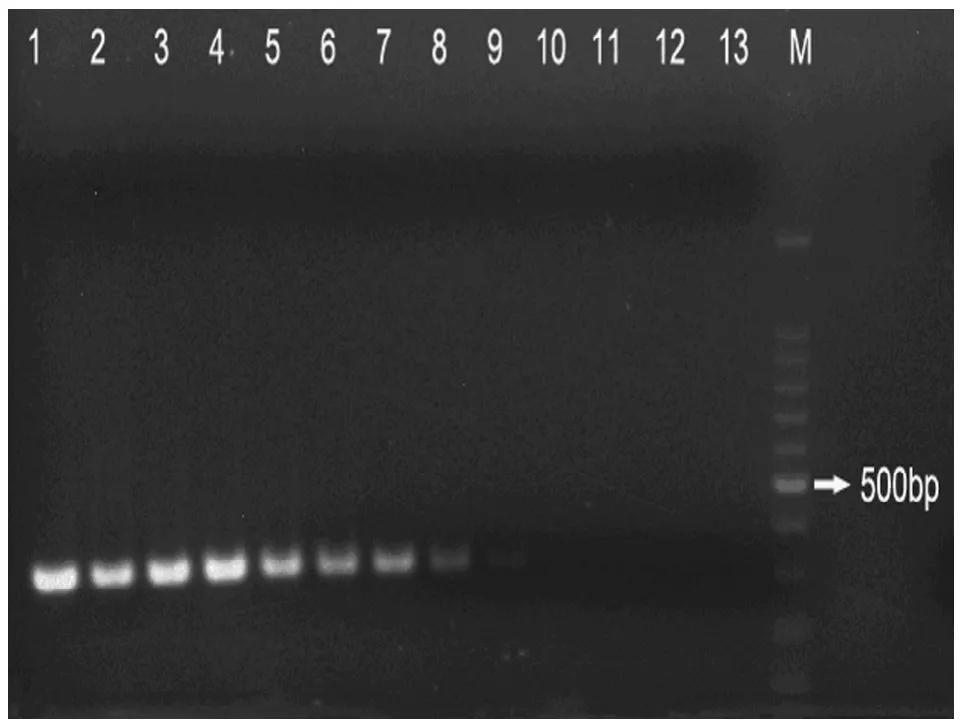
图 3 敏感性试验Figure 3 The sensibility test

图 4 沙鼠样本CAR杆菌检测结果Figure 4 The Result of samples from gerbil by the PCR assay
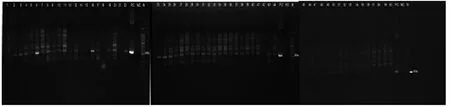
图 5 小鼠样本CAR杆菌检测结果Figure 5 The Result of samples from mice by the PCR assay

图 6 CAR杆菌阳性样本测序结果Figure 6 The sequencing Result of CAR positive sample
3 讨论
CAR杆菌主要通过直接接触传染,目前还没有证据证明可以通过污染物、带菌动物或气溶胶传染,所以哨兵动物并不能有效检测该菌。该菌在种群内传染的可能性尚无法排除,因此动物群应该定期筛查CAR杆菌,引入的动物应进行检疫,排除该菌的感染。
在所有的易感动物中,CAR杆菌以隐性感染为主。如果出现临床症状,主要是长期感染和典型的呼吸系统疾病。在呼吸道疾病的相关研究中,有慢性呼吸道疾病的动物一般是不适用的,所以在进行该类型实验前,应该排除CAR杆菌的感染。
CAR杆菌对培养有特殊要求,需含血清的细胞培养基或鸡胚,给培养带来一定难度,而血清学方法又有较高的假阳性率。基于以上原因,本实验选择PCR方法检测该菌,但国内目前没有分离到CAR杆菌标准株[3],从而无法设立阳性对照。本研究通过对ncbi上所公布的序列进行分析,找出相对保守的序列合成质粒,并将其作为标准参照品,通过对特异性引物的选择,体系的优化,敏感性、特异性的研究,建立了高灵敏度、高特异性的PCR方法,并对65份沙鼠及60份小鼠的气管样本进行筛查,沙鼠中没有发现阳性,而SPF小鼠中有阳性,随机选取2份SPF小鼠样本进行测序,Blast比对结果为CAR杆菌特异性序列,验证了该方法的可行性。所以,本研究所建立的CAR杆菌PCR检测方法可用于日常检测工作。
范薇等[6]利用CAR杆菌的特有16SrRNA基因序列片段267 bp设计引物,通过从日本实验动物中央研究所获取的CAR标准株DNA, 建立实验动物CAR杆菌16SrRNA基因PCR监测方法, 对国内455份实验动物样本进行筛查, 未检出CAR杆菌感染[6]。可能原因是所检测样本没有该菌感染或所检测样本的CAR杆菌与日本标准CAR杆菌的序列存在差异。本实验首次在SPF小鼠中检出CAR杆菌,提示我国也存在CAR杆菌的感染,应该引起实验动物科技界足够的重视。
[1] Sasaki Y, Endo R, Koido Y. Direct mutagens in the gaseous component of automobile exhaust detected with Bacillus subtilis spores[J]. Mutat Res, 1980, 79(2):181-184.
[2] Ganaway JR, Spencer TH, Moore TD, et al. Isolation,propagation, and characterization of a newly recognized pathogen, cilia-associated respiratory bacillus of rats, an etiological agent of chronic respiratory disease[J]. Infect Immun,1985, 47(2):472-479.
[3] 李红. 我国实验动物细菌学质量检测中亟待解决的若干问题[J]. 中国实验动物学杂志, 2002, 12(6):364-367.
[4] Matsushita S, Kashima M, Joshima H. Serodiagnosis of ciliaassociated respiratory bacillus infection by the indirect immunofluorescence assay technique[J]. Lab Anim, 1987, 21(4):356-359.
[5] Orós J, Matsushita S, Rodriguez JL, et al. Demonstration of rat CAR bacillus using a labelled streptavidin biotin(LSAB) method[J]. J Vet Med Sci, 1996, 58(12):1219.
[6] 范薇, 隋丽华, 刘大伟,等. 实验动物 CAR 杆菌 16SrRNA基因 PCR 监测方法的建立[J]. 中国实验动物学报, 2010,18(004):308-311.
Application of PCRMethodsfor Detection of Cilia-Associated Respiratory Bacillus in Mouse
FENG Yu-fang, XING Jin, YUE Bing-fei
(Institute for Laboratory Animal Resources, National Institutes for Food and Drug Control, Beijing 100050, China)
ObjectiveTo establish an effective PCR assay for detection of cilia-associated respiratory bacillus, and applicate the method for detection in mouse.MethodsSequence of CAR bacillus was obtained from NCBI genbank. A plasmid was structured by selecting the appropriate sequence. And primers were designed based on the sequence; the positive amplified fragments were sequenced to verify the reliability of the method.ResultsThe PCR method for detection of CAR bacillus was successfully established.ConclusionThe establishment of the method will help the detection of experimental animals for CAR bacillus.
Cilia-Associated Respiratory Bacillus; PCR; Application
Q95-33
A
1674-5817(2014)02-0136-04
10.3969/j.issn.1674-5817.2014.02.011
2013-08-19
实验动物质量检测关键技术研究(2013BAK11B01)
冯育芳(1981-), 女, 助理研究员, 硕士, 研究方向: 实验动物微生物检测, E-mail: fyf307@126.com
岳秉飞(1960-), 男, 博士, 研究员, 研究方向: 实验动物遗传学, E-mail: y6784@126.com
