人源性前列腺癌动物模型的初步建立
2014-01-04张振华沈增丽侯传玲宋春娇孙爱静
张振华, 沈增丽, 侯传玲, 宋春娇, 孙爱静
(1. 绍兴市人民医院&浙江大学绍兴医院病理科, 绍兴 312000;2. 温州医学院第一临床学院病理科, 温州 325003)
·论 著·
人源性前列腺癌动物模型的初步建立
张振华2, 沈增丽2, 侯传玲1, 宋春娇1, 孙爱静1
(1. 绍兴市人民医院&浙江大学绍兴医院病理科, 绍兴 312000;2. 温州医学院第一临床学院病理科, 温州 325003)
目的 建立中国人同一起源肿瘤不同恶性潜能前列腺癌动物模型,为研究前列腺癌转移进展机制及激素抵抗的发生机制提供理想的动物模型。方法 采用组织块外科原位移植法将人前列腺癌组织分别移植到虚拟去势组及去势组雄性裸小鼠前列腺部,成瘤后进行鼠间传代移植,选取虚拟去势组原位移植瘤、移植淋巴结转移瘤、去势组第4代淋巴结转移瘤体外培养建立细胞系,应用Boyden Chamber细胞运动实验检测细胞迁徙转移能力,描绘细胞生长曲线分析细胞增殖及激素依赖性,裸小鼠皮下异种移植瘤模型检测成瘤率、肿瘤湿重及浸润范围验证不同代移植瘤细胞在裸小鼠异种移植的生长状态。结果 第1代虚拟去势组成瘤率30%,无淋巴结转移,取移植瘤反复原位传代移植第3代成瘤率50%,盆腔淋巴结转移率40%。去势组原代移植以及来自虚拟去势组的原位移植瘤反复原位移植均未见移植瘤,源自虚拟去势组淋巴结转移瘤组织反复原位传代移植至第4代,成瘤率33%,其中一只可见盆腔淋巴结转移。三种细胞系细胞生长、迁徙以及体外裸小鼠成瘤率均有显著差别(P<0.05)。结论 裸小鼠前列腺癌原位移植反复传代可增强肿瘤成瘤率、转移力等恶性指标。以裸小鼠淋巴结转移瘤接种去势裸小鼠可筛选出激素非依赖性异种移植瘤及转移瘤。
前列腺癌; 原位异种移植; 肿瘤模型; 雄激素抵抗
人类前列腺癌的发生过程非常缓慢,欲复制出与人类前列腺癌病理过程相似的动物模型比较困难[1]。研究表明,犬类是动物中唯一可能自然发生前列腺上皮内肿瘤性增生和前列腺腺癌的动物[2],且与人类一样具有高龄发生、易于转移及晚期发生雄性激素抵抗等特点,被认为是前列腺癌研究的理想模型。但由于犬类实验较难控制且癌的自发率低,实验费用高等原因,研究受到很大的限制。随着基因工程技术的发展,转基因[3~5]和基因敲除动物模型[5~6]可成为研究和认识单一基因或数个基因在前列腺癌发生发展中作用的有效动物模型,但由于技术不成熟不能被广泛应用。诱发性啮齿类动物前列腺癌模型在发病部位、病理过程和组织分化特点与人类具有相似之处[7~8],利用已经建系的人类前列腺癌细胞株种植于免疫缺陷动物体内所建立的异种移植动物模型,虽然在研究肿瘤发生最初时间方面存在一定缺陷,但在研究前列腺癌由雄激素依赖型向抵抗型演进、转移机制、药物疗效等方面更加有用。
常用的人前列腺癌细胞系有LNCaP、PC3、CRW-22和LuCa-23等[9],均为来源于美国人的细胞株,从中国人前列腺癌患者新鲜标本中分离并建立具有不同恶性潜能的前列腺癌异种移植动物模型鲜见报道,这在一定程度上限制了对中国人群或亚洲人群前列腺癌的深入研究。
本课题采用本院未经治疗的前列腺癌患者新鲜手术标本, 将肿瘤直接进行雄性BALB/c裸小鼠和去势雄性BALB/c裸小鼠的前列腺进行原位移植, 去势组虚拟雄激素消融治疗后肿瘤进展的情况, 传代多次直至出现不同恶性潜能肿瘤, 对表现出对激素的依赖程度以及原位移植、转移等不同恶性潜能的移植瘤建立细胞系并进行稳定原位移植,旨在为研究前列腺癌的进展及雄激素抵抗发生提供良好动物模型。
1 材料与方法
1.1 材料
1.1.1 标本获取及处理 绍兴市人民医院住院接受手术切除的前列腺癌标本,离体后新鲜状态下放入无菌PBS中低温保存转移至细胞培养室,无菌操作取0.5 cm3大小,用于移植,剩余部分10%中性福尔马林固定后行常规病理学检查。
1.1.2 主要试剂和抗体 胶原酶、人工合成雄激素R1881购自Sigma公司; BD Matrigel基质胶购自上海杰海生物科技有限公司; 戊巴比妥钠购自中国医药上海化学试剂公司; 免疫组化用一抗包括雄激素受体(AR)、甲基酰基辅酶消旋酶(P504S)、前列腺特异性抗原抗体购自福州迈新生物科技有限公司。采用全自动免疫组化仪(Leica Bond-Max)配套染色液购于Leica公司。
1.2 动物实验
1.2.1 实验动物及分组 SPF级4~6周龄雄性BALB/c裸小鼠, 体质量22~25 g, 购于上海斯莱克实验动物有限责任公司[SCXK(沪)2007-0005 ], 垫料饲料及饮水均无菌处理。在绍兴市医学研究中心动物实验室饲养并进行实验[SYXK(浙)2009-0139]。动物分为虚拟去势组和去势组,实验一周前实施手术。
1.2.2 去势/虚拟去势手术及原位移植瘤模型的建立 体积分数1%戊巴比妥钠(60~80 mg/kg)麻醉裸小鼠后,仰卧位消毒下腹部皮肤及生殖器,去势手术分别在两侧阴囊前部剪开约1 cm左右横行开口后游离睾丸摘除并缝合; 虚拟去势术牵出睾丸附睾后复位缝合; 移植瘤建立采取下腹部正中线近生殖器处剪开一约1 cm左右的纵行开口。游离肌肉剪开腹膜,游离膀胱并将两侧脂肪组织推开,牵出部分膀胱及精囊腺充分暴露前部前列腺(左右各一叶),中间可见管状小沟,用眼科剪剪开3 mm左右开口后将事先准备好的组织块嵌入,用22号针头7-0可吸收缝线缝合固定,脏器复位后将腹膜、肌肉、皮肤逐层缝合。
1.2.3 细胞系裸小鼠背部皮下移植瘤鉴定细胞系成瘤能力 取对数期生长细胞系制成单细胞悬液(2×106/0.2 ml), 用1 ml注射器6号针头接种于裸小鼠双侧背部皮下,每种细胞系接种20只,虚拟去势裸小鼠和去势裸小鼠各10只。隔日观察并记录肿瘤生长状态。8周后处死裸小鼠解剖测定肿瘤湿重。
1.3 细胞实验
1.3.1 细胞系的建立 选取A组初代原位移植瘤灶(LA1)、A组原位移植第三代淋巴结转移瘤灶(LAN1)、B组第4代淋巴结转移灶(LBN1)0.5~1 cm3,无菌RPMI1640培养液中冰盒中保存转移至细胞培养室,无菌操作台下PBS冲洗干净后眼科剪剪切30 min以上至乳糜状,PBS稀释, 800 r/min离心, 弃上清置含15%FBS的RPMI1640培养液体外培养,贴壁后换液.每日观察细胞生长状态,待细胞融合成片贴壁后弃培养液用D-hanks冲洗2次,加入0.1%胰酶(含EDTA)溶液2 ml, 轻摇培养瓶, 使消化液铺满细胞,消化2~3 min。显微镜下观察至细胞变圆、融合细胞彼此分离少数细胞悬浮后加入含10%胎牛血清的RPMI-1640培养液10 ml终止消化,反复吹打使细胞分散,将细胞悬液分装于两个培养瓶中做好标记 ,37℃、5%CO2孵育箱静置培养,传代,建立上述肿瘤体外培养细胞系。
1.3.2 细胞计数及增殖曲线的描绘 细胞系以3×104/孔的密度接种于24孔培养板,每个细胞系一个培养板,37 ℃、5%CO2孵育箱培养过夜后,用胰酶消化细胞后加培养液吹打混匀,取细胞悬液用0.4%台盼蓝染色计数活细胞数,每24小时计数一次每次消化计数3孔求平均值。分别以时间为横坐标及细胞数为纵坐标描绘生长曲线。
1.3.3 TRANSWELL侵袭实验 将冻存于-80℃的BD Matrigel放入4 ℃冰箱过夜使其变成液态。冰块上用无血清PRMI1640将基质胶稀释到0.5 mg/ml上室每孔60 μl放入37 ℃培养箱中静置半小时。将细胞系培养液倒出, D-hanks液清洗两遍后加0.1%胰酶消化2~3 min加培养液吹打瓶底制成单细胞悬液, 计数板细胞计数调整细胞密度为105/ml, 200 μl/孔加入上室, 上室预先用无血清培养基洗一次。用无菌镊夹取插件, 下室加500 μl/孔完全培养基放入CO2细胞培养箱中培养。取出上室, 弃去孔中培养液, 用PBS清洗2遍, 甲醇固定30 min, 将小室适当风干。0.1%结晶紫染色20 min, 用棉签轻轻擦掉上层没有迁移的细胞, 用PBS洗3遍。400倍显微镜下随即5个视野观察细胞, 记数并计算侵袭指数。
1.4 病理学检查
1.4.1 常规标本 手术切除标本及移植瘤离体后,10%中性福尔马林固定12~24 h,常规脱水、石蜡包埋,制备4 μm连续切片,用于HE染色及免疫组化染色。
1.4.2 免疫组化染色 Leica Bond-Max全自动免疫组化仪程序设定为: 72 ℃脱蜡2次, 室温1次, 酒精冲洗3次,缓冲液冲洗3次。修复液pH9.0ER2抗原修复液, 100 ℃抗原修复20 min, 35 ℃缓冲液冲洗3次, 室温3 min。特异性过氧化物酶阻断10 min,缓冲液冲洗3次。一抗室温孵育30 min,缓冲液冲洗3次,增效液(Post primary) 8 min,缓冲液冲洗3次。二抗8 min,缓冲液冲洗2次,各2 min,去离子水1次。DAB 10 min,去离子水冲洗3次。苏木素复染5 min,去离子水冲洗1次,缓冲液冲洗1次,去离子水冲洗1次。梯度酒精脱水、透明,中性树胶封固,显微镜检。
结果判定: AR定位于细胞核,PSA和P504S定位于细胞质,阳性细胞比率超过20%视为阳性。
1.5 统计分析
计量资料采用多个样本均数方差分析,使用SPSS17.0软件包进行统计分析,取α=0.05作为检验水准。
2 结果
2.1 临床资料
77岁男性, PSA 13 ng/ml, 术前未经过任何治疗。大体观,弥漫增大前列腺根治标本, 大小5 cm×5 cm×4 cm。镜检癌细胞轻度异形,排列成不规则腺管状(图1A, HE×200),免疫组化示AR、P504S、PSA阳性(图1B、C、D, ×200)组织学诊断: 弥漫浸润性生长前列腺癌,Gleason评分3+3=6。
2.2 肿瘤原位移植瘤形成
第1代移植9周后解剖裸小鼠,10只虚拟去势组中3只在前列腺肿瘤接种部位形成移植瘤,呈白色鱼肉状质韧,边界尚清楚,无包膜(图2), 成瘤率30%。无淋巴结转移。去势组未见移植瘤形成。取原位移植瘤传代移植第2代成瘤率50% 无肉眼所见淋巴结转移,第3代成瘤率50%,其中4只见淋巴结转移,B组未见移植瘤形成。淋巴结转移瘤接种B组裸小鼠初代(总第4代)1只可见原位移植瘤,成瘤率10%,用该移植瘤反复传代,第2代(总第5代)、第3代(总第6代)、第4代(总第7代)原位成瘤率分别为10%、10%和30%,第4代其中一只可见盆腔淋巴结转移(表1)。
2.3 细胞增殖及激素依赖性分析
虚拟去势组原位移植瘤(LA1)、移植淋巴结转移瘤(LAN1)、去势组第4代淋巴结转移瘤进行体外培养(LBN 1)。三种细胞系分别置常规培养液(10%FBS的RPMI1640培养液)、低浓度血清培养液(3% FBS的RPMI1640培养液)及雄激素添加培养液(3% FBS的RPMI1640含1.0 nmol人工合成雄激素R1881)分别培养,显示在常规培养液中与LA1相比,LAN1和LBN1细胞具有更高增殖能力,且更早进入对数生长期; 在低浓度血清培养液中LA1和LAN1细胞增殖能力相似, LBN1细胞具有明显高的增殖能力; 而在雄激素添加培养液中三种细胞系显示相似的细胞增殖能力, 提示LA1、LAN1、LBN1体外增殖能力不同, LA1、LAN1显示激素依赖性生长特性而LBN1细胞获得雄激素抵抗生长特性(图3)。
2.4 细胞侵袭分析
Matrigel基质胶具有模仿体内细胞外基质的功能, 一定程度上反映细胞转移侵袭能力, 侵袭实验分析结果显示三种细胞系的侵袭指数分别为3.658%、4.135%和 7.201%,LBN1约为LA1的两倍。三种细胞系侵袭指数方差分析结果显示LA1与LBN1差异有统计学意义(P<0.05)。
2.5 裸小鼠背部皮下移植瘤模型鉴定细胞系成瘤能力
LA1、LAN1和LBN1细胞系分别于裸小鼠背部皮下移植后28 d、28 d和22 d,可在移植部位触摸到移植瘤。8周后解剖,可见肿瘤在局部皮下生长, 未见明显浸润, 未见肝肺转移。组织学观察显示移植瘤细胞呈团片状生长,局部可见腺管形成趋势, 免疫组化证实AR表达阳性(图4)。虚拟去势裸小鼠皮下移植瘤肿瘤湿重三组间无统计学差异。去势裸小鼠证实LA1、LAN1为雄激素依赖性生长,LBN1具有雄激素抵抗生长特性。LBN1细胞在去势和虚拟去势鼠间肿瘤湿重无统计学意义(表2)。
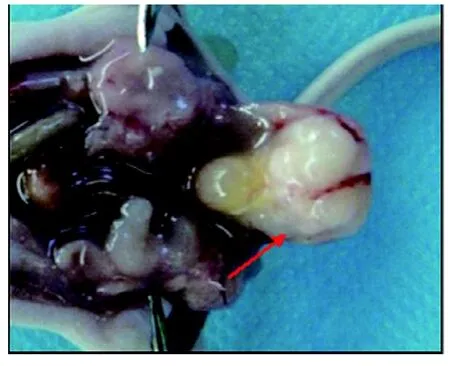
图 2 裸小鼠原代原位移植瘤Figure 2 The primary orthotopic transplanted tumor
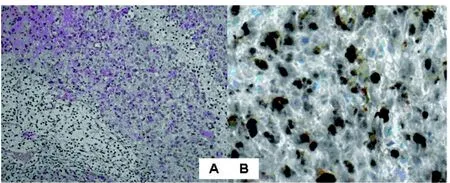
图 4 LBN1细胞裸小鼠异种移植瘤A: 组织学结构(HE×200); B: AR免疫组化染色(×400)Figure 4 LBN1 subcutaneous transplanted tumorA: histological structure(HE×200); B: AR immunohistochemical staining(×400)
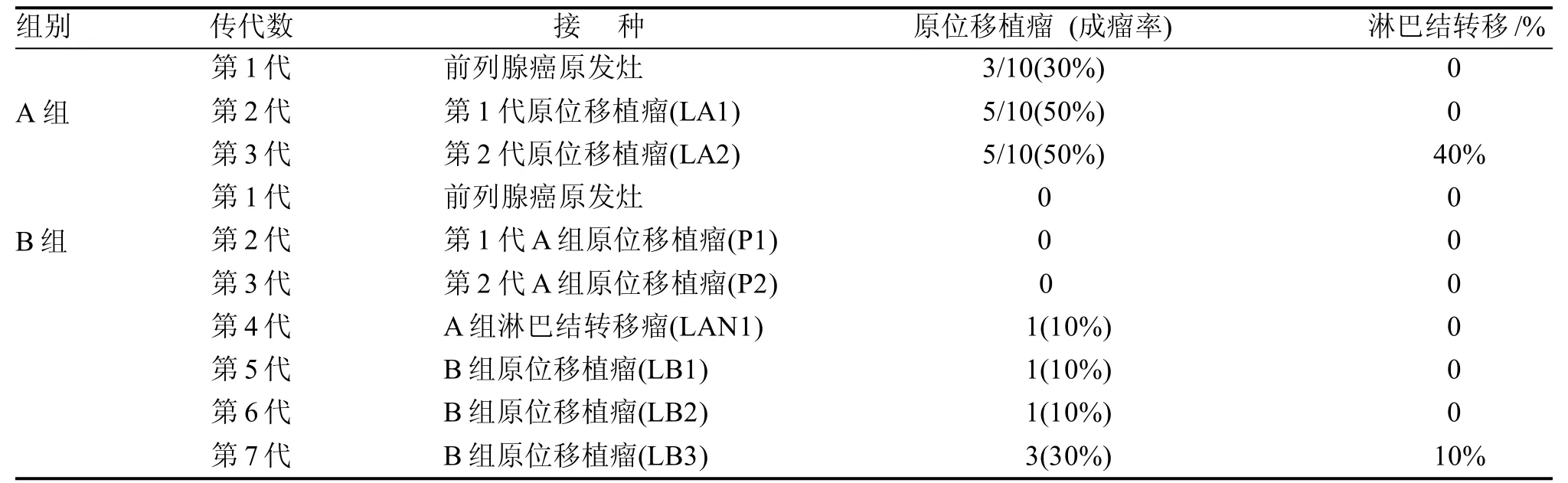
表 1 人源前列腺癌裸小鼠前列腺原位移植
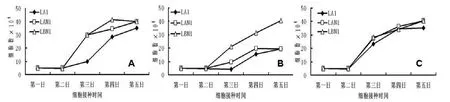
A:常规培养液; B:低浓度血清培养液; C:和雄激素添加培养液图 3 细胞增殖曲线A: common medium; B: low serum medium; C: androgen containing mediumFigure 3 The cell proliferation curve
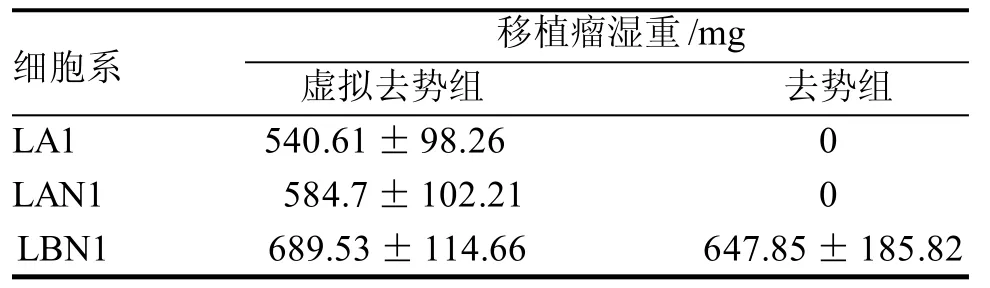
表 2 三种细胞系在裸小鼠皮下移植瘤的形成
3 讨论
肿瘤的转移不仅与自身分泌的肿瘤因子有关,而且很大程度上取决于肿瘤胞与肿瘤微环境的相互作用来推动分离的亚群细胞转移[10]。如肿瘤相关巨噬细胞可诱导肿瘤基质降解,增强肿瘤迁移能力及血管形成能力。组织块移植包含了肿瘤的所有成分,更能代表肿瘤的初始情况。本实验表明组织块原位移植能够稳定传代并发生转移适用于研究肿瘤的进展。
激素消融治疗是转移性前列腺癌的基础治疗手段,但大部分病人激素消融后发生雄激素抵抗,肿瘤复发转移导致病人死亡。当前对于转移性前列腺癌缺乏有效的治疗手段,间接反映了对肿瘤进展机制不了解[11]。前列腺癌转移进展机制的研究一直受阻于临床相关的实验模型,当前模型主要是通过购买国外高度恶性细胞系,培养制成细胞悬液进行皮下移植或者肾被膜注射移植诱发肿瘤模型[12]。这并不能确切反映国人前列腺癌的发生进展过程。本课题采用国人前列腺癌组织块原位移植方法分别移植到去势组及虚拟去势组裸小鼠并传代筛选出生物学形状不同的肿瘤细胞进行建模,目的在于探讨如何能建立模拟人体内肿瘤的进展及分化的裸小鼠肿瘤模型,为研究肿瘤转移进展及激素抵抗发生机制奠定基础。本实验证实组织块原位移植能模拟肿瘤在人体内的生长情况,移植效果与文献报道的细胞悬液原位注射以及组织块肾被膜移植等方法对比,人前列腺癌组织块原位移植具有较高的成瘤率,与肿瘤生长初始环境及微环境对肿瘤的生长及调控自我分化有重大影响这一理论吻合。我们尝试了用病人组织块制备未经筛选的混合细胞悬液,参考李志玲等[13]前列腺癌原位模型建立方法,采用注射移植方式移植到前列腺及精囊腺部,未能取得满意效果。精囊腺质地较脆、前列腺被膜紧张,细胞悬液易渗出流入腹腔可能造成人为性转移。组织块原位移植的缺点在于操作要求较高,虽然采用眼科手术器械操作,但由于裸小鼠前列腺体积较小能移植的组织块较小,而且会损伤组织块及宿主脏器影响实验结果。
经过不间断的传代移植, 肿瘤成瘤率以及转移能力等恶性潜能逐渐增强, 继而从虚拟去势裸小鼠淋巴结转移癌获得激素非依赖性质并在去势裸小鼠第4代传代移植中出现淋巴结转移。选取具有不同生物学性状的初代虚拟去势裸小鼠原位移植瘤、初代虚拟去势裸小鼠淋巴结转移瘤以及初代去势裸小鼠淋巴结转移瘤作为不同恶性潜能的代表建立的细胞系证实三种细胞在增殖、迁移、激素依赖等性能上存在显著性差别。为进一步研究中国人前列腺癌的发展以及激素抵抗发生机制提供了的良好模型。
综上所述: 采用组织块裸小鼠前列腺原位外科移植可模拟肿瘤在人体内的生长环境建立裸小鼠前列腺癌异种原位移植模型;裸小鼠前列腺癌原位移植反复传代可增强肿瘤成瘤率、转移力等恶性指标;以裸小鼠淋巴结转移瘤接种去势裸小鼠可筛选出激素非依赖性异种移植瘤及转移瘤。为进一步研究中国人前列腺癌的发展以及激素抵抗发生机制提供了的良好模型。
[1] 储剑虹, 孙祖越. 人前列腺癌移植性转移动物模型的研究进展[J].实验动物与比较医学, 2005, 25(2):119-125.
[2] Leav I, Schelling KH, Adams JY, et al. Role of canine basal cells in prostatic post natal development, induction of hyperplasia, sex hormone-stimulated growth; and the ductal origin of carcinoma[J]. Prostate, 2001, 47(3):149-163.
[3] Kasper S. Survey of genetically engineered mouse models for prostate cancer: analyzing the molecular basis of prostate cancer development, progression, and metastasis[J]. J Cell Biochem, 2005, 94(2):279-297.
[4] Nguewa PA, Calvo A. Use of transgenic mice as models for prostate cancer chemoprevention[J]. Curr Mol Med, 2010,10(8):705-718.
[5] Kerkhofs S, Denayer S, Haelens A, et al. Androgen receptor knockout and knock-in mouse models[J]. J Mol Endocrinol,2009, 42(1):11-17.
[6] Cotroneo MS, Haag JD, Zan Y, et al. Characterizing a rat Brca2 knockout model[J]. Oncogene, 2007, 26(11):1626-1635.
[7] Maini A, Archer C, Wang CY, et al. Comparative pathology of benigh prostate hyperplasia and prostate cancer[J], In Vivo, 1997, 11:293-299.
[8] Pylkkanen L, Mkela S, Santti R. Animal models for the preneoplastic lessons of the prostate[J]. Eur Urol, 1996, 30:243-248.
[9] 王元天, 孙颖浩, 邱镇, 等. 人类前列腺癌裸小鼠原位移植瘤模型的建立[J]. 中华泌尿外科杂志, 2005, 26(3):208-209.
[10] Fidler IJ. The pathogenesis of cancer metastasis: the ‘seed and soil’ hypothesis revisited[J]. Nat Rev Cancer, 2003, 3:453-458.
[11] Huggins C and Hodges CV. Studies on prostatic cancer: The effects of castration, of estrogen and of androgen injection on serum phosphatases in metastaic carcinoma of the prostate[J]. Cancer Res, 1941, 1:293-297.
[12] Pfitzenmaier J, Quinn JE, Odman AM, et al. Characterization of C4-2 prostate cancer bone metastases and their response to castration[J]. J Bone Miner Res, 2003, 18:1882-1888.
[13] 李志玲, 刘向云, 张晓芳, 等. 不同细胞株建立人前列腺癌裸小鼠移植模型及转移特性比较[J]. 实验动物与比较医学杂志, 2006, 26(4):207-212.
Establishment of Different Malignant Potential Prostate Cancer Animal Model from Same Origination
ZHANG Zhen-hua2, SHEN Zeng-li2, HOU Chuan-ling1, SONG Chun-jiao1, SUN Ai-jing1
(1. Department of Pathology, Shaoxing People's Hospital & Shaoxing Hospital of Zhejiang University,Shaoxing 312000, China; 2. Department of Pathology, The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China)
ObjectiveSupplying ideal animal model for investigating the mechanism of tumor progress and hormone resistant in prostate cancer.MethodsProstate cancer tissue was obtain via prostatectomy and cut into specimens which orthotopic transplanted into castrate group and shamcastration group nude mice .T hen tumor was harvest and transplant to next generation. until emergence of lymph node metastasis in two groups.. The cell growth curve of cell lines is used to evaluate their growth condition. Boyden chamber is used to evaluate metastasis ability of cell lines. The rate of tumor formation, weight of tumor and range of tumor infiltration of three cell lines was confirmed by subcutaneous transplant.ResultThe tumorgenic in sham-castration group is 30% without lymph node metastasis in first generation, after three passages is 50%, lymph node metastasis in pelvic is 40%. In castrate group, no tumor formation and lymph node metastasis in first generation. One pelvic lymph node metastasis is find after the forth passages which tumor origin from the lymph node metastasis of shamcastration group.. There are significant differences of cell proliferation transfer ability and tumor rate in vitro and vivo between three cell lines. (p<0.05).ConclusionIt’s feasible that applying surgical specimens of prostate cancer to establishment .nude mice orthotopic graft model. It is possible to screen heterotransplant tumors and metastasis tumors without hormone dependency by graft rat’s lymph node metastasis tumor into castrate nude mice.
Prostate cancer; Orthotopic xenotransplantation; Tumor model; Androgen resistance
Q95-33
A
1674-5817(2014)02-0083-06
10.3969/j.issn.1674-5817.2014.02.001
2013-09-23
浙江省医学重点学科建设计划(GJSX-010-004); 浙江省公益性技术应用研究计划项目(实验动物2011C37081); 浙江省自然科学研究基金(Y13H160104)
张振华(1986-), 男, 硕士, 医师,E-mail: zzhsg2005@163.com
孙爱静(1963-), 女, 医学博士, 教授, 从事实验动物学研究和肿瘤病理学研究,E-mail: sun_aijing@hotmail.co.jp
