小麦SBEⅡb基因的克隆及其与PDS基因串联VIGS载体的构建
2014-01-02南富波李淼淼王昊龙韩俊杰刘伟李卫华
南富波,李淼淼,王昊龙,韩俊杰,刘伟,李卫华
(石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子 832003)
病毒诱导基因沉默(virus induced gene silencing,VIGS)在研究植物基因功能方面因其具有简单、快速、高效的特点,成为近几年来备受学者们亲睐的新技术[1-2]。小麦淀粉分支酶(starch branching enzyme,SBE)SBEⅡb基因是淀粉合成过程中的关键酶基因之一[3]。八氢番茄红素脱氢酶(phytoene desaturase,PDS)是在光合作用过程中类胡萝卜素合成的关键酶,类胡萝卜素在植物中具有光保护作用,该基因沉默会引起沉默区域失绿,因此在VIGS实验中常用作指示基因[4-5]。
自1995年Kumagai等[6]首次利用重组烟草花叶病毒(tobacco mosaic virus,TMV)在本氏烟(Nicotiana benthamiana)中成功沉默了植物内源PDS基因以来,2002年Holzberg等[4]首次利用VIGS技术以大麦条纹花叶病毒(Barley stripe mosaic virus,BSMV)为载体在大麦上实现了PDS基因沉默。2005年Scofield等[7]率先成功实现BSMV诱导小麦苗内源基因沉默。最近Bennypaul等[5]还通过构建PDS基因的BSMV重组载体研究VIGS的遗传性。
BSMV-VIGS技术在小麦上的应用主要是研究植株抗病虫等过程中基因的功能,如贺洋等[8]研究了TaTST基因和小麦白粉病的关系。Scofield等[7]研究了由Lr21介导的抗叶锈病过程中相关基因的功能。Van等[9]研究发现WRKY53基因的转录因子和苯丙氨酸脱氨酶基因与小麦抗蚜虫有关。在品质方面,VIGS技术研究了与蛋白质及淀粉合成有关的基因功能。Ma等[10]在小麦中利用BSMV-VIGS技术研究发现HMW-GS1Bx14和小麦籽粒中麦谷蛋白聚合体合成有关。Bennypaul等[5]也利用BSMV-VIGS技术在小麦渐成的籽粒中展示了基因沉默。通过构建携带有GBSS基因片段的反义结构(pγ.wWxa)和发夹结构 (pγ.wWxhp)在小麦籽粒中实现了GBSS基因的沉默,发现反义结构使得直链淀粉含量降低了32.2%~40.6%,发夹结构使得直链淀粉含量降低了35.8%~39.1%,结果表明GBSS基因参与了直链淀粉的合成过程。
SBE被认为能影响植物淀粉的精细结构[11-12]。有研究表明SBEⅡb编码基因的突变(玉米ae突变体)可使玉米胚乳中直链淀粉的含量达到50%[13],说明SBEⅡb基因对玉米胚乳直链淀粉含量的影响很大。Nishi等[13]研究表明,水稻SBEⅡb缺失突变体中,直链淀粉含量明显增加,但支链淀粉中DP(degree of polymerization,聚合度)≤13的短链减少,从而进一步证实了SBEⅡb与水稻短分支链的合成有关。Francesco等[14]通过RNAi技术研究发现SBEIIa基因沉默的小麦植株,直链淀粉含量有显著的提高。但是,目前在利用BSMV-VIGS技术研究与小麦淀粉合成直接相关的SBEⅡb基因功能方面尚未见报道。
本研究选择小麦淀粉合成关键酶基因SBEⅡb为目的基因,以PDS基因为指示基因,以BSMV为载体,拟构建BSMV:γ-SBEⅡb:PDS重组载体,为下一步利用VIGS技术在小麦上研究SBEⅡb基因与小麦淀粉合成的关系奠定基础。
1 材料与方法
1.1 材料
小麦品种新春11号种子由石河子大学农学院提供;大麦条纹花叶病毒的α、β、γ及γ-PDS载体由加拿大农业部列桥研究中心John Lu博士惠赠;Trizol试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司;限制性内切酶及cDNA第一链合成试剂盒购自Thermo公司(北京);pMD19-T Vector、T4DNA Ligase 购自 TaKaRa 公司(大连);2×Es Taq MasterMix(含染料)酶购自北京康为世纪生物科技有限公司;引物合成及测序由北京六合华大基因科技股份有限公司完成。
1.2 方法
1.2.1 小麦籽粒总RNA提取及cDNA的合成
小麦新春11号种植于大田,管理方式按大田管理。对开花的植株进行标记,取花后12 d的小麦穗子,液氮研磨,按照本实验室改良的Trizol法提取总RNA[15],用核酸分析仪和琼脂糖凝胶电泳检测RNA质量,并用cDNA第一链合成试剂盒对其进行逆转录。
1.2.2 SBE IIb、PDS基因片段的克隆及拼接
根据GenBank中公布的小麦SBE IIb(AY740401.1)、PDS(FJ517553.1)基因序列,选取特异序列设计引物,并设计互补引物,引入PacⅠ和NotⅠ酶切位点(表 1)。
SBEⅡb、PDS基因片段的PCR扩增体系(10 μL):2×Es Taq MasterMix 5 μL、cDNA 和上、下游引物(10 mmol/L)各 1 μL、ddH2O 2 μL。
扩增程序:94℃预变性5 min,94℃变性40 s,56 ℃退火 40 s,72 ℃延伸 40 s,共 30 个循环;72℃延伸10 min,PCR产物用1%的琼脂糖凝胶电泳检测,回收纯化目的条带。
将上述纯化后的目的条带经浓度测定后等量混合,进行SBEⅡb、PDS基因片段的PCR拼接扩增。
扩增体系为:SSBE Ⅱb的 PCR 产物 1 μL、PDS的 PCR 产物 1 μL、2×Es Taq MasterMix 12.5 μL、ddH2O 10.5 μL。
按扩增程序:94℃预变性4 min;94℃变性40 s,55 ℃退火1 min,72 ℃延伸1.5 min,扩增5个循环后,加入SBE IIb上游和PDS下游引物各1 μL、Taq MasterMix 12.5 μL、ddH2O 10.5 μL 按扩增程序:94℃预变性4 min,94℃变性40 s,55℃退火40 s,72℃延伸40 s,扩增30个循环,72℃延伸10 min。
PCR产物用1%的琼脂糖凝胶电泳检测,回收目的条带,连接pMD19-T Vector,转化大肠杆菌TOP10。菌液PCR为阳性的菌落提取质粒酶切验证,阳性克隆送北京六合华大基因科技股份有限公司进行测序,命名为pMD19-SBEⅡb:PDS。

表1 SBEⅡb、PDS基因片段扩增引物Tab.1 PCR primers of SBEⅡb and PDS genes partial sequences
1.2.3 SBEⅡb:PDS基因的VIGS重组载体构建
用限制性内切酶PacⅠ/NotⅠ双切pMD19-SBEⅡb:PDS,回收纯化SBEⅡb:PDS基因片段。同时用PacⅠ/NotⅠ酶切 BSMV:γ-PDS 载体,回收纯化大片段BSMV:γ。然后将回收的SBEⅡb:PDS基因片段和BSMV:γ连接,转化大肠杆菌TOP10,菌液 PCR阳性菌落提取质粒酶切验证。
2 结果与分析
2.1 小麦籽粒总RNA质量分析
提取的小麦总RNA,经核酸分析仪检测显示浓度在2000 ng/μL以上,OD260/OD230在2.00以上。电泳结果显示,28和18 S条带明亮、清晰,说明提取的RNA质量较好(图1)。
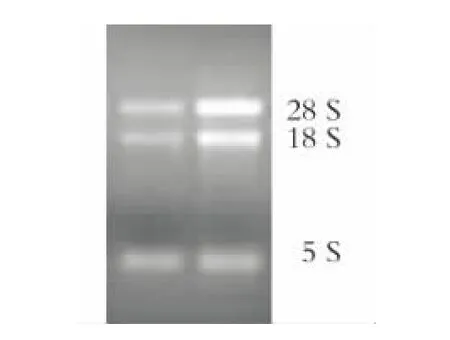
图1 小麦穗子总RNA琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of total RNA of wheat endosperm
2.2 SBEⅡb、PDS基因片段的克隆及拼接结果
PDS、SBEⅡb基因片段(图2)及拼接的PCR扩增结果(图3)显示,电泳条带清晰,大小与预期一致。SBEⅡb:PDS基因片段与pMD19-T连接,转化大肠杆菌TOP10。菌液PCR阳性菌落提取质粒酶切验证,酶切条带大小与预期相符(图4)。
测序结果(表2)显示:
获得1条通读的重组基因片段,其中克隆的SBEⅡb和PDS基因片段分别长181、190bp,因在引物的接头处有1个“A”碱基简并,其组合片段长为370 bp。
序列分析表明:SBEⅡb基因片段与小麦SBEⅡb(AY740401.1)序列同源性 97%;PDS基因片段与PDS(FJ517553.1)序列同源性为97%。

图2 PDS和SBEⅡb基因片段的PCR扩增电泳图Fig.2 PCR amplification products of PDS and SBEⅡb gene by agarose gel electrophoresis

图3 SBEⅡb、PDS基因片段的PCR拼接结果Fig.3 PCR amp lification products of SBEⅡb and PDS gene by agarose gel electrophoresis

图4 pMD19-SBEⅡb:PDS酶切验证Fig.4 The double digestion of pMD19-SBEⅡb:PDS plasmids

表2 SBEⅡb:PDS基因片段测序及拼接结果Tab.2 The sequencing result of gene segments
2.3 SBEⅡb:PDS基因的VIGS重组载体构建
将构建的BSMV:γ-SBEⅡb:PDS重组载体转化感受态大肠杆菌TOP10,菌液PCR阳性菌落提取质粒酶切验证。双酶切鉴定结果(图5)表明,目的条带大小与预期相符,说明构建BSMV:γ-SBEⅡb:PDS重组载体成功。

图5 γ-SBEⅡb:PDS酶切验证Fig.5 The double digestion of γ-SBEⅡb:PDS plasmids using Pac I/Not I
3 讨论
本研究选择提取花后12 d的小麦穗部RNA,是因为研究[16]表明小麦在花后15d左右淀粉的积累速度最快,也因此,在花后15 d后小麦籽粒的成分变得更复杂,提取的RNA更容易含有杂质。
重叠延伸PCR技术(SOE-PCR)采用具有互补末端的引物,使PCR产物形成了重叠链,从而在随后的扩增反应中通过重叠链的延伸,将不同来源的扩增片段重叠拼接起来[17]。该技术已形成3个各具特色的方法分支:重叠延伸拼接、跳跃PCR和DNA重排制备基因杂合体。实施重叠延伸PCR的3个步骤为:1)制备用于重组的DNA组件;2)组件分子作为巨引物互为模板延伸(无引物的热反应);3)克隆和定向筛选重组产物[18]。重叠互补引物的设计是该技术成功的关键,本研究在2个基因的连接处设计了可同时结合2个基因引物,因此得到的初级PCR扩增产物可实现互为引物的互相扩增。此外,整个过程不需要内切酶消化和连接酶处理。由于Taq DNA聚合酶具有在延伸的3′端加“A”的特性,会在1/2的重组基因片段中引入定点的A突变,因此在筛选过程中我们筛选到的是未引入“A”突变的重组片段构建的载体。为彻底防止引入定点“A”突变情况的发生,建议在制备用于重组的DNA组件时使用具有3′-5′外切酶活性的高保真酶,避免3′端加“A”,从而获得平末端产物。在第2次拼接PCR反应中使用Taq DNA聚合酶,加“A”以便进行TA克隆。
本研究所构建的载体经酶切及测序等步骤的验证,说明成功构建了含181 bp SBEⅡb基因片段和190 bp PDS基因片段的双基因VIGS重组载体。其与Gene bank中登录的其他品种的SBEⅡb基因和PDS基因片段的同源性均达到97%,这说明所选择的片段有高度的保守性,且总长度370 bp的长度远大于VIGS技术能有效沉默基因的理论最低长度23 bp。
4 结论
本研究经过对构建的BSMV:γ-SBEⅡb:PDS重组载体酶切鉴定,成功构建了与小麦淀粉合成直接相关的淀粉分支酶基因SBEⅡb的VIGS重组载体,下一步将在小麦上通过VIGS技术实现SBEⅡb、PDS基因沉默,研究基因对小麦淀粉合成的影响。
[1]Burch Smith T M,Anderson J C,Martin G B,et al.Applications and advantages of virus-induced gene silencing for gene function studies in plants[J].The Plant Journal,2004,39(5):734-746.
[2]Sahu P P,Puranik S,Khan M,et al.Recent advances in tomato functional genomics:utilization of VIGS[J].Protoplasma,2012,249(4):1017-1027.
[3]Ball S G,Morell M K.From bacterial glycogen to starch:understanding the biogenesis of the plant starch granule[J].Annu Rev Plant Biol,2003,54:207-233.
[4]Holzberg S,Brosio P,Pogue G P,et al.Barley stripe mosaic virus-induced gene silencing in a monocot plant[J].The Plant Journal,2002,30(3):315-327.
[5]Bennypaul H S,Mutti J S,Rustgi S,et al.Virus-induced gene silencing (VIGS)of genes expressed in root,leaf,and meiotic tissues of wheat[J].Functional&Integrative Genomics,2012,12(1):143-156.
[6]Kumagai M H,Donson J,Della Cippa G,et al.Cyto Plasmic inhibition of carotenoid biosynthesis with virusderived RNA[J].Proc Natl Acad Sci USA,1995,92(5):1679-1683.
[7]Scofield S R,Huang L,Brandt A S,et al.Development of a virus-induced gene-silencing system for hexaploid wheat and its use in functional analysis of the Lr21-mediated leaf rust resistance pathway[J].Plant Physiology,2005,138(4):2165-2173.
[8]贺洋,岳洁瑜,王华忠.利用表达分析和基因沉默方法研究硫代硫酸硫转移酶基因TaTST与小麦抗白粉病反应的关系[J].作物学报,2012,38(2):231-239.
[9]Van Eck L,Schultz T,Leach J E,et al.Virus-induced gene silencing of WRKY53 and an inducible phenylalanine ammonia-lyase in wheat reduces aphid resistance[J].Plant Biotechnology Journal,2010,8:1023-1032.
[10]Ma M,Yan Y,Huang L,et al.Virus-induced gene silencing in wheat spikes and grains andits application in functional analysis of HMW-GS-encoding genes[J].BMC Plant Biology,2012,12(1):141.
[11]Satoh H,Nishi A,Yamashita K,et al.Starch-branching enzyme I-deficient mutation specifically affects the structure and properties of starch in rice endosperm[J].Plant Physiology,2003,133(3):1111-1121.
[12]庞欢,李露,苑会功,等.小麦抗性淀粉与其它淀粉性状间的相关及通径分析 [J].石河子大学学报:自然科学版,2010,28(2):147-151.
[13]Seo B S,Kim S,Scott M P,et al.Functional interactions between heterologously expressed starch-branching enzymes of maize and the glycogen synthases of brewer′s yeast[J].Plant Physiol,2002,128(4):1189-1199.
[14]Francesco S,Michela J,Angela D,et al.Increasing the amylose content of durum wheat through silencing of the SBEIIa genes[J].BMC Plant Biology,2010,10 (1):144.
[15]李淼淼,南富波,刘伟,等.改良Trizol法从灌浆期小麦胚乳中提取高质量总RNA的研究[J].新疆农业科学,2013,50(8):1381-1385.
[16]石培春,李英枫,韩璐,等.不同品质类型小麦籽粒淀粉含量积累的动态差异 [J].石河子大学学报:自然科学版,2012,30(4):417-421.
[17]Warrensa A N,Jonesb M D,Lechlera R I,et al.Splicing by overlap extension by PCR using asymmetric amplify cation:an improved technique for the generation of hybrid proteins of immunological interest[J].Gene,1997,186(1):29-35.
[18]王皓,康现江,王琦.重组PCR技术研究进展和应用[J].中国生物工程杂志,2007,27(5):153-156.
