不同培养条件对拮抗酵母菌0732-1产生抑细菌物质的影响
2014-01-02王晓东陈好娟王春娟葛米红
王晓东,陈好娟,王春娟,葛米红
(1石河子大学绿洲农作物病害防控重点实验室,石河子大学农学院,石河子 832003;2武汉市农科所,武汉 430065)
随着近几年来对生防酵母菌研究的不断深入,发现生防酵母菌除了具有营养竞争的能力外,某些酵母菌还能够产生一些抑真菌物质(Antifungal substances,AFS)[1-4],这些AFS包括一些挥发性和不挥发性成份[5-8]。在生防作用过程中,AFS起到了很重要的角色,它不仅进一步扩大和增强了拮抗酵母菌在环境中的与敏感菌株的竞争能力[9],而且增强了其生防效果。因此,目前对具有多种拮抗作用类型的微生物倍受人们的关注,已成为生防菌研究的热点。
我们在拮抗酵母菌平板筛选和带菌种子处理的试验中,发现酵母菌0732-1发酵液中含有某类对Aac具有抗生作用的物质,并将这种物质称之为抗细菌物质(Antibacterial substances,ABS)。 虽然关于Pichia anomala产生AFS的报道很多[9-11],但是对P.anomala产生ABS的研究未见有报道。众所周知,微生物生存的环境不同其代谢方式也会存在很大差异,产生的拮抗物质在质和量上或多或少也可能发生变化[10-11]。营养物质的选择和培养条件的适宜,均对拮抗微生物产生抑菌物质的合成、产量和质量造成很大影响。提供良好的培养基配比和培养条件可以充分发挥生产菌种的生物合成能力,使之达到最大的生产效果。针对此,本研究初步探讨和分析了酵母菌0732-1在培养条件下对产生抑菌物质的影响,旨在为更好地发挥好其生防效果,以及提取、纯化ABS和研究其特性奠定可靠基础。
1 材料与方法
1.1 材料
1.1.1 供试培养基
PSB、KB、PDB、LB 培养液和 KBA 培养基参照植病研究法[12]制备。碳源、氮源同化基础培养液制备方法参照文献[1 3]进行。YEPB培养液参照文献[14]中的方法制备。NYPB培养液:牛肉膏1.0 g,大豆蛋白胨 5.0 g,葡萄糖 10.0 g,酵母粉 7.0 g,NaCl 5.0 g,蒸馏水1.0 L,pH 6.7。YPDB培养液:1%酵母汁,5%甘油,葡萄糖20.0 g,蛋白胨10.0 g。用蒸馏水1.0 mL配制。以上培养(基)液121℃灭菌25 min后备用。
1.1.2 供试菌株及培养
酵母菌0732-1为自主筛选所得。Aac由石河子大学农学院植病教研室提供。活化后的酵母菌0732-1和Aac分别接种在PDB和KB培养液中,28℃,160 r/min振荡培养36 h后,备用。
1.2 方法
1.2.1 抗细菌生物活性测定
采用琼脂孔扩散法。将培养好的Aac培养物用无菌水配制成 1×108cfu/mL 菌悬液(OD600≈0.3),吸取1 mL菌悬液注入KBA培养基平板中央,晃动平板使菌液布满全皿,倾斜平板,吸出多余菌液,在无菌条件下,吹干培养基表面的水分。然后用直径为7 mm无菌打孔器打孔,吸取100 μL酵母菌0732-1发酵物上清液(已灭菌)注入琼脂孔中,置28℃下培养48 h后,观察并测定抑菌圈的直径,试验重复3次。
1.2.2 培养基对ABS产生的影响
1.2.2.1 碳源对ABS产生的影响
称取蔗糖、麦芽糖、葡萄糖、柠檬酸钠、可溶性淀粉、甘油、果糖各4.0 g,量取5.0 mL无水乙醇,分别加入到200 mL碳源基础培养液中,混匀后,每种碳源基础培养液分装至4个150 mL三角瓶中,每瓶50 mL。121℃灭菌25 min后,3瓶培养液接种0.5 mL 1×108cfu/mL酵母菌悬浮液,以不接种的1瓶为对照。将各碳源培养液的三角瓶置于28℃ 160 r/min下振荡培养48 h后,取30 mL的培养物转入50 mL离心管中,4℃,8000 r/min离心15 min,收集上清液,灭菌后测定其抗Aac活性。
1.2.2.2 氮源对ABS产生的影响
测定的氮源包括硫酸铵、磷酸氢二钾、尿素、蛋白胨、硝酸钾和硝酸铵。分别称取4 g添加至200 mL氮源基础培养液中。灭菌后分装至4个三角瓶中(150 mL)。以氮源基础培养液为对照(CK)。接种酵母菌0732-1培养、培养液处理、培养液抗细菌活性测定等操作方法参见上述碳源试验(1.2.2.1)。
1.2.3 培养液类型ABS产生的影响
将制备好的 PDB、PSB、YEPD、KB、NYPB、LB 和YPDB培养液分别分装于4个三角瓶中,每瓶装50 mL。 灭菌后(121 ℃,25 min),调节 pH 6.0,吸取0.5 mL 1×108cfu/mL酵母菌悬液接种于每种培养液的3个三角瓶中,以不接种的1瓶培养液为对照。将各三角瓶28℃,160 r/min振荡培养48 h后,取30 mL培养物转入50 mL离心管中。4℃,8000 r/min离心15 min,收集上清液,灭菌后测定抗Aac活性。
根据6上105-2工作面支架工作阻力实测,r=12 834 kN,p0=5 563 kN,Δhi=600 mm,ΔhA=1 394 mm,计算得K=3 130 kN。
1.2.4 培养条件对ABS产生的影响
1.2.4.1 培养基初始pH值的影响
在无菌环境中,用 0.1 mol/L HCl和0.5 mol/L NaOH 将 PSB 培养液分别调节至 3.0、4.0、4.5、5.0、5.5、6.0、7.0、8.0、9.0、10.0 和 11.0 共 11 个 pH 值梯度。将每个pH梯度PSB培养液分装至4个灭菌的150 mL三角瓶中,每瓶50 mL。其中3瓶接种0.5 mL 1×108cfu/mL酵母菌0732-1菌悬液,1瓶不接种留作对照。各三角瓶在26℃、160 r/min条件下摇培48 h后,测定各三角瓶中培养物的pH值。然后取出30 mL酵母菌培养物及对照置于50 mL离心管中,4℃,8000 r/min离心15 min,收集上清液,灭菌后测定其抗Aac的活性。试验重复3次。
1.2.4.2 培养液装样量的影响
将PSB培养液按20、25、30、40、60、80、100、125、165和210 mL分别装入250 mL的三角瓶中,121℃下灭菌25 min后,以三角瓶中培养液体积的1%接种量接种1×108cfu/mL酵母菌0732-1菌悬液,密封三角瓶瓶口后,在28℃、160 r/min条件下摇培60 h。取出培养物测定其pH值后,倒出30 mL各酵母菌培养物及对照于50 mL离心管中,4℃,8000 r/min离心15 min,分别收集3次重复的培养物上清液,灭菌,按同上(1.2.1)中方法测定上清液抗Aac的生物活性。以PSB培养液为对照。
1.2.4.3 发酵温度的影响
取 0.5 mL 1×l08cfu/mL 酵母菌 0732-1 菌悬液,接种至50 mL PSB培养液中,分别置于20、25、28、30、37和 40℃恒温摇床上摇培 60 h (160 r/min)。 按上述方法(1.2.1)测定各发酵液的 pH 值、上清液抑制Aac的活性。试验重复3次。
1.2.4.4 培养时间对ABS的影响
1.2.4.5 接种量的影响
将新鲜的1×l08cfu/mL酵母菌0732-1菌悬液,按照接种量 0.2%、0.5%、1.0%、1.5%、2.0%、3.0%、5.0%和10.0%(V/V)分别接种到含有60 mL PSB培养液的150 mL三角瓶中,在28℃、160 r/min下摇培60 h后,测定各三角瓶中酵母菌培养物的pH值。取30 mL各培养物至50 mL离心管中,4℃,8000 r/min离心 15 min,收集上清液。按 1.2.1 中的方法测定上清液对Aac的抗菌活性。
1.3 数据分析与统计
采用SAS 8.0中的方差分析程序 (ANOVA)分析上述各试验中不同处理间的差异显著性。采用Duncan氏新复极差法比较处理之间的差异显著性(P<0.05)。
2 结果与分析
2.1 碳源对酵母菌0732-1产生ABS的影响
图1可见:酵母菌0732-1能利用果糖、葡萄糖、麦芽糖和乙醇产生ABS,且发酵物离心后上清液的抑菌圈直径为 0.5~9.8 mm。利用果糖产生 ABS抑菌活性最强,抑菌圈直径为9.8 mm。其次为葡萄糖。以甘油为碳源时,酵母菌发酵液上清中抑菌活性最弱,抑菌圈直径为0.1 mm。以淀粉、蔗糖和柠檬酸钠为碳源时,发酵液未能产生抑菌圈。因此,发酵液pH与抑菌圈大小无相关性。

图1 碳源对酵母菌0732-1产生ABS的影响Fig.1 The influence of carbon sources on ABS substances produced by the yeast strain 0732-1
2.2 氮源对酵母菌0732-1产生ABS的影响
由图2可见:葡萄糖为碳源的基础氮源培养液中,酵母菌0732-1利用硫酸铵、硝酸钾、磷酸二氢铵和蛋白胨能产抑菌圈,以硫酸铵为最适,发酵液的抑菌圈直径14.6 mm,硝酸钾抑菌圈直径为1.2 mm。尿素和硝酸铵不利于酵母菌0732-1产生ABS。

图2 氮源对酵母菌0732-1产生ABS的影响Fig.2 The influence of nitrogen sources on ABS produced by the yeast strain 0732-1
2.3 培养液对酵母菌0732-1产生ABS的影响
由图3可见:7种培养液培养酵母菌0732-1后,6种发酵液上清均能产生明显的抑菌圈,其中PSB和EYPB抑菌效果显著,抑菌圈直径均为11.0 mm;KB、YPDB和PDB发酵液上清抑菌活性间差异不显著, 形成抑菌圈直径分别为 5.0、4.7 和 5.7 mm,NYPB发酵液未产生抑菌圈。说明PSB或EYPB利于0732-1产生ABS。

图3 不同培养液对酵母菌0732-1产生ABS的影响Fig.3 The influence of different liquid media on ABS produced by the yeast strain 0732-1
2.4 初始pH的影响
由图4可见:原培养液pH值>5.0时,酵母菌0732-1发酵液上清抑细菌活性增强,抑菌圈直径为9.1~10.3 mm, 培养后 pH 为 3.6~4.1。 当原培养液pH值为9.0时,酵母菌0732-1培养后,发酵液上清抑菌活性最强,发酵液pH为3.9,抑菌圈直径达11.7 mm。

图4 初始pH值对酵母菌0732-1产生ABS的影响Fig.4 The influence of the initial pH on ABS produced by the yeast strain 0732-1
2.5 培养液装样量的影响
由图5可见:当装样量为20~40 mL时,发酵液pH 较高,为 7.2~7.4,发酵液上清液对 Aac 不具有抑菌活性。当装样量为60~200 mL时,酵母菌0732-1培养后pH出现先降后升的趋势;发酵液上清pH的变化由4.5降至3.7。当装样量为80 mL时,培养后发酵液上清pH为3.7,抑菌活性最强,抑菌圈直径为 12.1 mm。

图5 培养液装液量对酵母菌0732-1产生ABS的影响Fig.5 The influence of medium volume on ABS produced by the yeast strain 0732-1
2.6 温度的影响
由图6可见:在温度为20~40℃时,酵母菌0732-1均可生长且对抑细菌活性有不同程度的影响。当温度为20℃时,发酵液上清pH最低,为3.42,抑菌活性最强,抑菌圈直径为11.1 mm。在25~35℃时,酵母菌0732-1发酵液上清pH随着温度的升高而呈上升趋势,但抑菌活性不断下降。由此说明,酵母菌0732-1产生的ABS可能是一种酸性物质。

图6 培养温度对酵母菌0732-1产生ABS的影响Fig.6 The influence of incubation temperature on ABS produced by the yeast strain 0732-1
2.7 培养时间的影响
由图7可见:发酵液pH值随着培养时间的延长出现先降低,后升高的趋势,但发酵液上清的抑菌圈直径却出现先升高,后降低的趋势。培养96 h时,发酵液上清pH值最低,为3.24,但其抑菌圈最大,直径为26.4 mm。由此可以说明:发酵液中抑菌物的抑菌活性与其pH值高低成正相关,酸性时具有抑菌活性,当发酵液的pH>4.5时,基本无抑菌圈产生。

图7 培养时间对酵母菌0732-1产生ABS的影响Fig.7 The influence of incubation time on ABS prduced by the yeast strain 0732-1
2.8 接种量的影响
由图8可见:酵母菌0732-1抑菌活性随接种量的增大而增强,发酵液pH的变化基本随接种的增大而呈降低趋势。接种量为0.2%时,发酵液pH为 4.3,抑菌圈最小,直径为 5.9 mm,在接种量为10%时,发酵液pH为3.5,其抑菌圈直径最大,达14.0 mm。
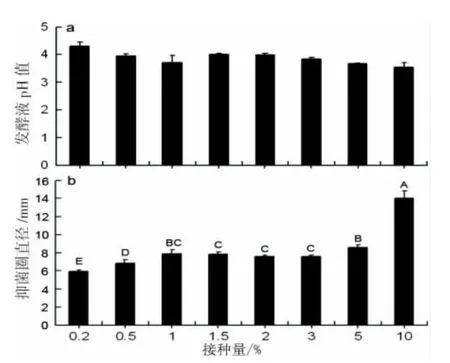
图8 接种量(V/V)对酵母菌0732-1产生ABS的影响Fig.8 The influence of the inoculation concentration on ABS produced by the yeast strain 0732-1
3 结论与讨论
通过不同培养条件下对酵母菌0732-1产ABS的影响,结果表明各单因子的梯度范围内,产生ABS最适碳源为果糖;以葡萄糖为碳源,最适氮源为硫酸铵。以PSB为基础培养液,初始pH为9.0;装样量为80 mL(250 mL三角瓶);以10%的接种量;培养温度为20℃;培养96 h利于酵母菌0732-1产生ABS,且抑菌活性最强。同时发现上述各单因子培养条件下发酵液的pH值越低其抑菌活性越强。由此说明产生的ABS可能是一种酸性物质,且或ABS抑菌活性可能与其营造的酸性环境有直接的关系。这可能与酵母菌利用营养物质代谢的方式有关。对于具体的产ABS发酵体系及代谢途径还有待于进一步探讨。
在酵母菌发酵过程中,代谢环境条件的调控是所获目的代谢物必要的手段。酵母菌群体历经了繁殖、生长和衰老的生命过程,在此过程中发生着各种生物化学变化,是生物体与其生存环境不断地进行物质、能量、热量传递和交换的动态过程[15]。影响酵母菌生存环境的因素主要有温度、pH值、底物浓度、溶解氧等[16]。本试验中通过人为控制培养条件对酵母菌0732-1代谢物中酸性ABS的产出的研究结果分析,推测这种酸性的ABS可能与酵母菌糖代谢中的糖酵解途径中的酒精发酵有密切关系,同时认为培养条件中溶氧是产生ABS关键的调控因子。酵母在厌氧性环境中,糖的利用是通过糖酵解EMP途径完成的,形成乳酸或乙醇等发酵物;好氧性的利用则是由EMP途径产生的丙酮酸经三羧酸循环(Tricarboxylic acid cycle)通过呼吸链彻底分解氧化,形成CO2、H2O和ATP。上述2条途径是酵母菌糖代谢的主要方式[17]。厌氧性发酵途径是酵母菌糖酵解中的酒精发酵时形成的有机酸的主要途径,代谢的有机酸包括酮酸、羟基、二羧酸、三羧酸、脂肪酸等。我们通过本试验结果初步推断,当培养液接种的初期,酵母菌体浓度较低,氧与碳源较充足情况下,酵母菌都能够得到最大限度的生长,此时糖以丙酮酸高流量转化,在有氧条件下,进入三羧酸循环,丙酮酸被彻底氧化,培养液中有气泡产生,释放出CO2。当三角瓶中的氧缺少或供应不足,那么代谢将进入酒精发酵阶段,从而形成大量的有机酸副产物,发酵液pH再度下降,酸性ABS在发酵液中存量较多,抑菌活性较强。因此可得出,氧对酵母菌的代谢途径的影响至关重要[18]。酵母菌0732-1产生ABS发酵体系一个复杂多因子协调的体系,对发酵机理以及代谢调节控制还有待进一步深入研究。此方面的研究将为高效获得且符合要求所需的代谢物提供重要的理论意义和实践价值。
[1]Young T W,Yagiu M.A comparison of the killer character in different yeasts and its classification [J].Antonie van Leewenhoek,1978,44:59-77.
[2]Staib F.The green colour effect(GCE)of the killer strain Cryptococcus larentii CBS 139 on stab agar[J].Mycoses,1999,42:103-106.
[3]Schmitt M J,Breinig F.The viral killer system in yeast:from molecular biology to application[J].FEMS Microbiol Rev,2002,26:257-76.
[4]Pfeiffer I,Golubev W I,Farlas Z,et al Mycocin production in Cryptoccocus aquaticus [J].Antonie van Leeuwenhoek,2004,86:369-75.
[5]Weiler F,Schimtt M J.Zygocin,a secreted antifungal toxin of the yeast Zygosaccharomyces bailli and its effect on sensitive fungal cells[J].FEMS Yeast Res,2003,3:69-76.
[6]Filonow A B.Germination and adhesion of fungal conidia on polycarbonate membranes and on apple fruit exposed to mycoactive acetate esters[J].Can J Animal Sci,2003,49:130-138.
[7]Bruce A,Stewart D,Verrall S,et al.Effects of volatiles from bacteria and yeast on the growth and pigmentation of sapstain fungi[J].Int Biodeterior Biodegrad,2003,51:101-108.
[8]Mercier J,Jiménez J I.Control of fungal decay of apples and peaches by the biofumigant fungus Muscodor albus[J].Postharvest Biol Technol,2004,31:1-8.
[9]Īzgü F,Altinbay D,Acun T.Killer toxin of Pichia anomala NCYC 432;purification,characterization and its exo-1,3-glucanase activity[J].Enzyme Microbial Technol,2006,39:669-676.
[10]Druvefors U Ä,Jonsson N,Boysen M E,et al Efficacy of the biocontrol yeast Pichia anomala during long-term storage of moist feed grain under different oxygen and carbon dioxide regimens[J].FEMS Yeast Res,2002,2:389-394.
[11]Druvefors U A,Passoth V,Schnürer J.Nutrient effects on biocontrol of Penicillium roqueforti by Pichia anomala J121 during airtight storage of wheat[J].Appl Environ Microbiol,2005,71(4):1865-1869.
[12]方中达.植病研究方法[M].北京:北京农业出版社,1998.
[13]Barnett J A,Payne R W,Yarrow D.Yeasts:characteristics and identification[M].Third edition.Cambridge:Cambridge University Press,2000.
[14]王晓东,李国庆,张莉,等.拮抗酵母菌0732-1的鉴定及其 ITS-5.8S rDNA 序列分析[J].北方园艺,2011(1):146-149.
[15]柯尔森 J M.化学工程(第 2卷)[M].北京:化学工业出版社,1988.
[16]俞俊棠.生物反应过程的特性及对过程控制的要求生化过程模型化与控制论文集[M].上海:华东化工学院出版社,1989.
[17]黄秀梨.微生物学[M].北京:高等教育出版社,2003.
[18]陈思妘,箫熙佩.酵母生物化学[M].济南:山东科学技术出版社,1990.
