不同浓度5-氨基乙酰丙酸(ALA)浸种对NaCl胁迫下番茄种子发芽率及芽苗生长的影响
2013-12-25赵艳艳胡晓辉邹志荣
赵艳艳,胡晓辉,邹志荣,燕 飞
(西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室,杨凌 712100)
5-氨基乙酰丙酸(5-aminolevulinic acid,ALA),又名δ-氨基酮戊酸,是一种广泛存在于植物、动物、真菌、细菌等生物机体活细胞中的非蛋白氨基酸,是叶绿素等四吡咯环色素形成的第一个直接前体[1],作为植物叶绿素合成研究的一部分,很早就受到重视。近年来众多研究表明ALA不仅仅是叶绿素生物合成途径的中间产物,而且能够促进作物的光合作用[1-6]、增加产量[7]、提高甜瓜、西瓜、黄瓜及辣椒的抗冷性[2,4,8-9]、增强西瓜幼苗耐弱光能力[4,10]等,具有类似于植物激素的调控效应[11],但在ALA对盐胁迫下种子萌发的影响方面研究甚少。有人利用ALA浸种,发现其能够促进盐胁迫下西瓜种子的萌发,不同浓度ALA处理能有效地提高紫苏种子和幼苗的抗盐能力,并认为ALA促进NaCl胁迫下种子萌发的主要原因是其浸种诱导芽苗中抗氧化酶活性增加[12-13],然而对于最适浸种浓度不同物种间存在较大差异。
为了确定ALA浸种对NaCl胁迫下种子萌发的促进效应及其最佳适用浓度,本试验以番茄 (Solanumlycopersicum)为试材,研究了不同浓度ALA浸种对NaCl胁迫下番茄种子发芽参数和芽苗抗氧化酶活性的影响,旨在探讨ALA提高作物抗逆性的作用机理及其浓度效应,为科学合理的应用ALA提高其综合效益提供理论依据。
1 材料与方法
1.1 试验设计
试验于2010年4—6月在RXZ-3800智能型人工气候箱内进行,根据前人研究的经验将NaCl浓度设为0、25、50、100 mmol/L 。每个处理挑选50粒饱满的“中杂九号”番茄种子均匀摆放在铺有2层滤纸的玻璃培养皿(内径9.0cm)内,分别加入20ml不同浓度ALA溶液(0、0.1、0.5、1.0、5.0、10.0mg/L ),对照处理加入等量蒸馏水,每个处理重复3次,于人工气候箱内28℃黑暗浸种24h。浸种结束后,以蒸馏水清洗种子及培养皿,并重新摆放于铺有2层滤纸的玻璃培养皿,分别加入10mL不同浓度NaCl溶液,对照处理加入等量蒸馏水,于人工气候箱内28℃黑暗培养,以后定时定量补充相应浓度NaCl溶液或蒸馏水保持滤纸湿润。以胚根长2mm作为萌芽标志,处理第4天到第7天统计种子发芽数。第7天结束发芽试验。
1.2 测定项目及方法
1.2.1 种子发芽参数测定
发芽期统计有关发芽指标[14],并在每个重复中选25株芽苗测定胚芽鲜重(SFW)、胚根鲜重(RFW)[15],计算芽苗总鲜重(FW),胚根鲜重/胚芽鲜重(RFW/SFW)。
发芽率(GR)(% )=第7天发芽种子数/供试种子数×100%
发芽势(GE)(% )=4d内发芽种子数/供试种子数×100%
发芽指数(GI)=∑Gt/Dt(Gt指时间t的发芽数,Dt指相应的发芽天数)
活力指数(VI) =S×∑Gt/Dt(S指芽苗的鲜重)
1.2.2 抗氧化酶活性和丙二醛含量测定
第7天发芽结束后,每个处理选25株芽苗分为地上部和根分别进行测定。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性按照李璟等[16]的方法测定,酶活性以U/mg鲜重表示。丙二醛(MDA)含量测定参照Velikova等[17]的硫代巴比妥酸(TBA)检测法,以μmol/g鲜重表示。
1.3 数据处理与分析
采用Microsoft Office Excel 2010和SAS 8.1进行制图和方差分析。
2 结果与分析
2.1 不同浓度ALA浸种对NaCl胁迫下番茄种子发芽指标的影响
2.1.1 对发芽率(GR)和发芽势(GE)的影响
从图1可以看出,在非盐胁迫下(蒸馏水催芽),0.1—10 mg/L ALA浸种处理均可促进番茄种子萌发,使发芽率(GR)提高了4.03%—8.87%,其中0.1mg/L ALA作用效果最好,但未达到差异显著性(P<0.05)。0.1 mg/L 和10 mg/L ALA处理显著提高种子发芽势(GE),与空白对照相比分别提高了23.33%和35.00%。
随着NaCl浓度的增加,番茄种子GR和GE逐渐减低。催芽第7天时,蒸馏水处理的番茄种子GR为82.67%,25、50和100 mmol/L NaCl处理的种子GR分别为84.67%、59.33%和28.67%;GE的统计数据显示,25、50、100mmol/L NaCl处理的种子GE比蒸馏水处理的种子分别降低了11.67%、63.33%和93.33%,可见低浓度NaCl(25mmol/L )处理的并不会影响种子萌发,但会降低发芽势;而50—100mmol/L NaCl处理则显著降低发芽率和发芽势,抑制种子萌发。
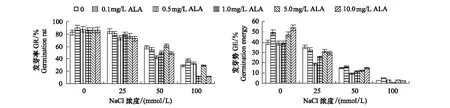
图1 ALA对NaCl胁迫下番茄种子发芽率(GR)和发芽势(GE)的影响
图1显示,ALA浸种处理降低了低浓度NaCl处理的GR和GE。随着ALA浸种浓度的增加,高浓度NaCl(50—100mmol/L )处理的GR和GE出现上升下降又上升的波动趋势,处理间差异显著。在100mmol/L NaCl胁迫下,0.1 mg/L ALA浸种处理使GR和GE分别提高了32.56%和100.00%,而1.0mg/L ALA使GR和GE分别降低了58.14%和75.00%,5.0mg/L ALA处理的GR和GE又显著上升。在50mmol/L NaCl胁迫下,0.1和5.0 mg/L ALA处理分别使GE和GR提高了9.09%和3.37%,而0.5mg/L ALA使GR和GE分别降低了28.09%和36.36%。
2.1.2 对芽苗鲜重的影响
胚芽鲜重(SFW)和胚根鲜重(RFW)是衡量NaCl胁迫对芽苗生长影响的指标,其比值RFW/SFW反映的是盐胁迫对地上部和地下部营养分配的影响。表1的数据显示,非盐胁迫下,ALA浸种可以提高番茄芽苗的SFW、RFW、FW和RFW/SFW比值,并且随着ALA浓度增加而持续升高,10.0mg/L ALA浸种的SFW、RFW、FW和RFW/SFW分别比蒸馏水浸种的提高了30.07%、48.88%、34.19%和14.47%,表明ALA浸种可以促进番茄芽苗生长,并且促进营养物质优先向根部运转,有利于根系生长(RFW)。
25—100 mmol/L NaCl胁迫下,番茄芽苗的SFW、RFW和FW与蒸馏水对照相比均有所增加,盐浓度越低增加量越多,对SFW/RFW比值没有显著影响。0.1—10.0mg/L ALA浸种处理对盐胁迫下RFW和SFW/RFW比值均没有显著影响,对SFW和FW的影响较显著;0.5—1.0mg/L ALA浸种不同程度的降低了盐胁迫下的SFW和FW;而5.0mg/L ALA浸种使25mmol/L NaCl处理的SFW和FW分别提高了8.47%和6.08%,10.0mg/L ALA浸种使50和100mmol/L NaCl处理的SFW、FW分别提高了22.17%、19.59%和2.17%、2.50%。
2.1.3 对发芽指数(GI)和活力指数(VI)的影响
图2显示,ALA浸种处理可以提高非盐胁迫下(蒸馏水催芽)番茄种子的发芽指数(GI)和活力指数(VI),其促进效应与ALA浓度增加正相关,与蒸馏水对照相比10mg/L ALA处理使GI和VI分别提高了12.73%和51.28%,可见ALA浸种可以显著促进番茄种子萌发和芽苗生长。与蒸馏水对照相比,25mmol/L NaCl处理的GI下降,而VI提高了35.82%, 50—100mmol/L NaCl胁迫下番茄种子GI和VI均显著下降。
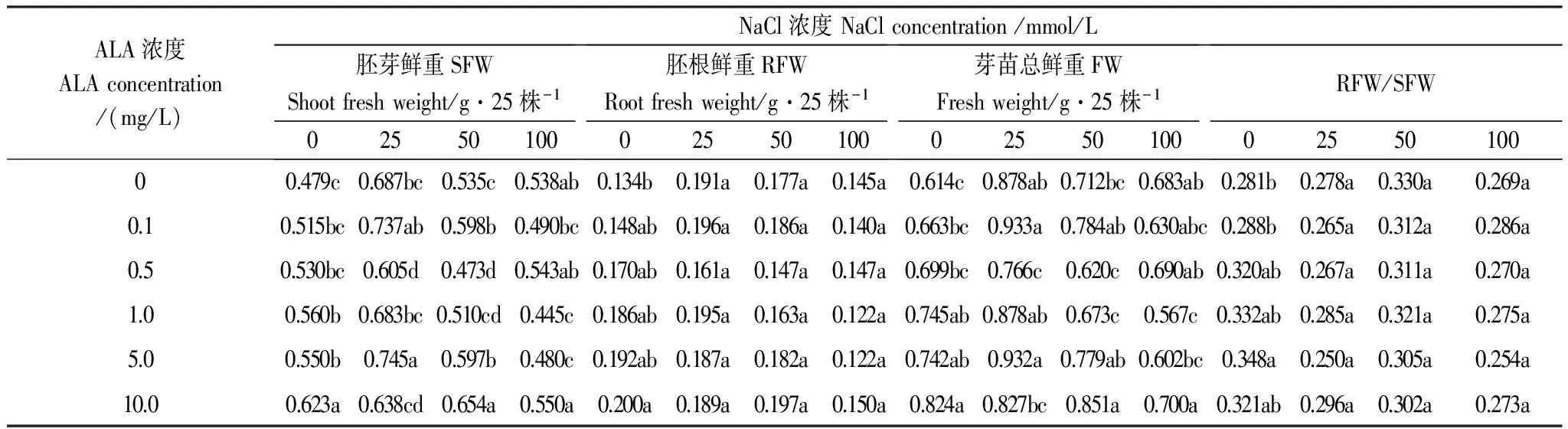
表1 ALA对NaCl胁迫下番茄芽苗鲜重的影响
同列不同字母表示处理间差异显著(P<0.05)
NaCl胁迫下,ALA浸种处理的GI和VI的变化趋势与GR和GE相似,随着ALA浓度的增加呈现出先上升再下降后又上升的波动趋势。0.1mg/L ALA浸种预处理使25、50、100mmol/L NaCl胁迫下种子的GI分别提高了0.01%、3.87%、60.28%,VI分别提高了5.77%、14.45%、47.86%;而0.5mg/L ALA浸种预处理显著地降低了25和50mmol/L NaCl胁迫下种子的GI和VI,1.0mg/L ALA浸种预处理则极显著地降低了100mmol/L NaCl胁迫下的GI和VI,与相应盐处理对照相比,GI分别降低了26.53%、30.94%和56.43%,VI分别降低了35.94%、39.84%和63.84%;然而随着ALA浓度继续升高(至5.0mg/L )GI和VI均有所上升,但仍低于单纯盐处理(图2)。
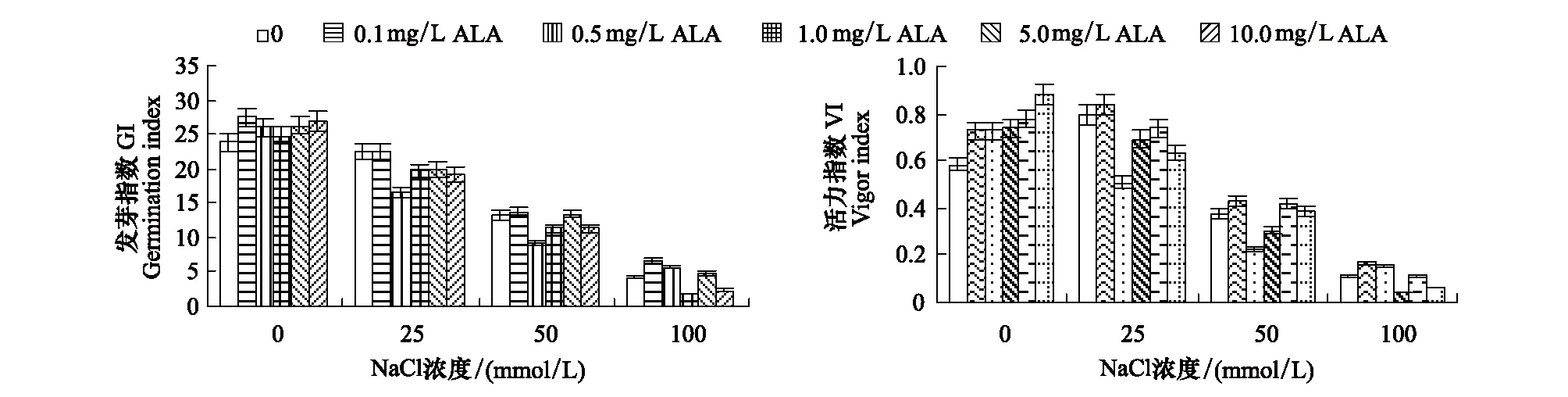
图2 ALA对NaCl胁迫下番茄种子发芽指数(GI)和活力指数(VI)的影响
2.2 不同浓度ALA浸种对NaCl胁迫下番茄芽苗抗氧化酶活性的影响
2.2.1 对超氧化物歧化酶(SOD)活性的影响
由图3可以看出,非盐胁迫下,0.5—1.0 mg/L ALA浸种使番茄芽苗胚芽中的SOD活性显著降低,0.1—10.0mg/L ALA极显著的降低了胚根中的SOD活性。25—100mmol/L NaCl胁迫使胚芽中SOD活性升高,胚根中SOD活性降低。
NaCl胁迫下,0.1—10.0mg/L ALA浸种处理不同程度的提高了胚芽中的SOD活性,同时显著降低了胚根中的SOD活性,且ALA浓度越高SOD活性越低。0.5mg/L ALA浸种处理使25和50mmol/L NaCl胁迫下胚芽中SOD活性分别提高了38.11%和28.02%,1.0mg/L ALA浸种使100mmol/L NaCl胁迫下胚芽中SOD活性提高了25.29%。10.0mg/L ALA浸种使25—100mmol/L NaCl胁迫下胚根中SOD活性分别降低了,25.41%、40.48%和98.29%。100mmol/L NaCl胁迫下,0.1—10.0mg/L ALA处理使胚根中SOD活性极显著的降低,可见过高浓度盐胁迫导致植物细胞产生不可修复的伤害,ALA浸种处理加剧了这一伤害,酶活性显著降低,且胚根受到的伤害更严重。
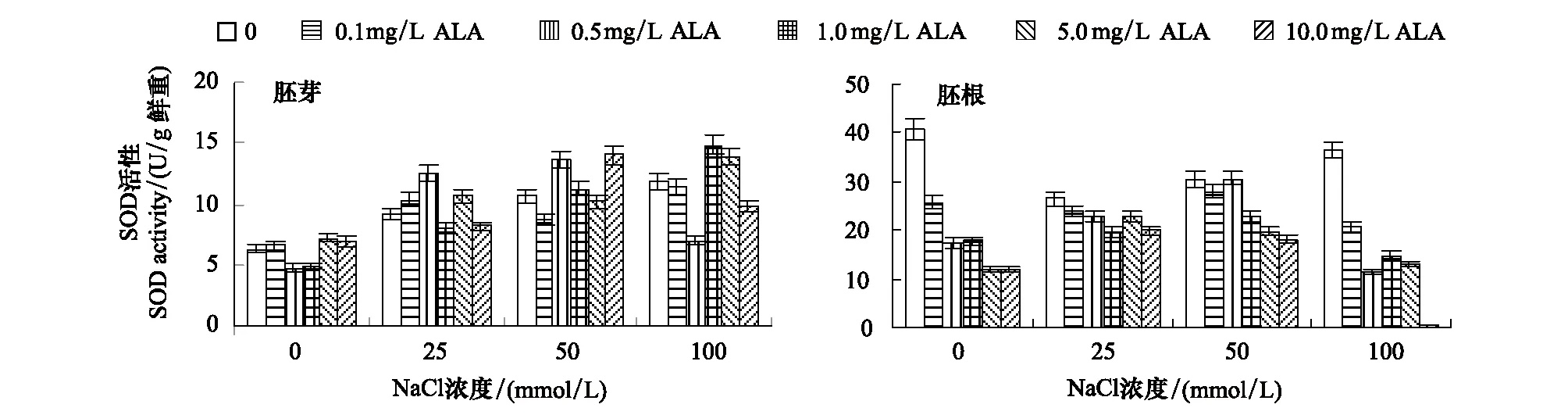
图3 ALA对NaCl胁迫下番茄种子胚芽和胚根中SOD活性的影响
2.2.2 对过氧化氢酶(CAT)活性的影响
ALA浸种对番茄芽苗中CAT活性的影响(图4)结果显示,非盐胁迫下,0.1—10.0mg/L ALA浸种对胚芽中CAT活性没有显著影响,使胚根中CAT活性降低,0.5和10.0mg/L ALA处理分别使其显著降低(P<0.05),分别降低了58.36%和37.15%,其余处理间的差异没有达到显著性。25—50mmol/L NaCl处理使胚芽和胚根中CAT活性降低,100mmol/L NaCl处理使胚芽CAT活性降低,胚根中CAT活性升高。
ALA浸种处理能够显著提高NaCl胁迫下胚芽和胚根中CAT活性,其中以0.5—1.0 mg/L ALA作用效果最好:与同浓度盐对照相比,0.5mg/L ALA处理使25和50 mmol/L NaCl胁迫下胚芽中CAT活性分别提高了51.52%和100.11%,胚根中CAT活性分别提高了101.66%和89.26%;1.0 mg/L ALA处理使100 mmol/L NaCl胁迫下胚芽和胚根中CAT活性分别提高了223.87%和89.76%。
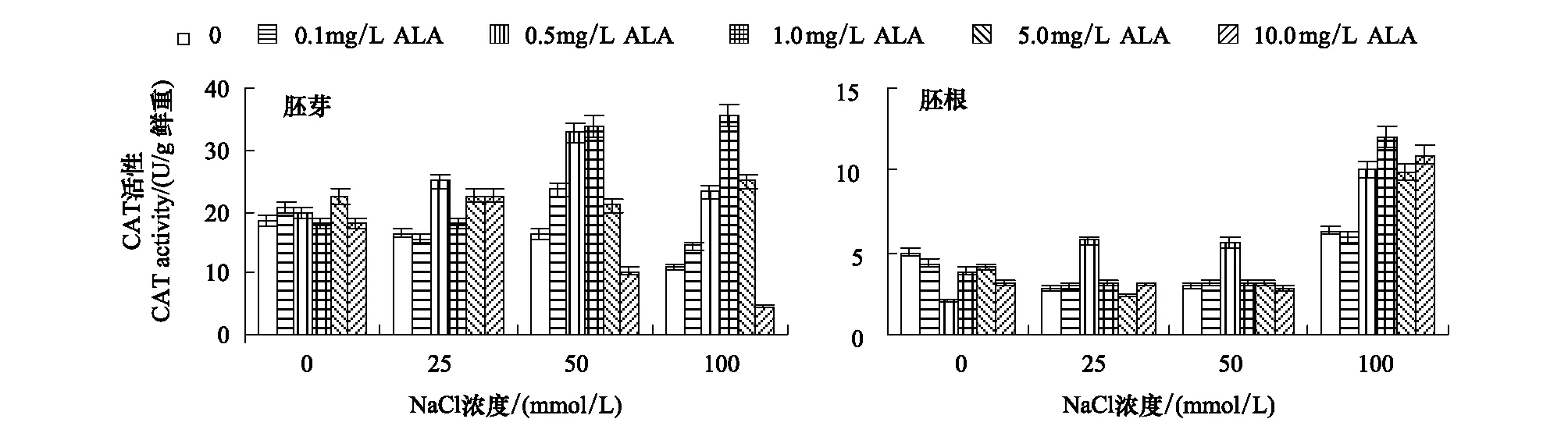
图4 ALA对NaCl胁迫下番茄种子胚芽和胚根中CAT活性的影响
2.2.3 对过氧化氢酶(POD)活性的影响
从图5可以看出,非盐胁迫下,1.0—10.0mg/L ALA浸种可以显著提高番茄种子胚芽中POD活性(P<0.05),同时极显著的降低胚根中POD活性(P<0.01)。25—100mmol/L NaCl胁迫下,胚芽中POD活性有所增加但未达到显著性,胚根中POD活性极显著的降低;ALA浸种能够提高其胚芽和胚根中的POD活性。0.5—1.0mg/L ALA浸种促使50和100mmol/L NaCl胁迫下胚芽中POD活性分别提高了66.26%—75.41%和64.19%—78.45%;0.5mg/L ALA浸种使25和50mmol/L NaCl胁迫下胚根中POD活性分别提高了44.05%和143.12%,而对100mmol/L NaCl胁迫的没有影响。
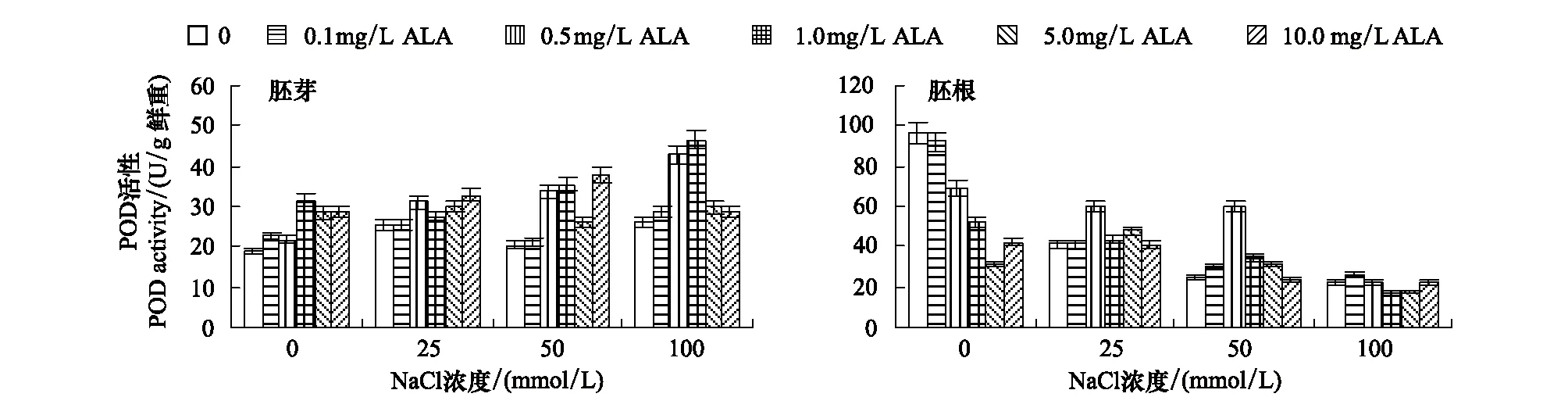
图5 ALA对NaCl胁迫下番茄种子胚芽和胚根中POD活性的影响
2.2.4 对丙二醛(MDA)含量的影响
由图6可知,非盐胁迫下,ALA浸种可以降低番茄种子胚芽和胚根中MDA含量,5.0 mg/L ALA浸种的MDA含量最低,胚芽和胚根分别比对照降低了81.14%和58.17%,浸种浓度超过5.0 mg/L 芽苗中MDA含量开始增加。NaCl胁迫的胚芽和胚根中MDA含量减少,仅25mmol/L NaCl胁迫下胚芽中MDA含量增加了16.48%,但未达到显著性(P<0.05)。0.1—10.0mg/L ALA浸种降低了盐胁迫下胚根中的MDA含量,25和50 mmol/L NaCl胁迫下,0.5mg/LALA浸种使其含量分别降低了36.14%、52.10%;100mmol/L NaCl胁迫下,0.1mg/LALA浸种使其含量降低了38.24%。对胚芽的影响显示,ALA浸种显著的降低了25mmol/L NaCl胁迫下其MDA含量,却使50和100 mmol/L NaCl胁迫下胚芽中MDA含量显著增加,峰值出现在5.0 mg/L ,分别比相应盐对照增加了128.95%和315.02%。
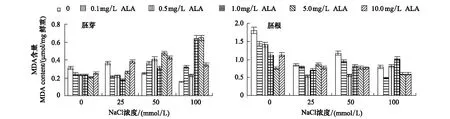
图6 ALA对NaCl胁迫下番茄种子胚芽和胚根中MDA含量的影响
3 讨论
发芽率(GR)反映了种子发芽的多少,发芽势(GE)反映了种子发芽的快慢和整齐度,发芽指数(GI)能够反映种子在整个发芽期的综合活力,活力指数(VI)既能反映种子发芽率、发芽速度,又能反映生长势及生长活力。这些指标能够从不同角度反映出番茄芽苗期耐盐性的强弱。试验中低浓度NaCl(25mmol/L )处理显著提高了番茄种子芽苗鲜重,与蒸馏水处理相比芽苗总鲜重提高30.13%,发芽率也有所提高,但未达显著性,可见适宜低浓度NaCl处理有利于种子萌发和芽苗生长;高浓度NaCl(50—100mmol/L )处理显著降低GR、GE、GI、VI,抑制种子萌发。图1和图2的结果显示,0.1mg/L ALA浸种能够提高50和100 mmol/L NaCl胁迫下的GR、GE、GI、VI,增强番茄种子耐盐性促进其萌发和生长。但是NaCl胁迫下,0.1—10.0 mg/L ALA浸种对番茄种子GR、GE、GI和VI的作用结果出现谷值。25和50mmol/L NaCl胁迫下,谷值出现在0.5mg/L ALA处理;100mmol/L NaCl胁迫下,谷值出现在1.0mg/L ALA处理。SFW、RFW、FW和RFW/SFW比值呈现与GR、GE、GI和VI同步的波动变化趋势,这是一个十分值得深入研究的现象,其特殊的浓度效应可能有利于揭示ALA调控植物生长发育的作用机理。
刘晖等认为[12],15—30 mg/L ALA能够促进盐胁迫下西瓜种子萌发。张春平等[4]发现50 mg/L ALA处理能有效地提高紫苏种子和幼苗的抗盐能力。研究表明,ALA浸种浓度不宜超过5.0 mg/L ;25—100 mmol/L NaCl作用下,10.0 mg/L ALA浸种的番茄种子GR、GE、GI、VI降低,丙二醛(MDA)含量增加,可见不同作物间ALA作用浓度存在较大差异,ALA浸种浓度过高不利于种子萌发和芽苗生长。
盐胁迫下,胚芽中SOD、POD活性增加,CAT活性降低;胚根中抗氧化酶活性显著降低,仅100mmol/L NaCl处理的胚根中CAT活性显著增加。0.5mg/L ALA浸种使25、50 mmol/L NaCl处理的胚芽中SOD、CAT、POD活性显著提高,使胚根中CAT、POD活性极显著提高、MDA含量显著降低。这与刘晖等[12]提出的盐胁迫降低西瓜幼苗新生组织SOD和POD活性,ALA处理能提高其活性的结论完全一致。
ALA是亚铁血红素(Heme)的合成前体,而Heme作为辅基普遍存在于POD和CAT中,因此有研究者推测,ALA可能通过转化为Heme进而提高抗氧化酶活性,并认为这是ALA促进NaCl胁迫下种子萌发的主要原因[12-13]。本试验中,非盐胁迫下,ALA处理增加胚芽中POD、CAT活性,降低胚根中POD、CAT活性;NaCl胁迫下,0.5mg/L ALA处理使胚芽和胚根中POD、CAT活性均显著增加;可见,ALA对 POD和CAT活性的影响在不同组织(胚芽和胚根)中存在很大差异,但二者的变化规律一致,可能与都含有Heme辅基有关。
在甜瓜[2]、紫苏[4]、草莓[5]、黄瓜[3,8]、辣椒[9]、油菜[20]等多种作物上观察到,ALA提高抗逆性总是伴随着抗氧化酶活性的增加,因此研究者认为ALA诱导SOD、POD、CAT等抗氧化酶活性上升是其增强植物抗逆性的主要原因。分析本试验中NaCl胁迫下ALA对番茄芽苗生长影响的结果表明,0.5mg/L ALA处理的种子抗氧化酶活性显著升高,GR、GE、GI、VI和芽苗鲜重显著降低;非盐胁迫下,随着ALA浓度的增加胚根中的抗氧化酶活性和MDA含量逐渐降低,GR、GE、GI、VI升高,芽苗鲜重增加。显然,ALA促进种子萌芽及生长与其提高芽苗中抗氧化酶活性呈现负相关,本试验的结果与西瓜[16]和小白菜[13]上的不同,或许ALA在幼苗期处理[2-5,8-9,20]与种子期处理的作用机制不同,导致现象不同,但两个时期的处理结果均表明ALA处理能够提高作物耐盐性。
在过量合成ALA的转基因拟南芥上的研究表明,一个Hem基因转入能够诱导20多种与脱落酸(ABA)合成、代谢和响应有关的基因表达上调。许多研究显示,ABA能够调节种子萌发和芽苗生长[21],也能提高植物对盐胁迫的抗性[22]。ALA处理对NaCl胁迫下番茄种子萌发和生长的影响,可能与其影响ABA合成及代谢有关,总之存在复杂的调控机制,其作用机理值得深入研究。
[1] Porra R J. Recent progress in porphyrin and chlorophyll biosynthesis. Photochemistry and Photobiology, 1997, 65: 492-516.
[2] Wang L J, Jiang W B, Huang B J. Promotion of Photosynthesis by 5-Aminolevulinic Acid (ALA) during and after Chilling Stress in Melon Seedlings Grown under Low Light Condition. Acta Horticulturae Sinica, 2004, 31(3):321-326.
[3] Liu C X, Luo Q X, Li Y J, Liu X J, Liang G Y, Yang H. Effect of Exogenous ALA on Cucumber Growth Indices and Antioxidant Enzymes Activity under Suboptimal Light.China Vegetables, 2011(16):72-78.
[4] Zhang CH P, He P, Wei P X, Du D D, Yu Z L. Effect of exogenous 5-aminolevulinic acid on seed germination and antioxidase activities ofPerillafrutescensseedlings under NaCl stress. Chinese Traditional and Herbal Drugs, 2011,42(6):1194-1200.
[5] Liu W Q, Kang L, Wang L J. Effects on Strawberry Photosynthesis and Relations to Anti-oxidant Enzymes of ALA. Acta Botanica Boreali-Occidentalia Sinica, 2006, 23(2):209-213.
[6] Wang L J, Shi W, Liu H, Liu W Q, Jiang W B, Hou X L. Effects of exogenous 5-aminolevulinic acid treatment on leaf photosynthesis of pak-choi. Journal of Nanjing Agricultural University, 2004, 27(2):34-38.
[7] Yao S M, Wang W J. Effects of 5-Aminolevulinic acid on grain filling and yield of the two-line Japonica hybrid rice. Huazhong Agricultural University, 2004, 23(5): 495-499.
[8] Yi L L, Yu X CH, Wang Y H, Xu ZH H, Li K, Han D J. Effect of 5-aminolevulinic Acid on Chilling-tolerance in Cucumber Seedlings. Acta Agriculturae Boreali-Occidentalis Sinica, 2007, 16 (4):166-169.
[9] Liu T, Guo SH R, Xu G, Gao W R, Li D C, Wang H. Mitigative Effect of 5-aminolevulinic Acid in Pepper under Low Temperature Stress. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(10): 2047-2053.
[10] Sun Y P, Wang L J. Effects of 5-Aminolevulinic Acid (ALA) on Chlorophyll Fluorescence Dynamics of Watermelon Seedlings under Shade Condition. Acta Horticulturae Sinica, 2007, 34(4):901-908.
[11] Roy C. Bindu,M. Vivekanandan. Hormonal activities of 5-aminolevulinic acid in callus induction and micro propagation. Plant Growth Regulation, 1998, 26: 15-18.
[12] Liu H, Kang L, Wang L J. Promotion of 5-aminolevunlinic acid on seed germination of wa抗氧化termelon (Citrulluslanatus) under salt stress. Journal of Fruit Science, 2006, 23(6):854-859.
[13] Wang L J, Jiang W B, Liu H, Liu W Q, Kang L, Hou X L. Promotion of 5-aminolevulinic acid (ALA)on germination of pakchoi (Brassica chinensis) seeds under salt stress. Integrative Plant Biol, 2005, 47(9):1084-1091.
[14] Wang X J, Li R S, Li S J, Tong Ai L, Chen L P, Guo H Y. Studies on Salinity-Resistant Selection of Cucumber During Germination. Journal of Shandong Agricultural University (Natural Science), 2000, 31(1): 71-73.
[15] Dong ZH G, Cheng ZH H. Salt tolerance and assessment of salt tolerance indices of tomato varieties in sprout stage and seedling stage. Acta Ecologica Sinica, 2009, 29(3): 1348-1355.
[16] Li J, Hu X H, Guo S R,Wang S P,Wang M H. Effect of exogenous spermidine on polyamine contentand antioxidantenzyme activities in roots of cucumber seedings under root-zone hypoxia stress. Journal of Plant Ecology( FormerlyActa Phytoecologica Sinica), 2006, 30(1): 118-123.
[17] Velikova V,Yordanov I,Edreva A.Oxidative stress and some antioxidant systems in acid rain2-treated bean plants protective role of exogenous polyamines.Plant Sci,2000,151(2):59-66.
[18] Hu X H, Du L J, Zou Z R. Protective effects of pre-socked seeds with Spd on tomato seedlings under NaCl stress. Acta Ecologica Sinica, 2009, 29(9):5152-5157.
[19] Su T, Wei X H, Ding X ZH, Li Y. Protective effects of NO and sucrose on oxidative damage in tomato seedling leaves under NaCl stress. Acta Ecologica Sinica, 2008, 28(4):1558-1564.
[20] Zhang W F, Zhang F, Jin Z L, Huang CH P, Tang G X, Ye Q F, Zhou W J. ALA improvingBrassicaNapusseedling tolerance to herbicide stress. Journal of Nuclear Agricultural Sciences, 2008, 22(4):488-494.
[21] Zhu G H, Xu W Y, Wu D, Zhang Q Y. Effect of Abscisic Acid Biosynthesis Gene NCED6 in Glucose Induced Delay of Arabidopsis thaliana Seed Germination. Plant Physiology Communications, 2010, 46(2):139-142.
[22] Wu Y R, Xie Q. ABA and Plant Stress Response. Chinese Bulletin of Botany, 2006, 23(5):511-518.
参考文献:
[2] 汪良驹,姜卫兵,黄保健.5-氨基乙酰丙酸对弱光下甜瓜幼苗光合作用和抗冷性的促进效应.园艺学报,2004,31(3):321-326.
[3] 柳翠霞,罗庆熙,李跃建,刘小俊,梁根云,杨宏.外源5-氨基乙酰丙酸(ALA)对弱光下黄瓜生长指标及抗氧化酶活性的影响.中国蔬菜, 2011(16):72-78.
[4] 张春平,何平,韦品祥,杜丹丹,喻泽莉.外源5-氨基乙酰丙酸对盐胁迫下紫苏种子萌发及幼苗抗氧化酶活性的影响.中草药,2011,42(6):1194-1200.
[5] 刘卫琴,康琅,汪良驹.ALA对草莓光合作用的影响及其与抗氧化酶的关系.西北植物学报,2006,23(2):209-213.
[6] 汪良驹,石伟,刘晖,刘卫琴,姜卫兵,侯喜林.外源5-氨基乙酰丙酸处理对小白菜叶片的光合作用效应.南京农业大学学报,2004,27(2):34-38.
[7] 姚素梅,王维金. ALA对两系杂交粳稻子粒灌浆和产量的影响.华中农业大学学报,2004,23(5): 495-499.
[10] 孙永平,汪良驹.ALA处理对遮荫下西瓜幼苗叶绿素荧光参数的影响.园艺学报,2007,34(4):901-908.
[8] 尹璐璐,于贤昌,王英华,许贞杭,李坤,韩道杰.5-氨基乙酰丙酸对黄瓜幼苗抗冷性的影响.西北农业学报,2007,16(4):166-169.
[10] 刘涛,郭世荣,徐刚,高文瑞,李德翠,王虹.5-氨基乙酰丙酸对辣椒植株低温胁迫伤害的缓解效应.西北植物学报,2010,30(10): 2047-2053.
[12] 刘晖,康琅,汪良驹.ALA对盐胁迫下西瓜种子萌发的促进效应.果树学报,2006,23(6):854-859.
[14] 王学军,李仁所,李式军,仝爱玲,陈丽平,郭红芸.黄瓜抗盐选择研究.山东农业大学学报(自然科学版), 2000, 31(1): 71-73.
[15] 董志刚,程智慧.番茄品种资源芽苗期和幼苗期的耐盐性及耐盐指标评价.生态学报,2009,29(3):1348-1355.
[16] 李璟,胡晓辉,郭世荣,王素平,王鸣华.外源亚精胺对根际低氧胁迫下黄瓜幼苗根系多胺含量和抗氧化酶活性的影响.植物生态学报, 2006, 30(1):118-123.
[17] 胡晓辉,杜灵娟,邹志荣. Spd浸种对盐胁迫下番茄幼苗的保护效应.生态学报, 2009,29(9):5152-5157.
[19] 苏桐,魏小红,丁学智,李源.外源NO与蔗糖对盐胁迫下番茄幼苗氧化损伤的保护效应.生态学报, 2008,28(4):1558-1564.
[20] 张文芳,张帆,金宗来,黄冲平,唐桂香,叶庆富,周伟军.ALA提高丙酯草醚胁迫下油菜幼苗耐性研究.核农学报,2008,22(4): 488-494.
[21] 朱国辉,徐慰盈,吴丹,张乾毅.拟南芥ABA生物合成基因NCED6对葡萄糖诱导其种子萌发延迟的作用.植物生理学通讯, 2010, 46(2):139-142.
[22] 吴耀荣,谢旗.ABA与植物胁迫抗性.植物学通报,2006,23(5):511-518.
