高盐下条斑紫菜光合特性和S-腺苷甲硫氨酸合成酶基因表达的变化
2013-12-20周向红易乐飞徐军田李信书阎斌伦
周向红,易乐飞,徐军田,李信书,阎斌伦
(1.淮海工学院江苏省海洋生物技术重点实验室,连云港 222005;2.淮海工学院海洋学院,连云港 222005)
条斑紫菜(Porphyra yezoensis Ueda)是红藻门中的一种大型海藻,作为重要的经济藻类广泛栽培于中国长江口以北、日本和韩国的近海区域,其2008年的产量已达5.5万吨干重,产值达13亿美元[1]。条斑紫菜不仅具有较高的食用和保健价值,还具有较高的学术研究价值。条斑紫菜叶状体生长于潮间带,由于潮汐变化其每天都会周期性地经历干出与覆水过程,期间可能遭受到盐度、温度、水分、光照和紫外线变化引起的多种非生物胁迫[2],但是长期的演化使得条斑紫菜适应了这种潮间带生活。因此条斑紫菜特殊的生活习性和胁迫适应机理引起了学者们的广泛兴趣。
紫菜耐受盐度胁迫的机理是复杂的、多方面的,全面细致的机理仍然知之甚少[1],不过目前已有学者研究了紫菜在盐度胁迫下的一些生理和生化变化过程,为阐明紫菜盐度胁迫适应机理奠定了基础。45—65盐度的海水能诱导条斑紫菜积累渗透调节剂甘露醇,同时高盐也诱导了脂质过氧化产物丙二醛的急剧增加,随后丙二醛会被自由基清除系统清除[3]。在1/16×—1×海水范围内,紫红紫菜(P.purpurea)的渗透调节剂红藻糖苷(floridoside)含量随着盐度的降低而降低,在1×—3×海水范围内,红藻糖苷含量随着盐度的增加而增加[4]。在9%以上的NaCl胁迫下4种紫菜的光化效率先急剧下降后缓慢下降,高盐胁迫解除后光化效率先急剧上升后缓慢上升,最后恢复正常,其中2种高潮位紫菜(P.suborbiculata和P.pseudolineari s)的光化学效率比2种低潮位紫菜(P.seriata和P.yezoensi s)的恢复得快[5]。研究还发现了高盐在光合系统的至少3个过程中影响紫菜(P.perforate)的光合作用[6]。
生物对逆境的适应与其生活习性密不可分,面对常态化的逆境,不同的生物采用不同的生存策略。仙人掌科植物采用特化的组织器官来适应常年的干旱环境,其根系发达,叶子退化成针状,茎表覆以蜡质,从而减少水分蒸发和阳光照射。处于活动状态的酵母、线虫和缓步类动物会以一种称之为隐生(cryptobiosis)的休眠机制来应对逆境,当面对干旱、低温、高盐和高压时,它们的新陈代谢、生长、繁殖和衰老等活动均趋于减弱或暂时性停止,当环境条件一旦恢复后,将立即恢复到活动状态[7]。例如干燥条件下,缓步类动物身体失水高达95%,身体收缩成桶状,此时新陈代谢完全停止,机体依靠海藻糖和热激蛋白等保护细胞基本结构免遭损害,隐生状态下的缓步类动物能抵抗极端的冷、热、旱、化学物质以及离子辐射[7-8]。
在紫菜中尚未发现有特化的组织器官来应对常态化的环境剧变[9],因此紫菜有可能采用了类似隐生的休眠机制来度过逆境,这样它们能将能耗和损伤降低到最低限,这在理论上是有意义的。为此,本文拟从分子和生理两个层面上来进行举证。在生理水平上主要研究高盐度胁迫对条斑紫菜光合放氧与呼吸耗氧的影响,在分子水平上主要研究高盐度胁迫对抗逆基因S-腺苷甲硫氨酸合成酶(S-Adenosylmethionine synthetase,命名为PySAMS)表达的影响。
1 材料与方法
1.1 条斑紫菜叶状体采集及胁迫处理
条斑紫菜叶状体于2012年1月从连云港海区的紫菜养殖场采集,选取健康叶片并剪成2 cm×2 cm大小,暂养于30盐度的过滤海水中,控制培养温度为8℃、光照为100μmol photons·m-2·s-1、光周期为12L∶12D,24h通空气,每天更换海水和ES培养基。暂养1周后将叶状体分别转移到30,40,50,60,70和80盐度的海水中进行盐度胁迫处理,处理于每日的10:00—14:00之间进行,每个处理3个重复,处理1h后取样。
1.2 条斑紫菜叶状体光合特性的检测
采用氧电极法测定条斑紫菜叶状体在盐胁迫下的光合特性。参照邹定辉等[10]的方法,用卤钨灯提供照明,通过调节卤钨灯距离将光照强度设定为400μmol photons·m-2·s-1;用低温恒温槽的循环水流将测定温度控制在8℃。Oxygraph液相氧电极和配套软件的使用参考仪器说明书进行,并且在正式测量之前先在8℃下标定氧电极。然后取盐胁迫处理后的藻体小片块约20mg加入到氧电极反应杯中,杯中反应介质为相应盐度的灭菌海水,连续搅拌反应介质并记录反应杯中氧的时间进程曲线。首先暗培养并纪录耗氧数据,以此作为藻体的呼吸强度;然后再在光照下培养并记录放氧数据,以此作为藻体的光合强度。
1.3 条斑紫菜叶状体PySAMS基因表达的检测
总RNA抽提参照TRIzol试剂(Invitrogen)说明书进行,抽提后的总RNA按DNase I(Fermentas)说明书进行处理,以避免残留的微量基因组DNA影响定量PCR结果的准确性。使用核酸蛋白定量仪(Bio-Rad)检测总RNA的纯度及浓度,电泳检测总RNA的完整性。
根据易乐飞等[11]克隆的 PySAMS基因序列(FJ404748)设计定量 PCR引物,正向引物是 5'AACGAGAGCGAGGACCTGATG 3',反向引物是5'CGTGCTGCGTGCTGATGAC 3',预期扩增产物长199bp。参考周向红等[12]的方法,选用18SrRNA序列(DQ666486)作内参进行上样误差校正和标准化,其定量PCR的正向引物是5'TGCCAGCACTGCGTTCTTACC 3',反向引物是5'AGCCTTCCGACCCAGGACTATC 3',预期扩增产物长163bp。所有引物均由生工生物工程(上海)有限公司合成。
以Oligo(dT)和Random 6 mers为引物,使用PrimeScript® RT reagent Kit(TaKaRa)进行反转录反应。在IQ5 PCR仪(Bio-Rad)上进行实时荧光定量PCR反应。25μL的反应体系中包含12.5μL 2×SYBR® Premix Ex TaqTMII(TaKaRa)、0.2μmol/L每种引物和2μL反转录产物。采用两步PCR法进行扩增,即首先95℃预变性1min;然后进入45个循环,每个循环中95℃变性10s,62℃延伸30s;循环结束后,从55℃缓慢升温到95℃,制备熔解曲线。同时还以10×系列稀释的反转录产物为模板进行定量PCR,以制作PySAMS和内参的标准曲线。每次反应都设置阴性对照和无模板对照,每个反应设3个复孔。
1.4 数据分析
应用PFAFFL[13]建立的数学模型对定量PCR数据进行处理,从而获得PySAMS在不同盐度下的相对表达量;藻体放氧和耗氧速率以每克鲜叶片每小时产生和消耗的O2的量为单位。所有数据采用SPSS进行统计分析,并以均数±标准差表示。因为各组数据都通过了正态性和方差齐性检验,所以组间差异采用单因素方差分析(one-way ANOVA),组间多重比较采用Ducan检验,P<0.05表示差异显著。
2 结果与分析
2.1 条斑紫菜叶状体光合特性
将藻体从30盐度转移至40盐度的海水中培养1h后,光合放氧率从197.3μmolO2·g-1鲜重·h-1下降至182.2μmolO2·g-1鲜重·h-1;虽然40盐度下的放氧率稍有降低,但是与30盐度的无显著差异。更高盐度(50—80盐度)的海水显著性地抑制了藻体光合作用,光合放氧率下降至149.7—118.2μmolO2·g-1鲜重·h-1范围,而且盐度越高,光合放氧率越低(图1)。高盐度海水培养的藻体呼吸强度的变化趋势类似于光合作用的变化。在40盐度海水条件下,呼吸耗氧率与30盐度的几乎没有变化,维持在22.6μmolO2·g-1鲜重·h-1左右。更高盐度(50—80盐度)的海水则显著性地抑制了藻体呼吸作用,呼吸耗氧率下降至15.1—12.1μmolO2·g-1鲜重·h-1范围,而且盐度越高,呼吸耗氧率越低,但彼此间尚无显著差异(图1)。
高盐度海水培养不同程度地抑制了藻体的光合和呼吸作用。放氧率降低表明藻体的有机物合成下降,耗氧率降低表明藻体的生理活性下降,因此50—80盐度不利于藻体生长,而且盐度越大则影响越大。
2.2 条斑紫菜叶状体PySAMS基因表达
核酸分离纯化是各类分子操作的第一步,因此总RNA质量对后续反转录与PCR反应具有较大影响。本实验中,抽提的所有总 RNA 经检测后显示 A260/A280的比值介于 1.9—2.1,A260/A230的比值介于 2.0—2.3,而且经普通琼脂糖凝胶电泳后显示出明亮且清晰的28S和18SrRNA条带以及一些细胞器rRNA条带。上述结果表明总RNA中没有明显的蛋白质、多糖或多酚等残留,总RNA片段完整且没有明显降解,进一步的DNase I处理清除了总RNA中残留的DNA。因此总RNA质量可以满足后续实验要求。

图1 条斑紫菜叶状体在不同盐度海水培养1h后的光合特性Fig.1 Photosynthetic characteristics of P.yezoensis thalli under salinity stress
PySAMS基因的扩增曲线呈规则的“S”形,基线平整、指数区明显;熔解曲线仅显示单一的特异峰;标准曲线的斜率为3.45,扩增效率为95%,相关系数是0.998。阴性对照和无模板对照的扩增曲线均呈水平直线状,复孔间扩增曲线基本重叠。这些说明扩增产物特异性高,无引物二聚体及非特异性扩增,确保了定量的准确性。
定量PCR结果显示高盐度的海水对PySAMS基因的相对表达量具有显著影响(图2)。将条斑紫菜叶状体转移至40盐度海水中培养,1h后检测到PySAMS被诱导表达,该表达量是30盐度下的1.58倍,且与之差异显著。50盐度海水培养1h后也检测到PySAMS表达量升高,该表达量是30盐度下的1.43倍。更高盐度(60—80盐度)海水胁迫后,PySAMS的表达量不但没有升高反而不同程度的下降,是30盐度下的0.70—0.73倍,且与之差异显著。
3 讨论
光合与呼吸作用是植物体内非常重要的生理过程,但容易受到外界环境的影响。研究表明叶绿体的类囊体膜是光能吸收、传递和转换的结构基础;盐胁迫下,过量盐离子积累会使类囊体膜糖脂含量显著下降,不饱和脂肪酸含量降低,饱和脂肪酸含量升高,垛叠状态的类囊体膜的比例减少,类囊体排列紊乱、膨大,基粒排列方向改变,基粒和基质片层界限模糊不清,叶绿素含量降低,从而降低了植物对光量子的有效吸收、传递和利用,使激发能不能迅速传递和转化,降低了光能转化为生物化学能的效率,最终降低了光合能力[14]。本文研究结果也显示了类似的抑制效应,即盐度越高对藻体光合作用的抑制越强(图1)。
呼吸作用为植物的生命活动提供大部分能量,当然也为植物抵御盐胁迫提供能量;植物积累或拒绝盐离子以及合成有机渗透调节物来适应或抵抗盐胁迫等一系列过程都需要消耗大量能量,因此低浓度盐胁迫下或盐胁迫早期植物呼吸强度通常会增加,然而更高强度的盐胁迫会抑制呼吸[14]。本文研究结果与高等植物的略有不同。条斑紫菜体细胞能正常生长发育的盐度范围在19.6—32.8之间[15],因此40盐度已属轻度盐胁迫。虽然盐度越高对藻体呼吸作用的抑制越强,但是轻度盐胁迫(40盐度)并没有增加藻体的呼吸强度(图1B)。类似现象在其它耐盐或耐旱的藻类中也有发现。例如,培养液中NaCl浓度的升高引起发状念珠藻(Nostoc flagelliforme,俗称“发菜”)藻体呼吸作用的降低,在 0—0.1mol/L NaCl条件下,呼吸维持在 3.57—3.60μmol·g-1·h-1,一旦盐度增加到0.2mol/L NaCl,呼吸迅速下降至2.44μmol·g-1·h-1,而且盐度越高呼吸作用越低[16]。将 1.5mol/L NaCl培养的杜氏盐藻(Dunaliella salina)转移至 2.5mol/L NaCl中培养 20min,呼吸作用也显著降低[17]。
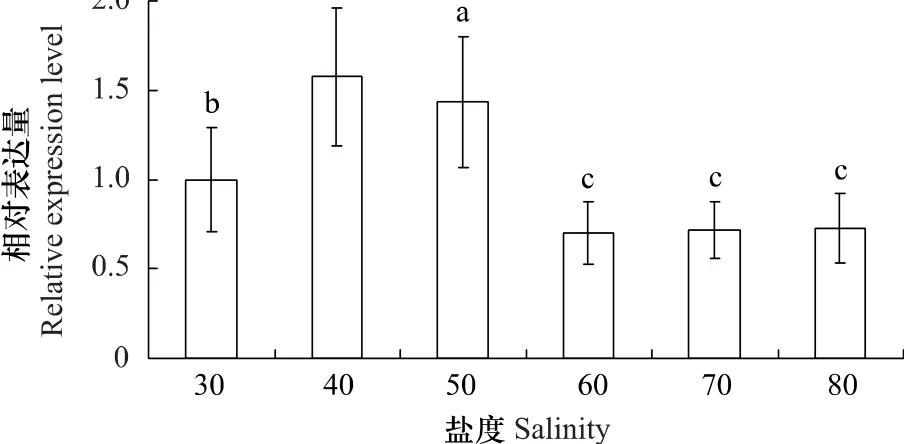
图2 条斑紫菜叶状体PySAMS基因在盐度胁迫下的相对表达量Fig.2 The relative mRNA expression levels of PySAMS gene in P.yezoensis thalli under salinity stress
SAMS在生物体内催化ATP和L-甲硫氨酸反应生成S-腺苷甲硫氨酸(S-adenosylmethionine,SAM),SAM作为重要的中间代谢物参与转甲基、转硫和转氨丙基等反应[18],反应能生成乙烯、多胺、还原型谷胱甘肽和甜菜碱等分子[11],这些物质能参与植物对逆境的抵抗过程,因此SAMS在植物的抗逆过程中发挥着积极作用。大量数据表明SAMS基因的确受环境胁迫的诱导表达[19-21],而且超表达SAMS还能提高转基因植物的抗逆能力[22-23]。与陆地棉(Gossypium hirsutum)[24]、裙带菜(Undaria pinnatifida)[25]等这些陆生植物和海洋藻类的SAMS一样,PySAMS受到盐胁迫的诱导表达。但是,PySAMS又有着其特殊的表达模式,即在40和50盐度时PySAMS诱导表达明显,在更高盐度(60、70和80盐度)胁迫下不被诱导(图2)。
综合生理和分子水平上的数据来看,30至40盐度范围内条斑紫菜光合与呼吸作用均不受影响,那么在40盐度下被诱导表达的PySAMS则可能参与维持了细胞内环境稳定,进而维持光合与呼吸作用的正常进行。在50盐度下,虽然PySAMS被诱导表达,但是PySAMS等抗逆基因以及渗透调节物质可能不足以维持内环境的稳定,于是光合与呼吸作用受到了盐胁迫的抑制。更高盐度(60至80盐度)下,藻体的光合与呼吸作用以及PySAMS基因表达都受到了明显抑制;光合作用的减弱将直接影响到藻体生长,呼吸作用的减弱将直接减少细胞内能量的产生,PySAMS表达量的减少将消弱维持细胞内环境稳定的能力。这些数据验证了我们的推断,即在面对逆境时条斑紫菜叶状体可能采用隐生策略来逐步降低体内新陈代谢以度过不良环境。这一假设也得到了其它数据的支持,例如随着脱水的增加,条斑紫菜叶状体光合和呼吸都逐步减弱,最后几近暂停[26],抗逆基因HSP70和HSP90的表达也受抑制[27-28]。虽然隐生的具体机理不详,但一般认为高浓度海藻糖可代替丢失的水,在细胞内形成氢键框架以抵御胁迫,热激蛋白则在胁迫解除后的恢复过程中发挥作用[29]。红藻含有高浓度的可溶性糖——红藻糖苷(floridoside),其在细胞质内也可以形成氢键框架[9]。因此这些数据暗示着条斑紫菜叶状体能采用隐生策略来度过不良环境。
为什么高盐胁迫抑制了PySAMS基因表达呢?对于条斑紫菜叶状体,高盐不仅抑制了PySAMS表达,还抑制了渗透调节物质甘露醇的合成,45盐度胁迫后的12h内藻体内甘露醇含量远远高于同期55和65盐度胁迫下的甘露醇含量[3]。虽然上述现象容易让人认为PySAMS和甘露醇不是藻体耐盐的主要物质,但是我们更倾向于认为:在细胞内存在某种胞质浓度感应装置,当胞质浓度增加并超过某一阈值之后细胞将降低体内新陈代谢以度过不良环境;那么在轻度盐胁迫时,胞质浓度达到阈值所经历时间长或者达不到阈值,此期间有更多的机会合成抗逆物质,反之,在重度盐胁迫时,胞质浓度达到阈值所经历时间短,此期间可能来不及合成抗逆物质。这一假设不仅能解释盐胁迫下的这些特殊现象,甚至还能对干出胁迫进行部分解释。条斑紫菜叶状体HSP70和HSP90在失水胁迫后不被诱导表达的原因可能是藻体一旦干出后,水分会从细胞内迅速流失,胞质浓度快速达到阈值,于是没有足够的时间去合成这些基因。
条斑紫菜耐受盐度胁迫的机理是复杂的、多方面的,仍然有许多机理不明[1],虽然本文提出了条斑紫菜的隐生假说,但是藻体如何感知胞质浓度变化,如何在高盐环境中生存以及如何在盐胁迫解除后迅速恢复生长等,详细的机理还有待于进一步研究。
[1]Blouin N A,Brodie JA,Grossman A C,Xu P,Brawley SH.Porphyra:a marine crop shaped by stress.Trends in Plant Science,2011,16(1):29-37.
[2]Davison I R,Pearson G A.Stress tolerance in intertidal seaweeds.Journal of Phycology,1996,32(2):197-211.
[3]Feng C,Lu X Z,Yu W G.Biochemical and physiological effects of adversity stress on Porphyra yezoensis.Transactions of Oceanology and Limnology,2004,26(3):22-26.
[4]Reed R H,Collins J C,Russell G.The effects of salinity upon galactosyl-glycerol content and concentration of the marine red alga Porphyra purpurea(Roth)C.Ag.Journal of experimental botany,1980,31(6):1539-1554.
[5]Hong D D,Kim T H,Hwang M S,Chung I K,Lee C H.Effects of salinity on chlorophyll fluorescence from Porphyra thalli and comparison of species with different intertidal distribution.Journal of Fisheries Science and Technology,1998,1(1):122-128.
[6]Satoh K,Smith C M,Fork D C.Effects of salinity on primary processes of photosynthesis in the red alga Porphyra perforata.Plant Physiology,1983,73(3):643-647.
[7]Schill R O,Mali B,Dandekar T,Schnölzer M,Reuter D,Frohme M.Molecular mechanisms of tolerance in tardigrades:New perspectives for preservation and stabilization of biological material.Biotechnology Advances,2009,27(4):348-352.
[8]Su L N,Li X C.Overview on dormancy of tardigrada.Sichuan Journal of Zoology,2006,25(1):191-195.
[9]Liu Y-C.Mechanism for differential desiccation tolerance in Porphyra species[D].Boston:Northeastern University,Department of Biology,2009.
[10]Zou D H,Gao K S.The effects of elevated inorganic carbon concentration on photosynthesis of Ulva lactuca under different temperature.Marine Sciences,2002,26(3):49-52.
[11]Yi L F,Wang P,Zhou X H,Liu C W.cDNA cloning and bioinformatic analysis of SAMS gene from Porphyra yezoensis.China Biotechnology,2009,29(7):43-49.
[12]Zhou X H,Yi L F,Li X S,Wang P,Yang P L.Molecular cloning and expression pattern of glutathione S-transferase gene in Porphyra yezoensis Ueda(Bangiales,Rhodophyta).Journal of Fisheries of China,2011,35(9):1354-1361.
[13]Pfaffl M W.A new mathematical model for relative quantification in real-time RT-PCR.Nucleic acids research,2001,29(9):e45.
[14]Yang X H,Jiang W J,Wei M,Yu H J.Review on plant response and resistance mechanism to salt stress.Journal of Shandong Agricultural University(Natural Science),2006,37(2):302-305,308.
[15]Yan X H,Jiang H B.Effects of salinity on the growth and development of somatic cells and preliminary observation of lower salinity Resistant in Porphyra yezoensis.Journal of Shanghai Fisheries University,1993,2(1):34-40.
[16]Bi Y H,Deng Z Y,Hu Z Y,Xu M.Response of Nostoc flagelliforme to salt stress.Acta Hydrobiologica Sinica,2005,29(2):125-129.
[17]Liu X D,Shen Y G.Salt shock induces state IItransition of the photosynthetic apparatus in dark-adapted Dunaliella salina cells.Environmental and Experimental Botany,2006,57(1/2):19-24.
[18]Zhang J G,Li X H,Yuan Z Y.Research advances in gene and structure of S-adenodylL-methionine synthetase.Industrial Microbiology,2005,35(3):39-44.
[19]Ma X,Wang Z,Qi Y,Zhao Y,Zhang H.Isolation of S-adenosylmethionine synthetase gene from Suaeda salsa and its differential expression under NaCl stress.Acta Botanica Sinica,2003,45(11):1359-1365.
[20]Lin F Y,Wang SQ,Hu Y G,He B R.Cloning of a S-adenosylmethionine synthetase gene from broomcorn millet(Panicum miliaceum L.)and its expression during drought and re-watering.Acta Agronomica Sinica,2008,34(5):777-782.
[21]Hwang SS,Cheah SC,Kulaveerasingam H,Tan S H.Molecular Cloning and Characterization of S-adenosylmethionine Synthetase Isolated from Suspension Culture Cdna Library of Oil Palm(Elaeis guineensis Jacq.).Pakistan Journal of Biological Sciences,2003,6(16):1468-1475.
[22]Fan JP,Bai X,Li Y,Ji W,Wang X,Cai H,Zhu Y M.Cloning and function analysis of gene SAMSfrom Glycine soja.Acta Agronomica Sinica,2008,34(9):1581-1587.
[23]Hua Y,Zhang B X,Cai H,Li Y,Bai X,Ji W,Wang Z Y,Zhu Y M.Stress-inducible expression of GsSAMS2 enhances salt tolerance in transgenic Medicago sativa.African Journal of Biotechnology,2012,11(17):4030-4038.
[24]Zhou K,Song L Y,Ye W W,Wang J J,Wang D L,Fan B X.Cloning and expression of GhSAMS gene related to salt-tolerance in Gossypium hirsutum L.Acta Agronomica Sinica,2011,37(6):1012-1019.
[25]Qiao K.Cloning,analysis and prokaryotic expression of SAMSgene in Undaria pinnatifida[D].Dalian:Liaoning Normal University,2011.
[26]Gao K,Aruga Y.Preliminary studies on the photsynthesis and respiration of Porphyra yezoensis under emersed conditions.Journal of the Tokyo University of Fisheries,1987,47(1):51-65.
[27]Zhou X,Wang P,Yan B,Li X,Yi L.Characterization and expression patterns of two 70-kDa heat shock protein genes in the intertidal red alga Porphyra yezoensis.Botanica Marina,2011,54(5):447-455.
[28]Zhou X H,Li X S,Wang P,Yan B L,Teng Y J,Yi L F.Molecular cloning and expression analysis of HSP90 gene from Porphyra yezoensis Udea(Bangiales,Rhodophyta).Journal of Fisheries of China,2010,34(12):1844-1852.
[29]Welnicz W,Grohme M A,Kaczmarek L,Schill R O,Frohme M.Anhydrobiosis in tardigrades the last decade.Journal of insect physiology,2011,57(5):577-583.
参考文献:
[3]冯琛,路新枝,于文功.逆境胁迫对条斑紫菜生理生化指标的影响.海洋湖沼通报,2004,26(3):22-26.
[8]苏丽娜,李晓晨.缓步动物休眠现象研究进展.四川动物,2006,25(1):191-195.
[10]邹定辉,高坤山.不同温度条件下无机碳浓度增高对石莼光合作用的影响.海洋科学,2002,26(3):49-52.
[11]易乐飞,王萍,周向红,刘楚吾.条斑紫菜SAMS基因克隆与生物信息学分析.中国生物工程杂志,2009,29(7):43-49.
[12]周向红,易乐飞,李信书,王萍,阎斌伦.条斑紫菜谷胱甘肽S-转移酶基因的克隆与表达分析.水产学报,2011,35(9):1354-1361.
[14]杨晓慧,蒋卫杰,魏珉,余宏军.植物对盐胁迫的反应及其抗盐机理研究进展.山东农业大学学报(自然科学版),2006,37(2):302-305+308.
[15]严兴洪,江海波.盐度对条斑紫菜体细胞生长发育的影响及耐低盐应变异体的初步观察.上海水产大学学报,1993,2(1):34-40.
[16]毕永红,邓中洋,胡征宇,徐敏.发状念珠藻对盐胁迫的响应.水生生物学报,2005,29(2):125-129.
[18]张建国,李新华,袁中一.腺苷甲硫氨酸合成酶的基因及结构研究进展.工业微生物,2005,35(3):39-44.
[20]林凡云,王士强,胡银岗,何蓓如.糜子SAMS基因的克隆及其在干旱复水中的表达模式分析.作物学报,2008,34(5):777-782.
[22]樊金萍,柏锡,李勇,纪巍,王希,才华,朱延明.野生大豆S-腺苷甲硫氨酸合成酶基因的克隆及功能分析.作物学报,2008,34(9):1581-1587.
[24]周凯,宋丽艳,叶武威,王俊娟,王德龙,樊保香.陆地棉耐盐相关基因GhSAMS的克隆及表达.大连:作物学报,2011,37(6):1012-1019.
[25]乔坤.裙带菜SAMS基因的克隆、分析及原核表达[D].大连:辽宁师范大学,2011.
[28]周向红,李信书,王萍,阎斌伦,滕亚娟,易乐飞.条斑紫菜HSP90基因的克隆与表达分析.水产学报,2010,34(12):1844-1852.
