荒漠啮齿动物群落对开垦干扰的响应及其种群生态对策
2013-12-09付和平武晓东张晓东查木哈张福顺甘红军
袁 帅,付和平,武晓东,*,张晓东,查木哈, 张福顺,甘红军
(1. 内蒙古农业大学生态环境学院,呼和浩特 010019; 2. 草业与草地资源教育部重点实验室, 呼和浩特 010019; (3. 中国农业科学院草原研究所, 呼和浩特 010010; 4. 内蒙古阿拉善盟草原站, 巴彦浩特 750306)
荒漠啮齿动物群落对开垦干扰的响应及其种群生态对策
袁 帅1, 2,付和平1, 2,武晓东1, 2,*,张晓东1, 2,查木哈1, 2, 张福顺3,甘红军4
(1. 内蒙古农业大学生态环境学院,呼和浩特 010019; 2. 草业与草地资源教育部重点实验室, 呼和浩特 010019; (3. 中国农业科学院草原研究所, 呼和浩特 010010; 4. 内蒙古阿拉善盟草原站, 巴彦浩特 750306)
开垦对功能相对脆弱的荒漠生态系统是重要的干扰,这种干扰往往导致栖息地破碎化,并对动植物群落产生强烈影响。作为荒漠生态系统的重要成分,啮齿动物群落受到开垦干扰后对环境的响应及其群落中种群的生态对策,是荒漠生态系统生物多样性及其功能维持稳定的重要基础。2006—2011年,采用标志重捕法对内蒙古阿拉善荒漠区未开垦和开垦草地啮齿动物群落格局及其不同生态对策种群的数量组成进行了专门研究。目的(1)明确开垦干扰下啮齿动物群落格局时间尺度变化;(2)验证假设:人为干扰区(开垦区)啮齿动物群落中r-对策者占据优势,未干扰区(未开垦区)以K-对策者为主;(3)依据啮齿动物群落中不同生态对策种群的数量组成来判断群落所受干扰的程度。结果表明,开垦干扰降低了啮齿动物群落多样性,改变了群落中不同生态对策种群的数量组成,种群以r-对策者为优势;未开垦区啮齿动物群落中以K-对策种群为主。开垦区啮齿动物群落受到严重干扰。
啮齿动物群落; 干扰; 生态对策; 生物多样性; 荒漠
啮齿动物是功能相对脆弱的荒漠生态系统中的重要成分,由于其种类多,数量相对较高,食性多样,在食物网结构中成为重要的次级生产者和消费者,是草原环境与其相互依存、相互作用的进化产物[1]。此外,由于啮齿动物具有较强的繁殖力及其群落对干扰快速响应的能力[2],使其成为评估环境的重要指示物种[3- 4]。因此,研究啮齿动物群落对外部干扰的响应机制及其群落中主要种群生态对策的格局变动,对于认识荒漠区生物多样性变化及荒漠生态系统功能的维持具有重要意义。
种群生态对策一般分为r-对策和K-对策。r-对策者具有寿命短、体型小、繁殖力强的特点,而K-对策者与之相反,相对寿命长、体型大、繁殖力弱。r-/K-选择认为,在具有非密度制约死亡的不稳定环境中,r-对策者要比K-对策者更加适应生存[5- 6]。因此,群落中不同生态对策者的数量组成是判断群落所受干扰程度的重要依据。
开垦对天然草地是一种重要的干扰,已有研究表明,开垦不仅降低土壤有机质含量[7- 8],改变草地原有的理化性状[9- 10],而且可以直接导致动物生境改变[11- 12],对动植物群落产生强烈影响[13- 14]。目前,国内已有关于草地或荒漠区开垦对啮齿动物群落影响的相关研究,并取得了重要成果[14- 17]。但有关荒漠啮齿动物群落对开垦干扰的响应以及群落中种群的生态对策等方面的研究较少。2006—2011年,在内蒙古阿拉善荒漠区,采用标志重捕法研究了未开垦与开垦区啮齿动物群落的变化过程,目的(1)明确开垦干扰下啮齿动物群落结构时间尺度变化;(2)验证假设:人为干扰区(开垦区)啮齿动物群落中r-对策者占据优势,未干扰区(未开垦区)以K-对策者为主;(3)依据啮齿动物群落中不同生态对策者的数量组成来判断群落所受干扰的程度。
1 研究区概况
研究区(104°10′—105°30′E,37°24′—38°25′N)位于内蒙古阿拉善左旗南部的荒漠景观中,地处腾格里沙漠东缘。气候为典型的大陆性高原气候。年降水量75—215mm,主要集中在7—9月。年蒸发量3000—4000mm。土壤为灰漠土和灰棕土。草场类型属于温性荒漠类型,植被稀疏,结构单调,以旱生、超旱生和盐生的灌木、小灌木、半灌木和小半灌木为主。建群种以藜科(Chenopodiaceae)、菊科(Compositae)和蒺藜科(Zygophyllaceae)植物为主。在此本底植被条件下,依据该地区的草地利用方式,选择未开垦区和开垦区2种生境作为取样样区[18]。
(1)未开垦区 面积206.6 hm2,1997年开始禁牧。植物群落建群种为红砂(Reaumuriasoongorica)、珍珠猪毛菜(Salsolapasserina),其次为霸王(Zygophyllumpterocarpum)、驼绒藜(Ceratoideslatens)、狭叶锦鸡儿(Caraganastenophylla)、黑沙蒿(Artemisiaordosica)等小灌木,草本优势种为白草(Pennisetumflaecidum),其次为糙隐子草(Cleistogenessquarosa),伴生植物有雾冰藜(Bassiadasyphylla)等,植被盖度约为29.5%。
(2)开垦区 面积180 hm2,1994年开垦,原生植被与未开垦区类似。开垦后植被以人工种植的梭梭(Haloxylonammodendron)、沙拐枣(Calligonummongolicum)和花棒(Hedysarumscoparium)等乔、灌木和多年生草本紫花苜蓿(Medicagosativa)等为主,伴生植物有1年生雾冰藜等,植被盖度约65%。
2 研究方法
2.1 动物取样
分别选择2个未开垦区和2个开垦区,在每个区中心建立1个固定的标志重捕样地,样地面积1 hm2。方格式布放活捕笼(42 cm × 17 cm × 13cm),行距15m,笼距15m,以新鲜花生米为诱饵[18]。2006—2011年每年4—10月上旬进行数据采集,每次连捕4 d,每天上下午各查笼1次,记录每个捕获个体的种名、编号、性别、体重、繁殖状况及捕获位置。为避免动物因热死亡,6—8月上旬在11:00—15:30关笼。以年平均百笼捕获率统计物种种群数量。
2.2 数据分析
2.2.1 多样性指数
统计不同样地内啮齿动物种数及各物种的捕获数据,并计算多样性指标:
物种丰盛度
S
(1)
Shannon-Wiener指数
(2)
Pielou 均匀性指数
E=H/lnS
(3)
(4)
式中,S为物种数,Pi为第i种个体在总个体中所占比例。
2.2.2 丰富度-生物量比较法(ABC曲线)及W统计
依据Connell[19]的中度干扰假说和Huston[20]的物种多样性广义假说,Warwick[21]提出丰富度-生物量比较法(ABC曲线),该方法具有r-/K-选择的经典进化论背景,在Lambshead与Shaw[22]K-优势曲线的基础上发展而来,用以评估群落受干扰的程度。ABC曲线是以群落中各种群丰富度及生物量的累积优势为纵坐标,以群落中物种排序的对数转换值为横坐标绘制得出的曲线。该方法主要描述3种理想状态:(1)无干扰,生物量曲线位于丰富度曲线上方;(2)适度干扰,生物量曲线比较接近并且相交一次或多次;(3)重度干扰,丰富度曲线位于生物量曲线上方。Clarke[23]提出了针对ABC曲线的W统计,计算公式为:
式中,S为群落中物种数,bj为按照生物量从高到低排序时前j个物种的累积生物量比例;aj为按照丰富度从高到低排序时前j个物种的累积丰富度比例。当W逐渐接近1时, 表示群落生物量优势逐渐由单一物种所统治,但各物种的丰富度趋于相同;当W逐渐接近-1时,情况刚好相反。
2.2.3 差异性检验
为了评估未开垦与开垦区之间啮齿动物群落的差异,将年份作为随机因素对多样性指标及W统计值在混合效应模型中进行了差异性检验。所有分析用SAS9.2软件完成,显著水平为α=0.05,应用Dunnett′st检验进行均值比较。
3 结果与分析
3.1 群落结构
2006—2011年共布放活捕笼9408笼日,捕获啮齿动物3科6属7种(表1),其中跳鼠科(Dipodidae)2种,包括:三趾跳鼠(Dipussagitta)和五趾跳鼠(Allactagasibirica);仓鼠科(Cricetidae)4种,包括:子午沙鼠(Merionesmeridianus),长爪沙鼠(Merionesunguiculatus),小毛足鼠(Phodopusroborovskii)和黑线仓鼠(Cricetulusbarabensis);松鼠科(Sciuridae)1种为:阿拉善黄鼠(Spermophilusalaschanicus)。研究期间,未开垦区捕获啮齿动物7种,优势鼠种为三趾跳鼠,次优势种为子午沙鼠;开垦区捕获啮齿动物5种,优势鼠种为子午沙鼠。依据所捕获啮齿动物的相对体型大小,繁殖后代数量,以及寿命长短将其划分为K-对策者与r-对策者两种[6],其中阿拉善黄鼠、五趾跳鼠和三趾跳鼠相对体型较大,繁殖力较弱,寿命较长为K-对策者(表2)[24- 28];子午沙鼠、长爪沙鼠、黑线仓鼠和小毛足鼠为r-对策者。
未开垦区和开垦区r-对策者和K-对策者在群落中的捕获量比例和物种丰盛度见图1。由图1可知,未开垦区K-对策者捕获量比例显著高于r-对策者(Plt;0.05),而开垦区恰相反,r-对策者捕获量比例极显著高于K-对策者(Plt;0.01);未开垦区中K-对策者物种数多于r-对策者,但差异并不显著,而开垦区内的K-对策者物种数显著低于r-对策者(Plt;0.01)(图1)。

表1 未开垦与开垦区啮齿动物群落结构及捕获量比例

表2 不同生态对策啮齿动物的生物学特征

图1 不同对策者在未开垦与开垦区的组成Fig.1 Composition of captured rodents with different bionomic strategies in non-cultivated and cultivated sites图中“*”表示Plt;0.05,“**”表示Plt;0.01; 均值比较使用Dunnett′s t检验
3.2 群落多样性指数
未开垦与开垦区啮齿动物群落多样性指数变化见图2。由图2可知,未开垦区啮齿动物群落Shannon-Wiener指数及Simpson指数最低值出现在2009年,而开垦区这两个指数的最低值出现在2010年。未开垦区的Pielou均匀性指数在2008年最低,而开垦区这一指数的最低值出现在2008和2010年(图2)。方差分析表明,未开垦区的啮齿动物群落物种数、Shannon-Wiener指数和Simpson指数均显著高于开垦区(Plt;0.05),但均匀性指数差异不显著(表3)。

图2 2006—2010未开垦与开垦区啮齿动物群落多样性指数Fig.2 Rodent community diversity indices between non-cultivated and cultivated treatments from 2006 to 2010
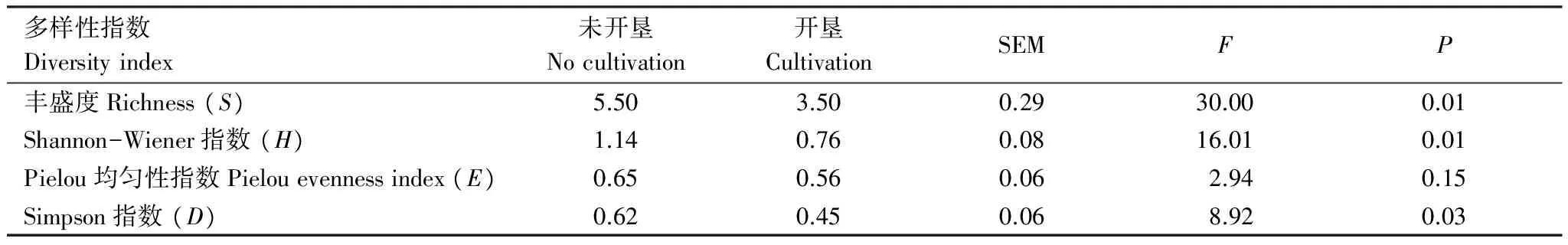
多样性指数Diversityindex未开垦Nocultivation开垦CultivationSEMFP丰盛度Richness(S)5.503.500.2930.000.01Shannon-Wiener指数(H)1.140.760.0816.010.01Pielou均匀性指数Pielouevennessindex(E)0.650.560.062.940.15Simpson指数(D)0.620.450.068.920.03
当Plt;0.05为差异显著,Dunnett′st检验进行均值比较; SEM表示均值标准误
3.3 群落的ABC曲线及W统计
未开垦与开垦区啮齿动物群落丰富度与生物量累积优势曲线见图3和图4。由图3可知,未开垦区啮齿动物群落在2006年与2010年的生物量累积优势大于丰富度累积优势,表明该区啮齿动物群落未受到干扰,生物量由少数物种主导(图3)。其余年份未开垦区生物量累积优势曲线均与丰富度累积优势曲线接近和相交,表明该区啮齿动物群落受到适度干扰(图3)。

图3 2006—2011年未开垦区啮齿动物群落丰富度与生物量累积优势曲线Fig.3 Cumulative dominance curves on abundance and biomass of rodent communities in non-cultivated sites from 2006 to 2011
由图4可知,开垦区2007年啮齿动物群落丰富度累积优势曲线与生物量累积优势曲线较为接近,但其仍处于生物量累积优势曲线上方; 2010年啮齿动物群落丰富度累积优势大于生物量累积优势,与其他年份相反。上述结果表明,除2010年外,其他年份开垦区均处于过度干扰过程,群落中种群数量由少数物种主导。
未开垦与开垦区啮齿动物群落的W统计见图5。未开垦区各年W统计值均大于0,而开垦区除2010年大于0之外,其余年份均小于0(图 5)。差异分析可知,未开垦区的W统计值显著大于开垦区(Plt;0.05),表明非开垦区具有较高的丰富度多样性及较低的生物量多样性,是非干扰群落,开垦区具有较低的丰富度多样性及较高的生物量多样性,为重度干扰群落。

图4 2006—2011年开垦区啮齿动物群落丰富度与生物量累积优势曲线Fig.4 Cumulative dominance curves on abundance and biomass of rodent communities in cultivated sites from 2006 to 2011

图5 2006—2011年未开垦与开垦区中啮齿动物群落的W统计 Fig.5 W-statistic for rodent communities in non-cultivated and cultivated sites from 2006 to 2011*表示Plt;0.05; 均值比较使用Dunnett′s t检验
4 讨论
4.1 群落结构与多样性
关于群落结构及其多样性,有多种假说对其进行了解释。Paine的捕食假说认为,局域动物的物种多样性与该系统内捕食者的数量,以及它们阻止单一猎物垄断重要资源的效率有关[29]。即某一物种独占适宜生境的效率受捕食者的制约。Soykan与Sabo的研究表明,生产力越高的栖息地将支持更多的捕食者,而捕食者的增多显然会抑制猎物中的某一种独占环境资源的速率,进而增加猎物的多样性[30]。但其研究所谓的高生产力栖息地未涉及到频繁的人为干扰。本研究中生产力较高的开垦区却具有较低的啮齿动物群落多样性,可能是由于频繁的农事干扰使捕食者较少出现所导致。从群落结构来看,开垦干扰降低了啮齿动物群落的物种丰盛度、Shannon-Wiener指数及Simpson指数,使得动物的栖息生境趋于破碎化,在较大的时间尺度上动物种类趋于减少,群落结构也趋于简单,系统更加脆弱,而未开垦区却相反。武晓东等曾对同一区域的啮齿动物研究发现,未开垦区啮齿动物物种数略低于开垦区[18]。主要由于时间尺度(3a)和空间尺度(40 hm2)与本研究的差异所致。
Downes 等的栖息地异质性假说认为,栖息地结构在局部尺度上调节物种多样性,复杂的栖息地通常与较高的物种丰富度有关[31]。大多数支持该假说的研究都以植物群落的物理结构充当动物栖息地的本底[12, 32- 33],虽然有大量的实例证明栖息地异质性假说[31,34],但也有一些研究表明栖息地异质性的增加会导致物种多样性的下降[35- 36]。Tew等在这两种相互矛盾结论的基础上提出了关键结构假说,认为生物多样性在具有关键结构的生态系统中要比在复杂结构生态系统中更为脆弱,关键结构的丧失或质量下降会造成物种多样性的衰减[37]。从结构的复杂性来看,本研究中开垦区由于植物种类相对单一,植被的物理结构复杂性显然要低于未开垦区,而开垦干扰形成的较高植被盖度,纵横交错的灌渠及道路显然不适合喜欢开阔生境,活动范围较大的跳鼠生存[38]。因此,开垦区一些关键结构的丧失,造成了群落多样性的降低。
无论是捕食者假说还是栖息地异质性假说,理论依据均着重于动物群落本身的外因,没有真正解释群落内部物种自身受到何种程度影响而形成现有群落格局的内因。Huston 在这些假说的基础上提出了非平衡假说[20],这一假说用竞争种群的增长率及替代速率来解释群落多样性格局。该假说认为,大多数群落处于非平衡态,在这一状态中种群的周期减少和环境的波动阻止了竞争平衡,从而形成一个稳定的多样性水平,竞争者种群的增长率增加通常会导致多样性下降。本研究子午沙鼠1a繁殖2—3次,平均胎仔数6.2(表2),种群增长大于每年繁殖1次的三趾跳鼠,而且子午沙鼠与三趾跳鼠存在空间生态位重叠,二者在同一生境中存在竞争[39],加之开垦区的低捕食压力以及跳鼠生境关键结构的丧失,也间接有利于子午沙鼠的种群增长。因此,外因与内因的共同作用导致了开垦区较低的啮齿动物群落多样性。
4.2 种群的生态对策及群落干扰程度
种群生态对策问题是近代生态学研究倍受关注的理论热点和难点[40]。比较经典的生态学对策当属r-对策和K-对策[5- 6]。基于r-对策和K-对策理论,生活在干扰栖息地中的种群会在数量的成倍增长上投入较多能量,从而可以快速的占据栖息地。因此,在非密度制约死亡的不稳定环境中,r-对策者为优势,而较高的物种丰盛度会促进K-选择[41]。本研究未开垦区K-对策者占优势,开垦区r-对策者占优势,K-对策者均具有冬眠习性,r-对策者则不具备这一特点。冬眠可使啮齿动物在严酷的自然环境中明显提高存活率[42- 43],从而延长寿命。此外,ABC曲线和W统计结果也表明,未开垦区啮齿动物群落中种群数量优势被多个物种所主导,而生物量优势被个别物种占据,即K-对策者在群落中占据优势,群落处于未受干扰或适度干扰程度;开垦区啮齿动物群落中种群数量优势被少数物种所主导,而生物量优势被多个物种占据,因此群落中r-对策者为优势,表明群落受到了严重干扰。
武晓东等用敏感性反应来描述荒漠区啮齿动物群落在不同人为干扰下优势种的替代现象,得出不同啮齿动物种对不同干扰的敏感性差异[14,18]。但未对敏感性反应机制做出进一步解释。依据本研究对未开垦和开垦区啮齿动物群落中种群生态对策的划分结果,开垦干扰下K-对策者在群落中比例显著下降,表明开垦干扰不适合K-选择物种生存,即K-对策者是开垦干扰的敏感者。但本研究中开垦干扰同样使r-对策者小毛足鼠数量减少,甚至从开垦区消失,就其生态生物学特性来看,小毛足鼠全年主要以植物种子为食[44],生境中多种不同结实期的植物种子会延长小毛足鼠的食物利用期。开垦区植被单一,种子成熟时间相对集中,不利于活动范围较小的小毛足鼠全年食物获取。此外,小毛足鼠体型较小,挖掘能力有限[45],更适宜于在松软的沙质环境中生存[27],而开垦区相对较少的沙质环境也可能是其分布的限制因子之一。因此短期来看,具有不同生活史对策的物种对环境变化采取了不同的行为响应,能够快速适应环境变化的物种继续留存,而另一些物种由于遇到其进化史中未遇到的人为干扰采取了非适应响应[46],通过迁出或死亡而减少非适宜生境中种群数量或灭绝[47],非适应响应导致了物种分布、多样性和群落格局的变化。长期来看,个体通过非适应响应选择是否在变化的环境中存活或繁殖,变化的环境又反过来影响了物种进化过程,进而影响其对生活史特性的选择[48]。啮齿动物是环境变化的重要指示者之一[4],啮齿动物群落受外因扰动后的变化程度及其不同生态对策者在荒漠生态系统中的功能与作用,是进一步研究人为干扰下啮齿动物群落和荒漠生态系统稳定性需要探讨的重要问题。
综上所述,本研究开垦干扰降低了啮齿动物群落多样性,改变了群落中不同生态对策者的数量组成,并且使群落处于重度干扰过程。人为干扰生境(开垦区)啮齿动物群落中物种以r-对策者为优势,未干扰生境(未开垦区)群落中物种以K-对策者为主。
致谢: 内蒙古农业大学研究生鄂晋、吉晟男、韩艳静等对野外数据收集给予帮助;野外工作同时也得到了内蒙古阿拉善盟草原站的帮助;加拿大半干旱农业研究中心的B. Biligetu博士润色英文摘要;内蒙古农业大学高福光博士,李元恒博士以及澳大利亚陈超博士帮助查询文献,特此致谢。
[1] Zhong W Q. Role and management of rodent in grassland ecosystem. Bulletin of Biology, 2008, 43(1):1- 3.
[2] Clark B K, Kaufman D W, Finck E J, Kaufman G A. Small mammals in tall-grass prairie: Patterns associated with grazing and burning. Prairie Naturalist, 1989, 21(4): 177- 184.
[3] Dale V H, Beyeler S C. Challenges in the development and use of ecological indicators. Ecological Indicators, 2001, 1(1): 3- 10.
[4] Leis S A, Leslie D M, Engle D M, Fehmi J S. Small mammals as indicators of short-term and long-term disturbance in mixed prairie. Environmental Monitoring and Assessment, 2008, 137(1/3): 75- 84.
[5] MacArthur R H, Wilson E O. The Theory of Island Biogeography. Princeton N J: Princeton University Press,1967.
[6] Pianka E R. On r and K selection. American Naturalist, 1970, 104(940): 592- 597.
[7] Aguilar R, Kelly E F, Heil R D. Effects of cultivation on soils in northern great plains rangeland. Soil Science Society of America Journal, 1988, 52(4): 1081- 1085.
[8] Davidson E A, Ackerman I L. Changes in soil carbon inventories following cultivation of previously untilled soils. Biogeochemistry, 1993, 20(3): 161- 193.
[9] Jiao Y, Zhao J H, Xu Z. Effects of a conversion from grassland to cropland on soil physical-chemical properties in the agro-pastoral ecotone of Inner Mongolia: analysis of a 50-year chronosequence. Ecology and Environmental Sciences, 2009, 18(5):1965- 1970.
[10] Zhang W L, Chen S P, Miao H X, Lin G H. Effects on carbon flux of conversion of grassland steppe to cropland in China. Journal of Plant Ecology, 2008, 32(6):1103- 1110.
[11] Jepsen J U, Topping C J, Odderskr P, Andersen P N. Evaluating consequences of land-use strategies on wildlife populations using multiple-species predictive scenarios. Agriculture, Ecosystems and Environment, 2005, 105(4):581- 594.
[12] Benton T G, Vickery J A, Wilson J D. Farmland biodiversity: is habitat heterogeneity the key? Trends in Ecology and Evolution, 2003, 18(4): 182- 188.
[13] Jin X X, Zhang D M. Rodent Community Structure and Species Diversity Analysis in Mosuowan Reclamation. Chinese Journal of Zoology, 2005, 40(6): 30- 37.
[14] Wu X D, A J, Fu H P, Jin H. Desert rodent communities patterns under different disturbances: the canonical correlation analysis of rodent and plant communities. Acta Ecologica Sinica, 2008, 28(12):6000- 6017.
[15] Zhang D M, Aniwar, Jiang T, Jian Y L. Analysis of the rodent community diversity and species variation in the Junggar Basin. Chinese Biodiversity, 1998, 6(2): 92- 98.
[16] Liu J K, Liang J R, Sha Q. The community and biomass change in rodents under the condition of reclaiming the desert into farmland in Nomhon, Qinghai province. Acta Zoologica Sinica, 1979, 25(3):260- 267.
[17] Fu H P, Wu X D, Yang Z L. Diversity of small mammals communities at different habitats in Alashan region,Inner Mongolia. Acta Theriologica Sinica, 2005, 25(1):32- 38.
[18] Wu X D, Fu H P. Fluctuations and patterns of desert rodent communities under human disturbance: the fluctuating tendency and the sensitive response of their population. Acta Ecologica Sinica, 2006, 26(3):849- 861.
[19] Connell J H. Diversity in tropical rain forests and coral reefs. Science, 1978, 199(4335): 1302- 1310.
[20] Huston M. A general hypothesis of species diversity. The American Naturalist, 1979, 113(1): 81- 101.
[21] Warwick R M. A new method for detecting pollution effects on marine macrobenthic communities. Marine Biology, 1986, 92(4): 557- 562.
[22] Lambshead P J D, Platt H M, Shaw K M. The detection of differences among assemblages of marine benthic species based on an assessment of dominance and diversity. Journal of Natural History, 1983, 17(6): 859- 874.
[23] Clarke K R. Comparisons of dominance curves. Journal of Experimental Marine Biology and Ecology, 1990, 138(1/2): 143- 157.
[24] Lu H Q, Ma Y, Zhao G Z. Prediction and Management of Rodent Pest. Beijing: Agricultural Publishing House, 1988: 32- 59.
[25] Hang W J, Xu S J. Rodents and Lagomorphs of China. Shanghai: Fudan University Press, 1995:99- 267.
[26] Zhang Z B, Wang Z W. Ecology and Management of Rodent Pest in Agriculture. Beijing: China Ocean Press, 1998:22- 23.
[27] Wu X D, Fu H P, Yang Z L. Researches on Rodents in Semi-Desert and Desert in China. Beijing: Science Press, 2009: 48- 73.
[28] Ma Y, Wang F G, Jin S K, Li S H. Glires (Rodents and Lagomorphs) of Northern Xinjiang and Their Zoogeographical Distribution, China. Beijing: Science Press, 1987:228- 230.
[29] Paine R T. Food web complexity and species diversity. American Naturalist, 1966,100(910): 65- 75.
[30] Soykan C U, Sabo J L. Spatiotemporal food web dynamics along a desert riparian-upland transition. Ecography, 2009, 32(2): 354- 368.
[31] Downes B J, Lake P S, Schreiber E S G, Glaister A. Habitat structure and regulation of local species diversity in a stony, upland stream. Ecological Monographs, 1998, 68(2): 237- 257.
[32] Murdoch W W, Evans F C, Peterson C H. Diversity and pattern in plants and insects. Ecology, 1972, 53 (3): 819- 829.
[33] Sullivan T P, Sullivan D S, Lindgren P M F. Influence of repeated fertilization and cattle grazing on forest ecosystems: Abundance and diversity of forest-floor small mammals. Forest Ecology and Management, 2012, 277: 180- 195.
[34] Riojas-López M E. Response of rodent assemblages to change in habitat heterogeneity in fruit-oriented nopal orchards in the Central High Plateau of Mexico. Journal of Arid Environments, 2012, 85: 27- 32.
[35] Ralph C J. Habitat association patterns of forest and steppe birds of Northern Patagonia, Argentina. The Condor, 1985, 87(4): 471- 483.
[36] Sullivan T P, Sullivan D S, Lindgren P M F. Influence of variable retention harvests on forest ecosystems. II. Diversity and population dynamics of small mammals. Journal of Applied Ecology, 2001, 38(6): 1234- 1252.
[37] Tews J, Brose U, Grimm V, Tielbörger K, Wichmann M C, Schwager M, Jeltsch F. Animal species diversity driven by habitat heterogeneity/diversity: the importance of keystone structures. Journal of Biogeography, 2004, 31(1): 79- 92.
[38] Zhao K T. Studies on ecology ofDipussagittaPallas. Chinese Journal of Zoology, 1964, (2): 59- 62.
[39] Fu H P, Wu X D, Yang Z L. Niche characteristics of rodents by diverse disturbance in Alashan Desert, Inner Mongolia. Acta Ecologica Sinica, 2005, 25(10): 2637- 2643.
[40] Sun R Y. Principles of Animal Ecology. 3rd ed. Beijing: Beijing Normal University Press, 2001:243- 244.
[41] Lipowsky A, Roscher C, Schumacher J, Schmid B. Density-Independent Mortality and Increasing Plant Diversity Are Associated with Differentiation ofTaraxacumofficinaleinto r- and K-Strategists. PLoS ONE, 2012, 7(1): e28121.
[42] Lebl K, Bieber C, Adamík P, Fietz J, Morris P, Pilastro A, Ruf T. Survival rates in a small hibernator, the edible dormouse: a comparison across Europe. Ecography, 2011, 34(4): 683- 692.
[43] Bieber C, Juškaitis R, Turbill C, Ruf T. High survival during hibernation affects onset and timing of reproduction. Oecologia, 2012,169(1): 155- 166.
[44] Wan X R, Liu W, Wang G H, Zhong W Q. Food consumption and feeding characters ofPhodopusroborovskiion Hunshandake sandy land of Inner Mongolia. Chinese Journal o f Eco logy, 2007, 26(2); 223- 227.
[45] Wang G H, Zhong W Q, Wan X R. Biological habit of desert hamster in the Hunshandake desert in Inner Mongolia. Chinese Journal of Ecology, 2001, 20(6); 65- 67.
[46] Ghalambor C K, McKay J K, Carroll S P, Reznick D N. Adaptive versus non-adaptive phenotypic plasticity and the potential for contemporary adaptation in new environments.FunctionalEcology, 2007, 21(3): 394- 407.
[47] Badyaev A V. Stress-induced variation in evolution: from behavioral plasticity to genetic assimilation. Proceedings of the Royal Society of London Series B Biological Sciences, 2005, 272(1566):877- 886.
[48] Tuomainen U, Candolin U. Behavioral responses to human-induced environmental change. Biological Reviews, 2011, 86(3): 640- 657.
参考文献:
[1] 钟文勤. 啮齿动物在草原生态系统中的作用与科学管理.生物学通报, 2008,43(1):1- 3.
[9] 焦燕, 赵江红, 徐柱. 农牧交错带开垦年限对土壤理化特性的影响.生态环境学报, 2009,18(5):1965- 1970.
[10] 张文丽, 陈世苹, 苗海霞, 林光辉. 开垦对克氏针茅草地生态系统碳通量的影响.植物生态学报, 2008,32(6):1103- 1110.
[13] 靳新霞, 张大铭. 莫索湾垦区啮齿动物群落结构与物种多样性分析. 动物学杂志, 2005,40(6): 30- 37.
[14] 武晓东, 阿娟, 付和平, 金珩. 人为不同干扰条件下荒漠啮齿动物群落格局的动态特征——动物与植物群落的典型相关分析. 生态学报, 2008,28(12):6000- 6017.
[15] 张大铭, 艾尼瓦尔, 姜涛, 蹇友里. 准噶尔盆地啮齿动物群落多样性与物种变化的分析. 生物多样性, 1998, 6(2): 92- 98.
[16] 刘季科, 梁杰荣, 沙渠. 诺木洪荒漠垦植后农田鼠类群落和生物量的变化. 动物学报, 1979, 25(3):260- 267.
[17] 傅和平, 武晓东, 杨泽龙. 阿拉善地区不同生境小型兽类群落多样性研究. 兽类学报, 2005, 25(1):32- 38.
[18] 武晓东, 付和平. 人为干扰下荒漠啮齿动物群落格局——变动趋势与敏感性反应. 生态学报, 2006, 26(3): 849- 861.
[24] 卢浩泉, 马勇, 赵桂芝. 害鼠的分类测报与防治. 北京:农业出版社,1988: 32- 59.
[25] 黄文几, 徐士菊. 中国啮齿类. 上海:复旦大学出版社,1995:99- 267.
[26] 张知彬, 王祖望. 农业重要害鼠的生态学及控制对策. 北京:海洋出版社,1998:22- 23.
[27] 武晓东, 付和平, 杨泽龙. 中国典型半荒漠与荒漠区啮齿动物研究.北京:科学出版社, 2009: 48- 73.
[28] 马勇,王逢贵,金善科,李思华.新疆北部地区啮齿动物的分类和分布.北京:科学出版社,1987: 228- 230.
[38] 赵肯堂. 三趾跳鼠(DipussagittaPallas)的生态研究. 动物学杂志, 1964, (2): 59- 62.
[39] 付和平,武晓东,杨泽龙. 不同干扰条件下荒漠啮齿动物生态位特征. 生态学报,2005, 25(10): 2637- 2643.
[40] 孙儒泳. 动物生态学原理 (第三版). 北京: 北京师范大学出版社, 2001:243- 244.
[44] 宛新荣,刘伟,王广和,钟文勤. 浑善达克沙地小毛足鼠的食量与食性动态. 生态学杂志, 2007, 26(2): 223- 227.
[45] 王广和, 钟文勤, 宛新荣.浑善达克沙地小毛足鼠的生物学习性. 生态学杂志, 2001, 20(6); 65- 67.
Responseandpopulationbionomicstrategiesofdesertrodentcommunitiestowardsdisturbanceofcultivation
YUAN Shuai1,2, FU Heping1,2, WU Xiaodong1,2,*, ZHANG Xiaodong1,2, CHA Muha1,2, ZHANG Fushun3, GAN Hongjun4
1CollegeofEcologyandEnvironmentalScience,InnerMongoliaAgriculturalUniversity,Huhhot010019,China2KeyLaboratoryofPratacultureGrasslandResources,MinistryofEducation,Huhhot010019,China3GrasslandResearchInstitute,ChineseAcademyofAgriculturalSciences,Huhhot010010,China4TheGrasslandResearchStationofAlashan,Bayehot750306,China
Cultivation on grassland ecosystem, as one of the greatest disturbance, is well studied. Grassland cultivation, especially in desert region, often results in habitat fragmentation, and subsequently affects plant and animal communities. Under intensive disturbance, the responses of rodent species with different bionomic strategies to environmental change could play a key role in determining structure of their communities. Few literatures on Chinese western desert have focused on the impacts of cultivation on rodents. A study was conducted from 2006 to 2011at cultivated and non-cultivated sites to investigate effect of cultivation on rodent community diversity, community structure with different bionomic strategies, and their population abundance in Alashan, Inner Mongolia, China. We expected that rodents withrstrategy will dominate in cultivated site, whileKstrategists will dominate in non-cultivated site. Rodent communities monitoring using live trapping method showed that cultivation significantly decreased Shannon-Wiener index and Simpson index, but did not affect Pielou evenness index. In the cultivated site, species richness and population abundance of rodents withrstrategy were higher than those ofKstrategy. In non-cultivated site, rodent population abundance was lower forrstrategists thanKstrategists. ABC curve analysis showed that cumulative dominance of species abundance was higher cumulative dominance of species biomass in cultivated site. The results suggested that cultivation had a negative impact on the rodent community diversity, and severely disturbed rodent community, therefore, excluded or decreased rodents withKstrategy. Our results supported our hypothesis that rodents withrstrategy will be dominant in communities in cultivated site.
rodent community; disturbance; bionomic strategies; biodiversity; desert
国家自然科学基金项目(30160019,30560028,30760044,31160096)
2012- 11- 28;
2013- 04- 01
*通讯作者Corresponding author.E-mail: wuxiaodong_hgb@163.com
10.5846/stxb201211281691
袁帅,付和平,武晓东,张晓东,查木哈, 张福顺,甘红军.荒漠啮齿动物群落对开垦干扰的响应及其种群生态对策.生态学报,2013,33(20):6444- 6454.
Yuan S, Fu H P, Wu X D, Zhang X D, Cha M H, Zhang F S, Gan H J.Response and population bionomic strategies of desert rodent communities towards disturbance of cultivation.Acta Ecologica Sinica,2013,33(20):6444- 6454.
