细胞培养过程中支原体污染的检测及预防
2013-12-16邢丽波
桂 馨,钱 洁,许 洁,邢丽波
(同济大学医学与生命科学实验教学中心,上海 200092)
细胞培养技术是一种体外增殖细胞的常规实验技术,目前被广泛用于教学、科研和临床实验。污染控制是细胞培养能否成功的关键所在。引起培养细胞污染的微生物有细菌、霉菌、黑胶虫、支原体等,其中支原体是常见的污染物。
支原体属于缺乏细胞壁的原核微生物,直径约0.13~0.18 μm,大小介于细菌和病毒之间,可透过一般滤膜(0.22 μm),因此在细胞培养过程中,细胞极易受到支原体污染。已有许多调查及研究显示,世界范围内正在使用的细胞体系中支原体污染发生率达到30%~60%[1-3]。中国医学科学院基础医学研究所检测过的国内来源的细胞株系,支原体污染率高达60%[4]。支原体感染发生后培养液清澈不浑浊,但pH值变化明显,培养液更换后几小时内变为酸性(颜色变黄)。污染初期,显微镜高倍镜下观察发现细胞外形无明显变化但有细小黑色颗粒,所以不容易被发现。虽然支原体可以与细胞长期共存,且随着细胞换液而缓解,但细胞遭受支原体污染后会抑制细胞生长,改变细胞的DNA/RNA及蛋白表达,使细胞的转染效率大大降低,并在污染后期引起细胞变形,对后续教学、科研产生严重影响。因此在细胞培养过程中进行支原体检测十分必要。
目前,检测细胞培养物中的支原体有多种方法,常用的有DNA荧光染色法、支原体培养、ELISA(enzyme-linked immunosorbent assay)、电镜和聚合酶链反应(PCR)等[5-7]。其中PCR法通过对支原体特异性片段的扩增及电泳分析快速灵敏地检出支原体。而DNA荧光染色是利用Hoechst 33342染料能将支原体染色,并在紫外光的激发下显色,从而在形态学上直观地观察到支原体。本研究将荧光染色法和PCR方法相结合,快速检测细胞培养中的支原体污染,并对如何预防进行了探讨。
1 材料与方法
1.1 材料
1.1.1 细胞 待测细胞1为实验室传代 Hela细胞;待测细胞2为复苏(批号110914)实验室冻存Hela细胞。
1.1.2 主要试剂 Hoechst 33342购自美国sigma公司;细胞培养液RPMI 1640购自美国HyClone公司;小牛血清购自法国Biowest公司;支原体检测试剂盒购自杭州华安生物;MarkerIII、100 bp、50 bp DNA Ladder、2×Taq PCR MasterMix均购自天根生化科技;其他试剂购自国药集团化学试剂有限公司,为分析纯产品。
1.1.3 引物设计与合成 选择16SrRNA支原体种属特异性区域作为扩增区,定制支原体通用引物。上游引物(GPO):5'-tgc acc atc tgt cac tct gtt aac ctc-3';下游引物(MGSO):5'-ggg agc aaa cag gat tag ata ccct-3',由上海生工生物技术有限公司合成。
1.2 方法
1.2.1 荧光染色法 将待测细胞分别培养于Φ3 cm培养皿中,细胞长到70%~80%时进行荧光检测。首先,各组细胞用PBS清洗2次,每次1 min,4%多聚甲醛(PBS配制)室温固定20 min,再以含5 μg/ml Hoechst 33342染料的PBS溶液进行染色,5 min后吸去染液,PBS洗涤一次,加入少量PBS使细胞保持湿润,在荧光显微镜下观察细胞。
1.2.2 PCR 法
1.2.2.1 支原体通用引物检测 取1 ml待测细胞1和2培养细胞上清液、培养液和小牛血清(培养细胞所用试剂),若细胞较多可1 000 r/min离心3 min以沉积细胞碎片;取上清液13 000 r/min离心10 min以沉淀支原体;倒去上清,保留少量液体后重悬;95℃煮沸15 min;取2 μl液体作为模板;浓度10 μmol正反引物各 1 μl;2 × PCR MaterMix 12.5 μl;ddH2O 8.5 μl为一个反应体系(共 25 μl/管)。参照以下参数进行PCR扩增:预变性94℃10 min;34个循环(94℃for 1 min;55℃for 30 s;72℃for 30 s);延伸 72 ℃for 1 min。取10 μl PCR扩增产物,用2%琼脂糖凝胶电泳,100 V电泳60 min;EB染色观察结果。
1.2.2.2 试剂盒检测 阳性质控、阴性质控均为试剂盒自带,培养液、小牛血清为培养细胞所用的试剂,取待测细胞1和2(用细胞刮刀刮取细胞)150 μl(约含1~3×105个细胞)至离心管,沸水浴10 min。将煮沸过的细胞悬浮液12 000 r/min离心2 min~5 min;每个PCR反应管取样品上清4 μl作为PCR反应模板,加入PCR反应液(含有引物、dNTP等),Taq酶1 μl作为一个反应体系。DNA阳性对照和阴性对照各加入4 μl/管;将所有PCR反应管放入PCR仪,参照以下参数运行;预变性94℃ 5 min;30个循环(94℃for 30 s;56℃for 30 s;72℃for 45 s);延伸72℃for 5 min。取5 μl PCR扩增产物,用2%琼脂糖凝胶电泳,100 V电泳60 min;EB染色观察结果。
2 结 果
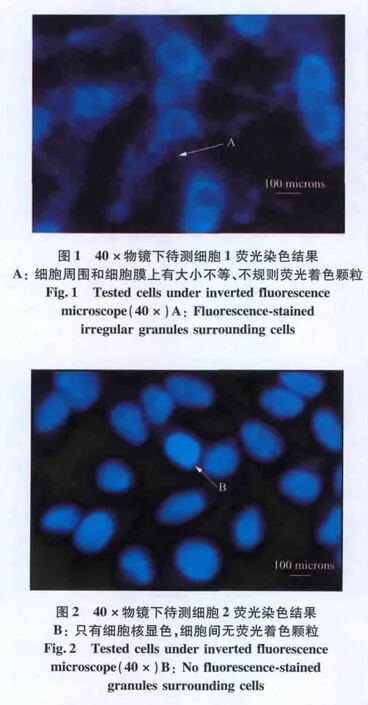
2.1 荧光染色结果
Hoechst 33342是一种可透过细胞膜并对DNA染色的细胞核染色试剂。荧光染色法检测支原体污染,就是利用Hoechst 33342可与双链DNA结合,在紫外光的激发下,释放强烈的蓝色荧光这一特点对细胞加以染色。经过染色,在荧光显微镜下,可见待测细胞1的细胞周围或细胞膜上有大小不等、不规则荧光着色颗粒,推测为支原体污染细胞(图1),而待测细胞2只有细胞核显色,推测为未污染细胞(图2)。由于荧光染色法可能出现假阳性和假阴性,所以对于支原体污染的判定还需要用PCR法进一步判定。
2.2 PCR 结果
实验中分别对待测细胞1和待测细胞2进行PCR反应,用定制引物的PCR扩增,电泳结果显示(图3),待测细胞1在280 bp处有特异性条带,提示该细胞被支原体污染;待测细胞2、培养基及小牛血清则无特异性条带,提示无支原体污染。为了进一步确认实验结果,用支原体检测试剂盒按说明书对样品再做了一次PCR扩增(图4),结果阳性质控在280 bp处有特异性条带,阴性质控则无,表明实验试剂是可靠的。待测细胞1在与阳性质控相同位置(280 bp)出现特异性条带,确认为支原体污染细胞,而待测细胞2、培养基、小牛血清电泳后未有条带出现,判为支原体阴性。

通过Hoechst 33342荧光染色和PCR联合检测得到结果:待测细胞1为支原体污染细胞;待测细胞2为无支原体污染细胞,支原体阳性检出率50%。
3 讨 论
支原体是一种介于细菌与病毒之间的一种微小生物,可与细胞共存,是细胞培养较常见的一种污染物。Hoechst 33342荧光染料能使支原体染色,通过紫外光激发使支原体污染易于观察。在支原体污染初期,荧光染色效果可能不明显,出现假阴性结果;而细胞碎片也可被Hoechst 33342染色,被误认为是支原体感染,出现假阳性。PCR检测法虽然快速灵敏[8],由于支原体特异性引物与衣原体具有同源性,会使PCR检测法出现假阳性结果[9]。目前除了上述支原体检测方法,国内外学者还建立了支原体直接培养法、ELISA和电镜法等一系列检测方法。这些方法各有特点,但也存在实验周期长、敏感性低、出现非特异性结果等各种不足,而本实验室将荧光染色和PCR法相结合的方法检测待检细胞,能弥补使用单一检测方法的局限性,又能简便、快速、灵敏地检测支原体,并大大提高支原体检测的准确率。
细胞发生支原体污染,无论采取何种补救措施,效果都不甚理想。若经过大剂量抗生素处理,对细胞损伤较大,使细胞原有的许多生物学特性,如基因表达、抗原性和代谢特点发生相应的改变,对后续教学实验和科研结果造成严重影响。细胞培养工作中预防支原体污染尤为重要,本实验室长期采用以下几点来控制支原体污染。
(1)保持操作环境清洁:无菌室的滤膜要定期清洗和更换;每次进行细胞培养操作前,无菌室和超净台都要用紫外和臭氧彻底消毒灭菌;每次实验完毕要用消毒水浸泡的抹布擦拭操作台,避免交叉污染;定期对二氧化碳培养箱进行消毒灭菌。
(2)实验用品无菌处理:所有用品都要经过高温消毒灭菌;培养基、血清、胰酶等试剂均要经过检测确定无支原体污染后方可使用。
(3)操作者遵守无菌室消毒规定:由于正常人口腔带有支原体,因此进入无菌室一定要带好口罩、帽子(口罩必须罩住口鼻,帽子必须将头发全遮在里面),鞋套,穿隔离衣,带乳胶手套,并用75%酒精擦拭手套表面。
(4)操作过程严格按照无菌操作要求:开始要先用75%用精棉球擦拭瓶口,在火焰上烧灼瓶口,必须在火焰周围无菌区内打开瓶口,瓶口要再次转动烧灼[10];操作时尽量不要讲话;要常更换吸管,一旦发现吸管触及手和其他物品应弃去。所有操作过程要在距离超净台边缘10 cm以内的无菌区域进行。
(5)定期进行支原体污染检测[11-12]:对实验室中的培养物定期进行支原体检测,预防为主,不能等到发现有支原体污染时再进行检测,发现已经污染支原体的培养物,灭活后弃之,严禁随意倾倒、随意丢弃。及时更换新的培养物,避免支原体污染。
[1] Morozkin ES,Sil’nikov VN,Rykova EY,et al.Extracellular DNA in culture of primary and transformed cells,infected and notinfected with Mycoplasma[J].Bull Exp Biol Med,2009,147(1):63-65.
[2] Uphoff CC,Drexler HG.Detection of mycoplasma contaminations[J].Methods Molecular Biol,2013,946:1-13.
[3] 余华,杜永凤.DNA荧光染色法和培养法在支原体检测中的比较[J].安徽农业科学,2010,38(8):4039-4041.
[4] Degeling MH,Maguire CA.Sensitive assay for mycoplasma detection in mammalian cell culture [J].Analytical Chem,2012,84(9):4227-4232.
[5] Volokhov DV,Graham LJ.Mycoplasma testing of cell substrates and biologics:Review of alternative nonmicrobiological techniques[J].Molecular Cellular Probes,2011,25(2-3):69-77.
[6] 甘一迪,王银银.培养细胞污染支原体的PCR检测方法的建立及应用[J].中国医药生物技术,2011,06(4):295-298.
[7] Winchell JM,Mitchell SL.Detection of Mycoplasma pneumoniae by real-time PCR[J].Methods Molecular Biol,2013,946:149-158.
[8] 李臻.聚合酶链反应在慢性泌尿系统及性病诊断中的应用[J].同济大学学报:医学版,2002,23(3):249-250.
[9] Viola M,Jan MK,Matthias P,et al.Sequence homologies between mycoplasma and chlamydia spp.lead to false-positive results in chlamydial cell cultures tested for mycoplasma contamination with a commercial PCR Assay[J].J Clin Microbiol,2011,49(10):3681-3682.
[10] 曹忠玲.大规模细胞培养中控制污染的举措[J].中国兽医杂志,2010,44(2):56-58.
[11] Uphoff CC,Denkmann SA,Drexler HG.Treatment of mycoplasma contamination in cell cultures with plasmocin[J].J Biomed Biotechnol,2012,2012:506159.
[12] Molla KV,Shokrgozar MA,Arabestani MR,et al.PCR-based detection and eradication of mycoplasmal infections from various mammalian cell lines:a local experience[J].Cytotechnology,2009,61(3):117-124.
